Pdots-RVG-Curcumin纳米复合物穿透体外血脑屏障模型的研究*
文欣宜,苏炳银,李淑蓉△,韩玉萍△
1.成都医学院 发育与再生四川省重点实验室(成都 610500);2.成都医学院 病理学与病理生理学教研室(成都 610500);3.成都医学院 组织胚胎学教研室(成都 610500)
血脑屏障(blood brain barrier,BBB)是存在于血液和中枢神经系统之间的屏障结构,由脑微血管内皮细胞及内皮细胞间的紧密连接、星形胶质细胞足突、基底膜和周细胞组成[1]。BBB一方面起神经保护作用,保证中枢神经系统较少被外来物质侵扰,维持高度的稳态,同时为脑内输送营养物质;另一方面,BBB也阻碍了用于脑部疾病诊断和治疗的药物通过非侵入性给药方式进入脑内。因此,通过各种手段对药物进行结构等方面的修饰,使药物能够穿越BBB[2],进入脑组织发挥药效,是近些年研究者重点关注的方向。脑靶向生物相容性高的纳米生物载体可以在分子水平上解决这个问题。
理想的脑靶向药物系统包括治疗性药物、药物载体、靶向分子三部分。姜黄素(curcumin, Cur)是从姜黄根茎中提取的一种多酚类物质,有着广泛的药理作用,如抗炎、抗氧化,抗肿瘤、抗动脉粥样硬化等[3-6],近年来逐渐用于神经退行性疾病的治疗。然而,由于Cur在体内半衰期短、口服吸收差、化学性质不稳定,导致其生物利用度较低,限制了Cur在临床上的运用。半导体聚合物量子点(semiconducting polymer dots, Pdots)经修饰后可用作靶向药物载体,提高药物的靶向运输能力,延长药物的半衰期,增强药物的治疗作用,同时减小药物的毒性。Pdots的疏水性使其具有载体屏蔽作用,药物被包覆在Pdots内部,或者与Pdots共价连接[7]。狂犬病病毒衣壳中包含有嗜神经性蛋白质(rabies virus glycoprotein, RVG),能被神经元表面表达的尼古丁乙酰胆碱受体特异性识别。在RVG的作用下,狂犬病病毒很容易越过BBB,侵袭脑组织和神经中枢,引起狂犬病发作[8]。本研究通过构建Pdots-RVG-Cur纳米复合物以及体外BBB模型,探讨Pdots-RVG-Cur穿透BBB靶向神经元的作用。
1 材料与方法
1.1 材料
小鼠中脑多巴胺能神经元细胞系(MN9D)、小鼠脑微血管内皮细胞系(b.End3)由中国科学院典型培养物保藏委员会细胞库提供,高糖DMEM、DMEM/F12培养基、胎牛血清、双抗(青霉素+链霉素)、0.25%胰酶均购自美国Gibco公司,超滤离心管(0.5 mL/100 kd)、0.22 μm亲水PVDF微孔滤膜、悬挂式细胞培养小室(PET 3 μm, 24-well)均购自美国Millipore公司,二甲基亚砜(dimethyl sulfoxide, DMSO)、9,9-二辛基聚芴苯并噻二唑交替共聚物(F8BT)、四氢呋喃(tetrahydrofuran,THF)、Cur、多聚甲醛、聚苯乙烯-马来酸酐 (poly styrene-co-maleic anhydride, PSMA)均购自德国sigma-aldrich公司,RVG29-Cys购自上海吉尔生化公司,抗荧光淬灭剂(4′,6-二氨基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、羟乙基哌嗪乙硫磺酸(HEPES)购自上海碧云天公司,CCK-8试剂盒购自日本同仁公司,不含酚红DMEM高糖培养基购自美国博士德公司,荧光素钠购自上海阿拉丁公司,鼠尾Ⅰ型胶原、细胞培养皿均购自美国Corning公司。
1.2 材料制备
1.2.1 Pdots的制备 采用纳米共沉淀的方法制备Pdots。将0.75 mg共轭聚合物F8BT、0.187 mg两亲性聚合物PSMA溶解于3 mL THF,将混合液迅速加入正在超声的双蒸水中,继续超声20 min直至溶液澄清透亮。将溶液置于通风橱,通风过夜以蒸发溶液中多余的THF。将得到的溶液用100 KDa超滤管离心提纯。最后,将提纯后的溶液通过0.22 μm的膜过滤得到浓度为250 mg/L的Pdots原液。密封,置于4 ℃冰箱避光保存。
1.2.2 Pdots-RVG的制备 将Pdots与RVG按照1∶1 000 mol/L比例混合,若要配置1 mL含Pdots-RVG的培养基,按照以下比例混合:Pdots原液100 μL、HEPES(1 mol/L) 15 μL、RVG(1 mmol/L)8.8 μL、含2% FBS的细胞培养基876.2 μL。按照顺序依次加入,每步充分混合。其中,加入RVG后要充分混合20 min后再加入培养基。Pdots-RVG混合液现用现配,尽量避光操作。
1.2.3 Cur母液及Pdots-RVG-Cur的配制 Cur溶解于无水乙醇中,配制成浓度为10 g/L的Cur溶液。将合成好的Pdots-RVG与一定量的Cur溶液混合,室温下摇床轻微摇晃2 h以充分混匀,制备Pdots-RVG-Cur。
1.3 材料的表征
1.3.1 透射电子显微镜(transmission electron microscope, TEM)下观察纳米颗粒的形态 取50 μL样品滴加到铜网上,干燥后在TEM下对其形貌进行表征。其中Pdots-RVG、Pdots-RVG-Cur经过磷钨酸染色。
1.3.2 动态光散射技术(dynamic light scattering, DLS)检测纳米颗粒粒径及稳定性分析 将样品稀释到合适的倍数,用纳米粒度仪测量,采集数据,获得其平均水力学直径及多分散系数(particle dispersion index, PDI)。将样品室温放置24、48 h后采集数据。
1.4 CCK-8检测细胞存活率
MN9D细胞和b.End3细胞培养至对数生长期后分别接种于96孔板,分为空白组、对照组、实验组,空白组不含细胞。实验组分别加入含不同浓度Pdots-RVG混合液(Pdots浓度为10~50 mg/L,RVG的浓度按照方法1.2.2相应增加)的培养基,37 ℃,5%CO2培养箱孵育48 h。吸除培养基,每个孔内加入含10% CCK-8试剂的培养基,避光孵育1.5 h。用酶标仪测定450 nm处的吸光度值,根据公式计算细胞存活率。细胞存活率(%)=(A给药-A空白)/(A对照-A空白)×100%。
1.5 BBB体外模型的建立
取足够数量的悬挂式细胞培养小室置于24孔板内。小室上层加100 μmol/L鼠尾胶原Ⅰ,湿润小室20 min后吸出,超净工作台1级风干6 h,风干成胶。将b.End3接种在涂有鼠尾胶原Ⅰ的小室的PET膜上,小室下层加500 μL高糖DMEM培养基以高过PET膜水平面。接种细胞当天,12 h后更换小室上层培养基,以后隔天换液。
1.6 BBB体外模型的评价
1.6.1 4 h渗漏实验 细胞贴附在PET膜上后,在小室上层加入300 μL高糖DMEM细胞培养基,在小室下层加入500 μL高糖DMEM细胞培养基以高过上层液面(具有>0.5 cm的液面差)。置于细胞培养箱培养4 h,取出观察小室上、下层液面差变化。当4 h后液面差没有明显变化时,说明形成了较为致密的细胞层,行下步荧光素钠(fluorescein sodiu,FLU)通透性实验。
1.6.2 FLU通透性实验 测定1.000、0.500、0.250、0.125、0.063 g/L FLU溶液在530 nm处的吸光度值,绘制FLU标准曲线。细胞小室上层加300 μL含1 g/L FLU的无酚红DMEM培养基,下层加入无酚红DMEM培养基,加入的量以保持上、下液面相平为准。培养2 h后,分别从上、下室中取100 μL溶液,加入到96孔板中,酶标仪测溶液在530 nm处的吸光度,利用标准曲线计算FLU浓度。以未加入b.End3细胞的小室作为空白对照组,4 h试漏实验成功的b.End3细胞小室为模型组,比较两组FLU通透率差异。小室FLU通透率=(下室FLU浓度×下室培养液体积)/(上层FLU浓度×上室培养液体积)×100%。
1.7 观察BBB模型中MN9D细胞对药物的摄取情况
将MN9D细胞接种于带有细胞爬片的24孔板内,将成功建立BBB体外模型的悬挂式细胞小室移至其内(图1)向小室上层分别加入DMEM/F12培养基、含20 μmol/L Cur的培养基、含相同Cur浓度的Pdots-RVG-Cur的培养基,共孵育48 h。培养结束后,移去小室,MN9D细胞爬片PBS洗3次。4%多聚甲醛避光固定细胞20 min。将细胞爬片有细胞的一面朝下盖在滴有抗荧光淬灭剂(含DAPI)的载玻片上,通风橱避光通风,风干后后立即用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观察。
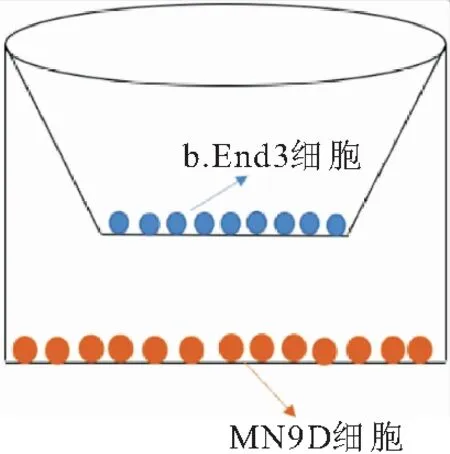
图1 体外BBB模型图
1.8 统计学方法

2 结果
2.1 Pdots、Pdots-RVG、Pdots-RVG-Cur的表征
2.1.1 TEM下观察纳米颗粒的形貌 TEM下观察Pdots的外貌呈相对均匀的球形,粒径在0.10 μm左右。Pdots-RVG、Pdots-RVG-Cur同样呈球形,粒径分别在0.20、0.33 μm左右(图2), 表明Pdots-RVG载药结构具有稳定性。
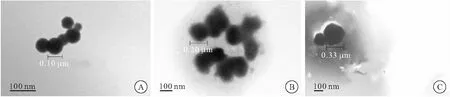
图2 TEMF观察Pdots、Pdots-RVG、Pdots-RVG-Cur的形态
2.1.2 DLS测试纳米颗粒粒径及及稳定性分析 PDI表示粒径分布的离散程度,PDI越小,说明粒子大小分布越集中,粒径表征时PDI的最佳范围为0.08~0.70。测量Pdots、Pdots-RVG、Pdots-RVG-Cur的PDI分别为0.206、0.217、0.308,纳米粒子分散均匀,粒径测量结果可靠。Pdots平均粒径为98.4 nm, Pdots-RVG平均粒径为214.8 nm, Pdots-RVG-Cur平均粒径为317.2 nm(图3)。这与TEM下观察到的粒子粒径相符合。24、48 h再进行DLS测量。结果显示,随着时间推移,Pdots、Pdots-RVG、Pdots-RVG-Cur的粒径分别相对稳定在95、250、320 nm左右,说明三者在溶液中稳定性均良好(表1)。
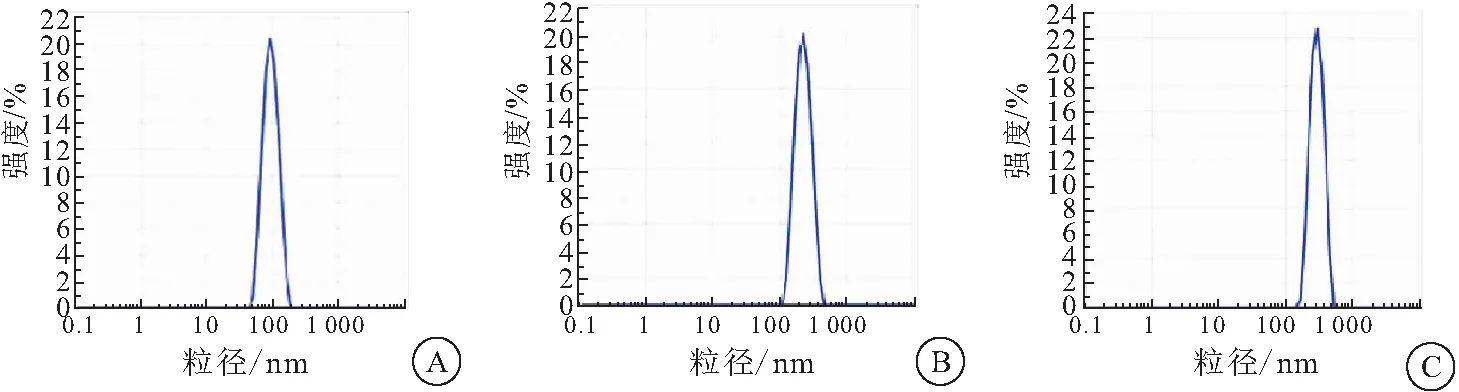
图3 Pdots、Pdots-RVG、Pdots-RVG-Cur的粒径分布图
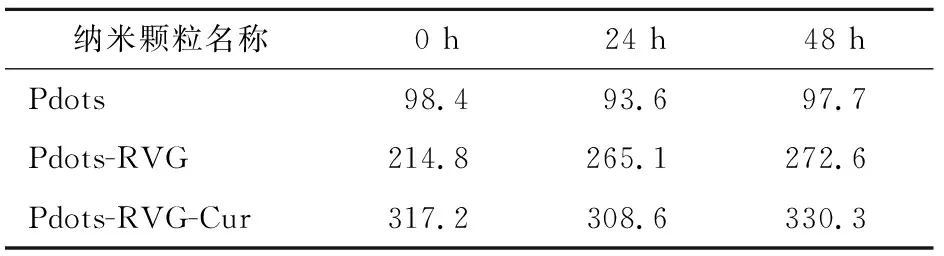
表1 Pdots、Pdots、Pdots-RVG-Cur不同时间点的粒径(nm)
2.2 纳米材料的生物相容性
为了研究Pdots-RVG作为载药体的细胞毒性,用浓度梯度的Pdots-RVG处理MN9D细胞和b.End3细胞48 h,用CCK-8分别检测两种细胞的存活率。结果发现,随着药物浓度的增加,两种细胞的存活率均下降。在10 mg/L时,MN9D细胞和b.End3细胞的存活率分别为95.1%、94.8%,均高于90.0%。当药物浓度达到50 mg/L时,MN9D细胞和b.End3细胞的存活率分别为84.5%、80.2%,仍高于80.0%(图4)。Pdots-RVG表现出较低的细胞毒性。
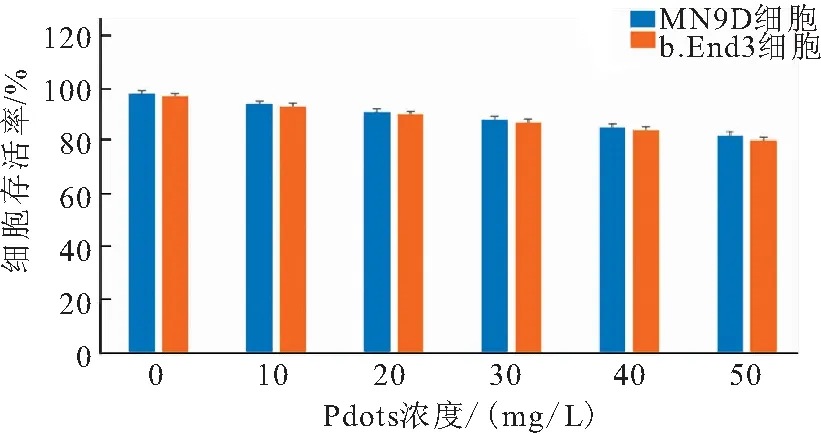
图4 不同浓度Pdots-RVG对细胞的损伤作用
2.3 BBB体外模型的建立与评价
将b.End3细胞以每孔8×104个/cm2的密度接种在涂有鼠尾胶原Ⅰ的小室的PET膜上,12 h后光镜下观察到小室内无悬浮细胞,说明细胞已贴附生长在PET膜上,此后每隔24 h行一次4 h试漏实验。
2.3.1 4 h试漏实验 细胞贴膜生长后,每隔24 h行1次4 h试漏实验。观察到在细胞接种第96 h时,4 h试漏实验结果显示,模型组小室内外液面差在4 h后能保持相对稳定,且>0.5 cm, 而未接种细胞的空白对照组4 h后,小室内、外液面差消失,内外液面齐平(图5)。结果说明此时细胞已生长融合足够紧密,形成了致密的细胞层,对液体有一定的屏障作用,阻隔了液体间的流动。将此小室用于下步FLU通透性检测。

图5 4 h试漏实验
2.3.2 FLU通透性检测 由FLU标准曲线可知, FLU浓度与其吸光度值有较好的相关性,可以通过吸光度值间接反映FLU的浓度(图6 A)。根据标准曲线及通透率计算公式计算两组的通透率,模型组FLU通透率48.52%,对照组FLU通透率90.67%(图6 B)。模型组通透性明显低于空白对照组(P<0.001),说明模型对小分子物质具有一定的阻隔作用,模型组具有较低的通透性,体外BBB模型建立成功,用于下步细胞摄取Cur、Pdots-RVG-Cur的实验。
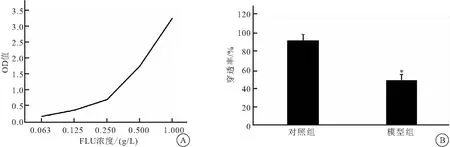
图6 荧光素钠通透性测试
2.4 药物透过BBB体外模型被神经元摄取情况
将成功建立BBB体外模型的细胞小室移至种植有MN9D细胞的24孔板内。向小室上层分别加入培养基、含Cur的培养基、含相同Cur浓度的Pdots-RVG-Cur的培养基,孵育48 h后,于CLSM下观察MN9D细胞对药物的摄取情况(图7)。Cur和Pdots-RVG-Cur均能穿过BBB模型进入小室下层被MN9D细胞摄取,且Pdots-RVG-Cur组细胞显示出比相同浓度游离的Cur组细胞更强的红色荧光。结果表明Pdots-RVG-Cur和游离的Cur均能透过体外BBB模型,用Pdots-RVG包裹Cur相比于游离Cur更容易被细胞摄取,Pdots-RVG增加了Cur的生物利用度;这可能是因为Pdots的包裹提高了疏水性Cur的溶解度和分散性,而RVG不仅能与神经元上特异受体结合,使纳米颗粒进入神经元,还可以介导纳米颗粒穿过BBB。
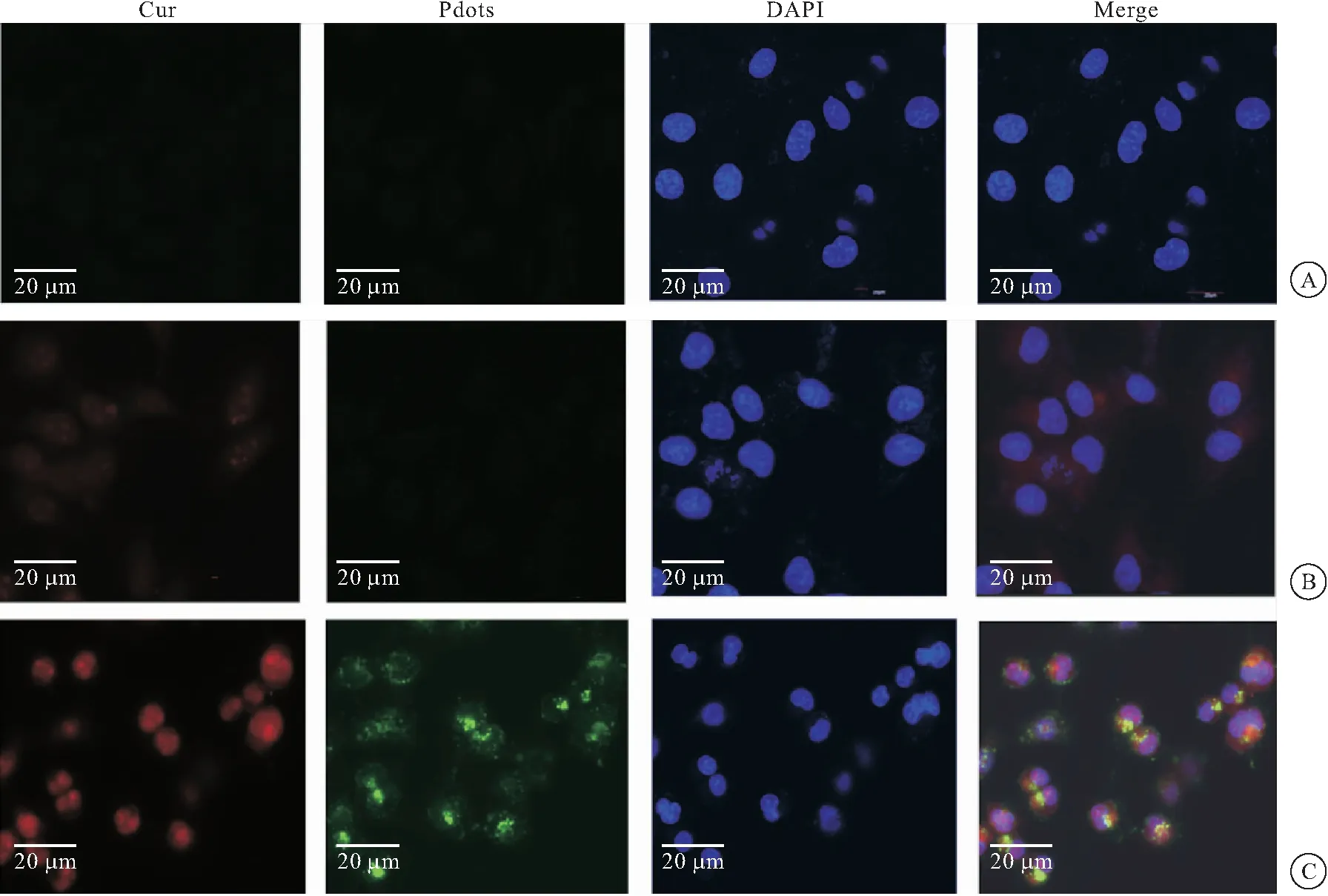
图7 CLSM下观察体外BBB模型中MN9D细胞对药物的摄取情况
3 讨论
随着我国人口老龄化程度逐年加重,阿尔兹海默病、帕金森病、肌萎缩侧索硬化等神经退行性疾病的发病人群逐年增加[9-10]。中枢神经系统疾病的治疗进展缓慢,主要的障碍之一是由于血脑屏障限制了治疗药物向中枢神经系统的有效递送。因此,开发各种载药系统,使药物能穿过血脑屏障进入脑部病灶部位发挥疗效是神经系统疾病治疗的研究热点。
在靶向脑药物的开发领域中,纳米材料由于其生物学特性而具有独特的优势。Pdots作为一种新型的纳米探针,拥有作为药物载体的开发潜力。首先,Pdots具有低毒性,较高的生物相容性,保证了其药物安全性。其次,Pdots具有疏水性,可利用载体的屏蔽作用包裹并保护药物。除此之外,Pdots表面带电荷,使得其易于与药物结合。同时,Pdots还拥有较高比表面积(即单位质量物料所具有的总面积),提示其作为药物载体能获得较高的药物载量[11-18]。然而将其作为药物载体的研究目前并不多。本研究选用Pdots作为药物载体装载靶向分子RVG以及治疗性药物Cur,通过本实验验证了Pdots具有较稳定的载药结构、较低的细胞毒性以及较好的BBB穿透性。
开发有效的穿透BBB靶向脑的药物递送系统,除了要有药物载体之外,还要有脑靶向递送策略。药物递送入脑主要有以下3种方式:1)吸附介导的跨血脑屏障转运;2)细胞穿膜肽介导的跨BBB转运;以上两种方法都并不是特异靶向到脑部。3)受体或转运体介导的转胞吞实现跨BBB转运。RVG29是近年来新发现的一种存在于狂犬病毒糖蛋白上一段29个氨基酸序列的多肽,该段多肽能被神经元表面表达的尼古丁乙酰胆碱受体特异性地识别最终使得狂犬病毒穿过BBB[19-20]。本研究构建的Pdots-RVG-Cur载药系统中,RVG29作为靶向递送分子,发挥了协助药物穿透BBB,并增强神经元对药物的摄取的作用。
本研究通过构建上层为BBB模型,下层为MN9D细胞的体系,探究向上层加药物后,下层细胞内是否能观察到此药物,以此模拟药物在人体内透过血脑屏障进入神经元的过程。本实验结果表明,Pdots-RVG-Cur和游离的Cur均能透过体外BBB模型,但用Pdots-RVG包裹Cur后,相比于游离Cur,穿透BBB并被细胞摄取Cur的量更多。这说明Pdots-RVG作为载药体,提高了Cur的生物利用度,揭示Pdots的包裹提高了疏水性Cur的溶解度和分散性,从而提高Cur在溶液中的稳定性。并且,RVG作为脑靶向分子,能够增加药物系统穿透BBB效率。
综上所述,选用RVG29作为脑靶向分子,将其与作为载体的Pdots相连接,建立Pdots-RVG药物递送系统,并装载神经保护性药物Cur,利用RVG29与BBB上受体结合介导的穿胞作用以及Pdots的药物包封作用,实现将Cur载药系统转运至脑部的效果,为后续开发Cur类神经治疗性药物提供新的思路。

