肉品中食源性致病菌检测技术研究进展
倪皓洁 周芷卉 傅玲琳 王翀 张德权 王彦波 李欢

摘 要:肉品易受食源性致病菌污染,是食品安全监管的重点。借由现代检测技术快速可靠的鉴别及检验肉品中的食源性致病菌具有重要的现实意义。本文在总结肉品典型致病菌污染现状的基础上,重点综述了分子诊断法、免疫分析法、光谱检测法及电子鼻检测法等致病菌检测技术研究进展,在分析现有技术存在的主要问题的同时,对其未来发展方向进行了展望,旨在为肉品中食源性致病菌检测技术的完善及提升提供参考与借鉴。
关键词:肉品;食源性致病菌;分子诊断法;免疫分析法;光谱技术;电子鼻
Advances in Detection Technologies for Foodborne Pathogenic Bacteria in Meat
NI Haojie1, ZHOU Zhihui1, FU Linglin1, WANG Chong1, ZHANG Dequan2, WANG Yanbo1, LI Huan1,*
(1. School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China;
2.Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, National Risk Assessment Laboratory of Agro-products Processing Quality and Safety, Ministry of Agriculture and Rural Affairs, Beijing 100193, China)
Abstract: Meat is subject to contamination by foodborne pathogenic bacteria, which has become one of the key points of food safety supervision and management. It is of great significance to identify and detect foodborne pathogenic bacteria in meat quickly and reliably by modern detection technology. Beginning with the current status of meat pollution by typical foodborne pathogenic bacteria, this paper reviews the currently available technologies for the detection of pathogenic bacteria such as molecular diagnosis, immunoassay, spectroscopy and electronic nose. The limitations and prospects of the detection technologies are also discussed. The review is expected to offer references for improving the limitations and developing new detection technologies.
Keywords: meat; foodborne pathogenic bacteria; molecular diagnosis; immunoassay; spectral analysis; electronic nose
DOI:10.7506/rlyj1001-8123-20210309-059
中图分类号:TS207.4 文献标志码:A 文章编号:
引文格式: 倪皓洁, 周芷卉, 傅玲琳, 等. 肉品中食源性致病菌检测技术研究进展[J]. 肉类研究, 2021, 35(3): . DOI:10.7506/rlyj1001-8123-20210309-059. http://www.rlyj.net.cn NI Haojie, ZHOU Zhihui, FU Linglin, et al. Advances in detection technologies for foodborne pathogenic bacteria in meat[J]. Meat Research, 2021, 35(3): . DOI:10.7506/rlyj1001-8123-20210309-057. http://www.rlyj.net.cn
我国是肉类生产和消费大国。据统计,2019年肉类总产量高达7758.8万t,居民人均肉类和禽类食品消费量分别为26.9 kg和10.8 kg[1]。然而,肉品因营养丰富,极易遭受食源性致病菌的污染,诱发各类食源性疾病。研究表明,食源性致病菌等微生物引起的食品安全问题依然突出,引起的发病人数最多,2015年除西藏、台湾外中国地区爆发的食源性疾病事件中,由微生物因素引起的发病人数高达51.5%[2]。因此,有效的预防和控制肉品中食源性致病菌的感染与传播具有重要的现实意义。
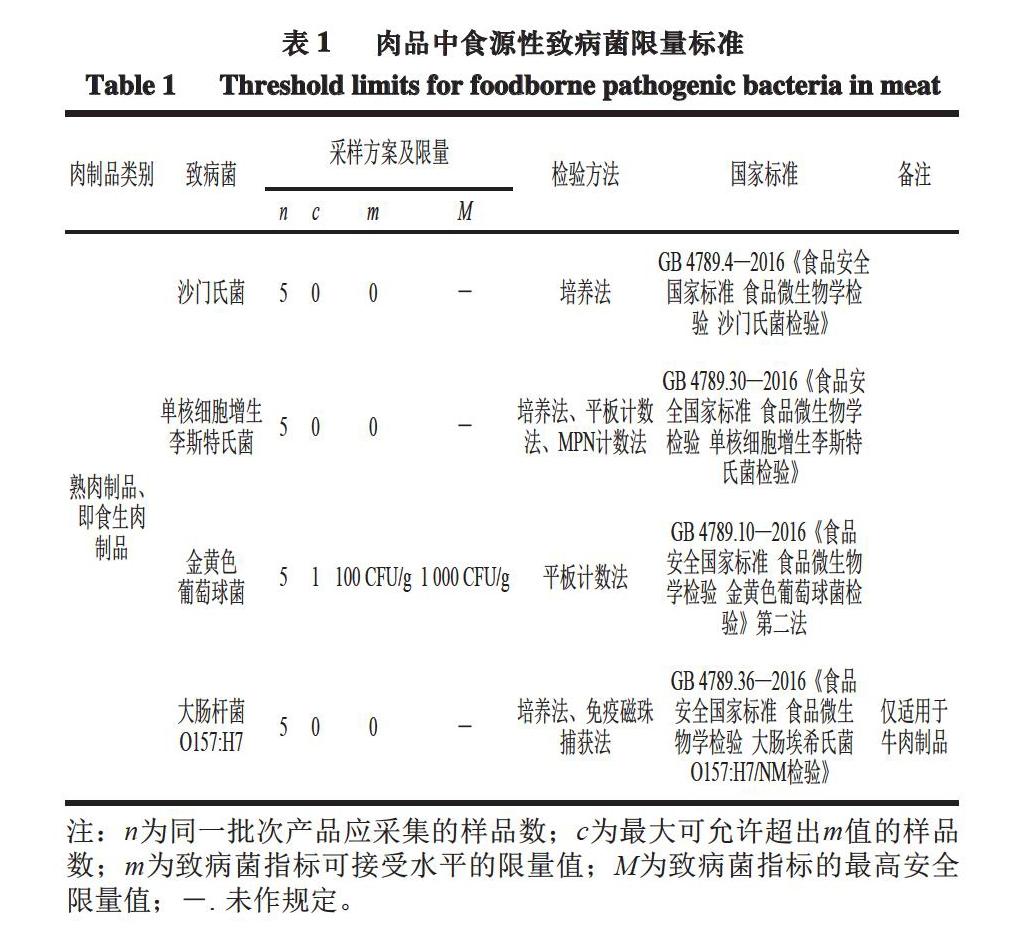
肉品中常见的食源性致病菌有沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌、致病性大肠杆菌、产气荚膜梭菌及空肠弯曲杆菌等[3-4]。食用被食源性致病菌污染的肉品时,易引起恶心呕吐、腹泻、发烧、胃肠炎等,更甚者引发死亡。我国对肉品中食源性致病菌的限量标准如表1所示。建立高效、准确、灵敏的肉品中致病菌检验检测方法,对于预防相关食源性疾病的发生和流行至关重要,也是肉类产业高质量发展的迫切需要。鉴于此,本文在综述肉品典型食源性致病菌污染现状的基础上,着重介绍了分子诊断、免疫分析、光谱检测和電子鼻检测等肉品中致病菌检测技术的发展现状及应用,分析其存在的主要问题,并对未来的发展方向进行展望,以期为肉品中食源性致病菌检测技术的完善及提升提供一定的参考与借鉴。
1肉品中常见致病微生物
1.1 沙门氏菌
沙门氏菌(Salmonella)属革兰氏阴性肠道杆菌,是一种人畜共患病原菌,为引起食物中毒最常见的致病菌之一[5]。沙门氏菌侵染肠道后会引起肠胃炎、败血症以及伤寒等疾病,被我国列为乙类传染病[6]。在世界各国的细菌性食物中毒事件中,沙门氏菌引起的食物中毒事件数量常列榜首,我国内陆地区也以沙门氏菌为首位[7-8]。据统计,肉品中沙门氏菌的检出率在美国为20%~25%、英国为9.9%,日本进口家禽中沙门氏菌的污染率为10.3%,国内肉品沙门氏菌的检出率在1.1%~39.5%[9]。
1.2 金黄色葡萄球菌
金黄色葡萄球菌(Staphylococcus aureus,S. aureus)也称“嗜肉菌”,为兼性厌氧革兰氏阳性菌,通常不具有致病性,但其产生的肠毒素会导致中毒,引起发烧、腹泻和恶心呕吐等症状[10]。近几年,由金黄色葡萄球菌引发的食物中毒报道层出不穷,我国因其引起的食物中毒事件已居世界第4位[11]。
1.3 单核细胞增生李斯特氏菌
单核细胞增生李斯特氏菌(Listeria monocytogenes,L. monocytogenes)简称单增李斯特菌,是一种兼性厌氧革兰氏阳性短杆菌,被世界卫生组织列为四大食源性疾病致病菌之一。人感染该菌所导致的住院率高达92%,死亡率达20%~30%,孕妇、儿童、老年人等为高危人群,感染后会导致胎儿畸形、流产,以及脑膜炎、发热性胃肠炎等疾病[12-13]。据风险评估分级研究,熟肉制品是我国单增李斯特菌病发病风险率最高和最主要的食品之一[14]。
1.4 致病性大肠杆菌
大肠杆菌(Escherichia coli,E. coli)属革兰氏阴性短杆菌,是一种条件致病菌。致病性大肠杆菌,按其致病作用可以分为肠道致病性大肠杆菌、肠道产毒素性大肠杆菌、肠道侵袭性大肠杆菌、肠道出血性大肠杆菌、肠集聚性大肠杆菌、肠产志贺样毒素大肠杆菌、尿道致病性大肠杆菌和黏附大肠杆菌[15]。世界范围内爆发严重的大肠杆菌感染事件中,几乎都是由食物传播引起的。屠宰环节是畜禽肉供应链中致病性大肠杆菌污染风险最高的环节[16]。
1.5 产气荚膜梭菌
产气荚膜梭菌(Clostridium perfringens,C. perfringens)是一种芽孢杆菌科的革兰氏阳性厌氧菌,普遍存在并长期存活于各类环境中,具有较高的传播率,能导致气性坏疽和食物中毒等病症[17]。原料肉和熟肉制品均易被产气荚膜梭菌污染,其中,由牛肉制品污染引起的病例达40%[18]。
1.6 空肠弯曲杆菌
空肠弯曲杆菌(Campylobacter jejuni,C. jejuni)是一种微需氧的革兰氏阴性菌,作为共生菌大量存在于动物肠道内,猪、牛、鸡、狗是其最常见的传染源和宿主[19-20]。在某些发达地区,空肠弯曲杆菌的感染率接近于沙门氏菌和志贺氏菌。感染空肠弯曲杆菌不会直接导致死亡,但其造成的一系列消化道及神经疾病严重威胁人体健康[21]。
2食源性致病菌的传统检测方法
目前,传统生化培养分析法依旧是肉品中食源性致病菌检验检测的“金标准”。该法通过样品预增菌、选择性增菌、分离培养、生化鉴定、血清分型等手段,实现对致病菌的定性和定量检测[22]。传统生化法在致病菌检测中应用最为广泛、成本低、灵敏度高,但存在费时费力的缺点,检验流程通常需要1~2 d甚至更长时间,难以满足现场快速检测、实时监控等需求[23]。由于其基于致病菌可培养性的检测原则,可能会导致样品中致病菌种类及含量的检测值低于实际值,检测结果的假阴性率较高[24]。近年来,随着技术的不断发展改进,相继出现了许多以生化培养法为基础、酶底物显色法为原理的显色培养基、测试片、全自动微生物检测鉴定仪等产品,但仍无法满足自动化、高通量的现代检测技术需求,从传统人工操作向自动化检测的发展已经成为肉品致病菌检测技术不可逆转的发展趋势[13]。
3食源性致病菌检测新技术
3.1 分子诊断法
基于核酸的分子诊断法是评估肉品食源性致病菌安全性的首选分析方法之一,具有特异性强、灵敏度高、检测周期短、应用范围广等特点[25],并逐渐向轻量便捷及多靶点同步检测等方向发展。
3.1.1 聚合酶链式反应技术
聚合酶链式反应(polymerase chain reaction,PCR)是一种以特定核酸序列为靶标,经过变性、退火、延伸的重复循环过程进行体外扩增的技术,简便易行、特异性强、灵敏度高[26]。Capobianco等[27]利用液滴数字聚合酶链式反应(droplet digital PCR,ddPCR)检测牛肉制品中产志贺毒素的大肠杆菌,成功区分了单个细胞内的志贺毒素基因和内膜素基因。该方法无需绘制标准曲线即可直接对样品进行定量检测,实用性强。Liu等[28]通过实時荧光定量聚合酶链式反应(real-time quantitative PCR,qPCR)定量检测了12种常见的食源性致病菌。该方法对肉类样品中副溶血性弧菌的检出限为103 CFU/g,对其他11个菌株的检出限为104 CFU/g,且不同致病菌间无交叉反应,具有快速、低成本、高通量、高特异性和高灵敏性等优点。
为实现多种食源性致病菌的快速同步检测,一系列多靶点检测技术相继涌现。其中,多重聚合酶链式反应(multiple polymerase chain reaction,mPCR)法因灵敏度高、特异性强,引起了广泛的关注。Feng等[29]通过mPCR快速检测了多种高致病性单增李斯特菌,基因组DNA的检出限为291 fg/?L,细菌悬液中检出限为5.5×106 CFU/mL。此外,以人工接种单增李斯特菌的猪肉为对象进行检测时,分析时间为10~16 h,在1.8×102~1.8×103 CFU/10 g的范围内呈现出良好的线性关系。Alía等[30]建立了四重qPCR技术,用以鉴别从肉类加工厂中分离的单增李斯特菌株的4 种主要血清型,分析时间和成本大大降低。该方法可用于肉品工业中单增李斯特菌污染源的鉴定,以及肉品加工过程中持久性菌株的流行病学监测。
3.1.2 等温扩增技术
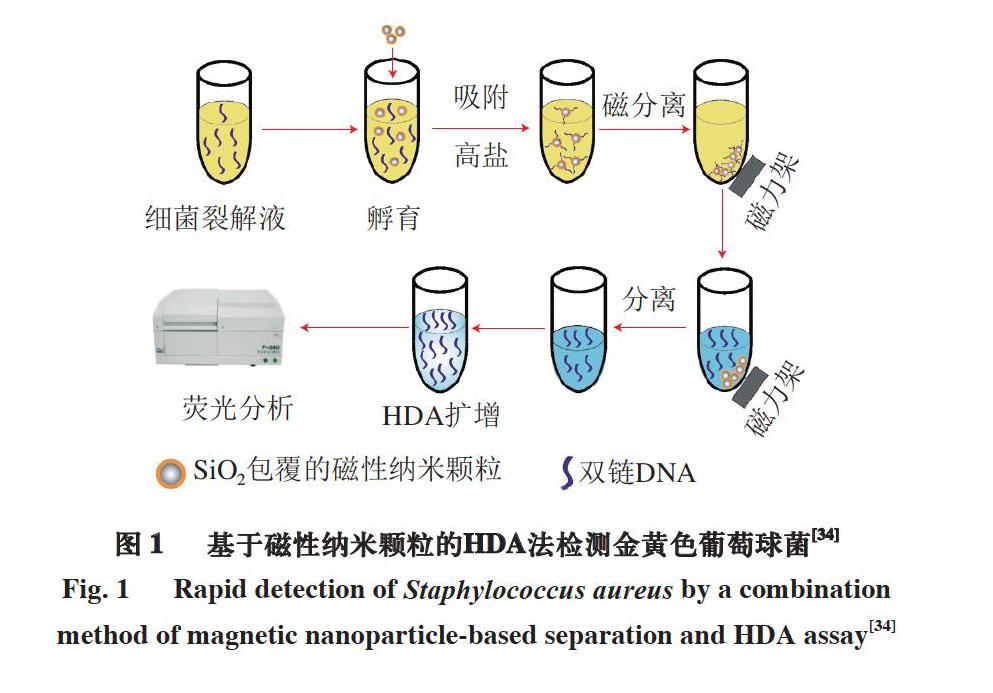
等温扩增作为一种核酸体外扩增技术,特点在于其反应过程始终维持在恒定温度下,仅需简单的恒温仪器如热块或水浴锅等的辅助即可实现扩增,大大降低了成本以及对精密温控设备的依赖,已成为PCR扩增的替代性选择[31]。常见的等温扩增技术有环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、滚环扩增技术(rolling circle amplification,RCA)、单引物等温扩增技术(single primer isothermal amplification,SPIA)以及解旋酶依赖性扩增技术(helicase-dependent amplification,HDA)等[32]。Ledlod等[33]利用LAMP和双向侧流试纸(duplex lateral flow dipstick,DLFD)相结合的方法定量检测了肉品中的单增李斯特菌,检测时间为45 min。同时,与未经LAMP预富集处理的检测方法相比(检出限4000 CFU/g),结合LAMP预富集的检测方法灵敏度大大提升,检出限最低可达20CFU/g。同时,该方法检测单个样品的成本仅为商用化试剂盒的一半,适用于大批量样品的现场快速检测。Chen等[34]建立了一种基于嗜热解旋酶依赖性等温扩增技术的猪肉制品金黄色葡萄球菌快速检测方法(图1)。该方法利用表面包裹二氧化硅的磁性纳米颗粒非特异性分离富集细菌裂解液中的DNA,并通过HDA法对目标核酸序列进行扩增,结果显示在102~104 CFU/mL范围内具有良好的线性关系,检出限低至50 CFU/mL。
3.1.3 DNA微阵列
DNA微阵列,又名DNA芯片,是一种基于基因测序的新型物种鉴定技术,利用在数平方厘米面积的基材上以特定顺序排列形成的特异性寡核苷酸探针二维高密度矩阵,实现基因信息的快速检测,在鉴定肉品中不同种属致病菌等方面展现出了巨大的应用前景。Raji等[35]利用DNA微阵列技术对沙特阿拉伯利雅得零售生肉样本中分离得到的金黄色葡萄球菌进行了分子诊断。对比禽肉、骆驼肉、羊肉和牛肉的实验结果,可发现易感甲氧西林金黄色葡萄球菌对骆驼肉的污染率最高,为28%,而在牛肉中未检出;耐甲氧西林金黄色葡萄球菌对骆驼肉的污染率最高,为20%,对禽肉污染率最低,为4%。
3.2 免疫分析法
免疫分析法以致病菌或菌的菌毛蛋白、脂多糖及其毒素为抗原[36],利用相应的抗体或适配体对其进行特异性识别和定量检测。除了经典的酶联免疫吸附法,近年来与层析技术、传感器技术、芯片技术等方法联用的免疫分析技术在肉品食源性致病菌检测领域展现出了广阔的应用前景。
3.2.1 酶联免疫吸附法
酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)是一种利用抗原抗体特异性结合进行定性和定量检测的技术。Zhu等[37]建立了一种灵敏的双抗体夹心ELISA法检测蜡样芽孢杆菌细胞个数,在磷酸盐缓冲液中可直接检测到浓度低至0.9×103 cell/mL的蜡样芽孢杆菌细胞,线性范围约为1×104~2.8×106 cell/mL,在碎肉末样品中的回收率为94.9%~98.4%。Zhao等[38]构建了一种微流控蜡印纸基ELISA(paper-based ELISA,P-ELISA)法用以快速检测牛肉中的大肠杆菌O157:H7。该方法检测时间不超过3 h,样品用量低至5 ?L,检出限达104 CFU/mL,与常规ELISA相比灵敏度提升了一个数量级。进一步对人工接种大肠杆菌O157:H7并富集培养8 h后的牛肉样品进行定量检测,发现该方法的灵敏度可达1 CFU/25 g。
3.2.2 免疫层析法
免疫层析法(immunochromatographic assay,ICA)是一种利用胶体金等显色标记物通过夹心免疫反应实现特异性免疫诊断的检测技术。Jiang等[39]开发了一种新型免疫层析测定法,利用具有高过氧化物酶活性的铂-金双金属纳米粒子检测大肠杆菌O157:H7。即使在低浓度范围内,该方法也可在不到1 min的时间内产生强烈的可见光信号,与传统的纳米金试纸条相比,灵敏度提高了1000倍以上。肉品作为一个复杂基质,其中的碳水化合物、脂肪以及氯化钠和赖氨酸等成分能抑制抗体的特异性结合进而影响检测的准确性[40]。Bu等[41]建立了一种基于免疫磁珠分离法及侧向流动免疫层析(lateral flow immunoassays,LFIA)技术的肠炎沙门氏菌检测方法,可有效分离富集肉品中的目标菌细胞(图2)。首先利用表面包覆氨苄西林抗生素的磁性纳米颗粒捕获肠炎沙门氏菌,并通过与试纸条上的单克隆抗体形成夹心结构复合物,产生顯色反应实现目标菌的定量检测。该方法仅靠肉眼观察即可判别出102~103 CFU/mL肠炎沙门氏菌的存在,在猪肉样品中的灵敏度为103 CFU/mL。
3.2.3 免疫传感器
免疫传感器集传统免疫学检测方法和生物传感器技术的诸多优点,被视为是食源性致病菌检测的高潜力途径。比如,可视化传感器可利用自身色彩鲜明或具有类似过氧化物酶活性的纳米材料的颜色变化,通过比色法对目标致病菌进行定性及定量检测[42-43]。Díaz-Amaya等[44]研究了一种基于喷墨印刷纳米图案的光学适配体传感器定量检测大肠杆菌O157:H7,在绞碎的牛肉末中的检出限为233 CFU/mL,并成功实现了大肠杆菌O157:H7在属、种、菌株和血清型水平上的高特异性鉴别。Xu等[45]结合免疫磁珠分离技术及电化学传感技术,实现了大肠杆菌O157:H7和鼠伤寒沙门氏菌的快速检测,两者在菌液中的特异性检测范围均为102~106 CFU/mL,在牛肉末中大肠杆菌O157:H7的检出限为2.05×103 CFU/g,在鸡肉漂洗水中鼠伤寒沙门氏菌的检出限为1.04×103 CFU/mL。
3.2.4 免疫芯片法
免疫芯片因具有微型化、自动化及集成化等优势,近年来成为生化分析的研究热点。其中,微流控芯片是一类通过对微米尺度通道内液体进行操纵和控制实现样品制备、反应、分离、检测等流程的微型系统,具有高通量、高效率和易操作的特点[46]。Hao等[47]利用微流控技术实现了鼠伤寒沙门氏菌的快速自动化检测。该方法首先将表面修饰有量子点和多克隆抗体的MnO2纳米花与样品和磁性微粒共同注射到微流控芯片中,在充分混合及孵育后,利用外加磁场将磁性微粒-目标菌-纳米花复合体分离到特定腔室内,随后向芯片注射谷胱甘肽溶液,将MnO2纳米花分解为Mn2+,释放量子点。利用量子点的荧光信号可实现鼠伤寒沙门氏菌的定量分析,检出限低至43 CFU/mL,在加标鸡肉中的平均回收率为99.7%。
3.3 光谱检测法
光谱技术是一种具有非侵入性和非破坏性特征的檢测方法,具有快速、重现性好等优势,适用于肉品中食源性致病菌的现场在线监测[23]。目前已有将近红外光谱(near infrared spectrum,NIRS)、表面增强拉曼光谱(surface-enhanced raman spectroscopy,SERS)及荧光光谱等技术应用于肉品致病菌检测的报道。
3.3.1 近红外光谱法
近红外光谱技术利用近红外光照射样品后收集到的分子旋转及振动相关特征信息实现目标分析物的检测,具有无需或只需少量准备工作即可对各种样品进行非接触分析的优点。但其存在化学特异性较差,光谱解谱困难等不足[48-49]。Bonah等[50]建立了一种可见-近红外高光谱成像系统,结合偏最小二乘回归算法,快速监测新鲜猪肉中的大肠杆菌O157:H7和金黄色葡萄球菌。该方法可以提供猪肉样品表面致病菌的浓度和分布,是评估肉品质量和安全性的高潜力途径。
3.3.2 表面增强拉曼光谱法
表面增强拉曼光谱法利用金属纳米结构对拉曼信号的增强效应实现目标待检物的高灵敏分析。研究表明相较于单分子拉曼信号,SERS法信号增强可高达1014倍[51]。Cho等[52]利用SERS技术快速检测了牛肉末中的大肠杆菌O157:H7。通过结合免疫磁珠和膜过滤法,可从复杂样品中快速捕获、分离和富集目标菌,检测时间小于3 h,检出限低于10 CFU/mL,灵敏度高。
3.3.3 荧光光谱法
荧光光谱可提供较多的微生物相关生理或过程状态的物理参数,较少的样品量即可实现肉品中致病菌快速、自动化在线监测[53]。Durek等[54]利用荧光光谱法对肉品表面的致病菌污染进行了无损监测,成功在5℃下贮存20 d的猪肉和羊肉样品中检出了原卟啉和锌卟啉的荧光,并证实这些卟啉荧光信号主要是由于肉品表面滋生的不同微生物相互作用而引起的。研究结果表明该方法可应用于鲜肉制品生产线和贸易线的致病菌污染监测。
3.4 电子鼻检测法
电子鼻是一种能够快速指示样品中隐含的特征化学气体的传感器,通过直接识别肉品中的细菌种群以评估肉品的安全性,已成功应用于肉品质量的快速监控[55]。Timsorn等[56]建立了一种基于8 种金属氧化物传感器的新型便携式电子鼻系统(图3),可用于评估鸡肉的新鲜度,并分别检测在4 ℃和30 ℃下贮存贮存5 d的鸡肉上已知细菌污染物的数量。构建的电子鼻传感器能较好地评价鸡肉的细菌种群数量,相关系数较高,达0.94,均方误差为0.016。该技术响应时间短、检测速度快、评估范围广,可以识别不同致病菌不同生长阶段产生的化学气味,有望发展为一种同时获取多项生物信息的新型途径。肉品食源性致病菌检测技术的相关研究如表2所示。
4 结 语
现阶段,传统生化法仍是食源性致病菌检测的“金标准”方法,但其操作繁琐、耗时较长,不能满足肉类行业现代化高速发展的需要。近年来,在肉品食用安全保障需求下,涌现了大量的新型食源性致病菌检测技术。其中,分子诊断法在肉品致病菌的检测中应用较为广泛,灵敏度高,特异性强,适合定量分析复杂肉品,但是存在无法区分活死致病菌的局限性,易造成假阳性或假阴性结果[60]。此外,分子诊断法对样品预处理、引物设计的要求较为严格,实验操作复杂不适用于现场的检测。免疫分析法依赖于抗原抗体等的特异性结合作用,目前技术发展较为成熟,但仍存在如抗体成本高、适配体种类有限等问题。光谱检测法和电子鼻检测法无需复杂耗时的前处理过程,是一种无损检测法,可脱离实验室环境,为实现肉品中食源性致病菌的实时原位在线监测和自动化采样监测提供有效途径。
开发简单、快速、高效、灵敏的食源性致病菌检测技术对保障肉品安全和消费者健康至关重要。在今后的研究中,还应加强对以下方面更为深入的探索:1)肉品基质复杂,亟需发展快速有效的样品前处理技术,以替代漫长繁琐的增菌步骤;2)如何在保证精准性的同时,提升检测速度,实现实时在线监测和快速现场检测;3)如何构建轻量化、一体化及智能化的检测设备,通过与大数据、人工智能及物联网等技术联用,为产业监控提供技术支撑;4)如何处理检测完毕后的废弃物,避免致病菌二次污染等。
参考文献:
[1] 中华人民共和国统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2020.
[2] 付萍, 王连森, 陈江, 等. 2015年中国大陆食源性疾病暴发事件监测资料分析[J]. 中国食品卫生杂志, 2019, 31(1): 64-70. DOI:10.13590/j.cjfh.2019.01.014.
[3] 李可维, 刘思洁, 赵薇, 等. 9274份肉及肉制品食源性致病菌监测结果分析[J]. 食品安全质量检测学报, 2020, 11(23): 9033-9038. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.23.077.
[4] PATEIRO M, MUNEKATA P E S, SANTANA A S, et al. Application of essential oils as antimicrobial agents against spoilage and pathogenic microorganisms in meat products[J]. International Journal of Food Microbiology, 2021, 337: 108966. DOI:10.1016/j.ijfoodmicro.2020.108966.
[5] 蔡洁. 我国肉类食品微生物安全现状及控制检测技术[J]. 中外企业家, 2018, 595(5): 222. DOI:CNKI:SUN:ZWQY.0.2018-05-178.
[6] 谢雨龙, 覃巧思, 李佳连. 沙门氏菌检测方法研究进展[J]. 轻工科技, 2020, 36(9): 139-141. DOI:CNKI:SUN:GXQG.0.2020-09-056.
[7] 王霄曄, 任婧寰, 王哲, 等. 2017年全国食物中毒事件流行特征分析[J]. 疾病监测, 2018, 33(5): 359-364. DOI:CNKI:SUN:JBJC.0.2018-05-005.
[8] 王霄晔, 吴晓旻, 王锐, 等. 2018年第三季度全国食物中毒事件流行特征分析[J]. 疾病监测, 2019, 34(8): 741-745. DOI:CNKI:SUN:JBJC.0.2018-06-004.
[9] 吴得海. 食品安全事件之警示与思考[M]. 甘肃: 文化出版社, 2016.
[10] 孔祥瑞, 王洪柱. 金黄色葡萄球菌检测方法的研究进展[J]. 中国乳业, 2017, (10): 72-74. DOI:10.16172/j.cnki.114768.2017.10.020.
[11] 梁金姬, 宋德涵, 李韵辞, 等. 金黄色葡萄球菌检测方法研究进展[J]. 山东化工, 2015, 44(10): 41-42. DOI:10.3969/j.issn.1008-021X.2015.10.013.
[12] KARTHIKEYANA R, GAYATHRIB P, GUNASEKARAN P, et al. Comprehensive proteomic analysis and pathogenic role of membrane vesicles of Listeria monocytogenes serotype 4b reveals proteins associated with virulence and their possible interaction with host[J]. International Journal of Medical Microbiology, 2019, 309(3-4): 199-212. DOI:10.1016/j.ijmm.2019.03.008.
[13] SILVA N F D, NEVES M M P S, MAGALHES J M C S, et al. Emerging electrochemical biosensing approaches for detection of Listeria monocytogenes in food samples: an overview[J]. Trends in Food Science & Technology, 2020, 99: 621-633. DOI:10.1016/j.tifs.2020.03.031.
[14] 宋筱瑜, 裴晓燕, 徐海滨, 等. 我国零售食品单增李斯特菌污染的健康风险分级研究[J]. 中国食品卫生杂志, 2015, 27(4): 447-450. DOI:10.13590/j.cjfh.2015.04.021.
[15] 殷泽禄, 万虎. 大肠杆菌的研究综述[J]. 甘肃畜牧兽医, 2019, 49(5): 33-35. DOI:10.15979/j.cnki.cn62-1064/s.2019.05.010.
[16] 韩海燕, 蔡扩军, 王承. 大肠杆菌O157:H7的风险监测[J]. 中国畜牧业, 2020, (10): 50. DOI:CNKI:SUN:MYTX.0.2020-10-021.
[17] 于旭磊. 产气荚膜梭菌流行特点及其噬菌体遗传背景分析[D]. 泰安: 山东农业大学, 2020: 1. DOI:10.27277/d.cnki.gsdnu.2020.000354.
[18] LI L, VALENZUELA-MARTINEZ C, REDONDO M, et al. Inhibition of Clostridium perfringens Spore Germination and Outgrowth by Lemon Juice and Vinegar Product in Reduced NaCl Roast Beef[J]. Journal of Food Science, 2012, 77(11): M598-M603. DOI:10.1111/j.1750-3841.2012.02922.x.
[19] 黄亚奇, 熊静禹, 沈达, 等. 空肠弯曲杆菌毒力因子及其致病机制研究进展[J]. 中国家禽, 2019, 41(22): 46-51. DOI:10.16372/j.issn.1004-6364.2019.22.010.
[20] 阳成波, 蒋原, 黄克和. 空肠弯曲杆菌感染流行病学研究进展[J]. 动物医学进展, 2002(6): 10-12. DOI:10.16437/j.cnki.1007-5038.2002.06.004.
[21] 金星. 乳酸菌拮抗空肠弯曲杆菌的机制研究[D]. 无锡: 江南大学, 2020: 1. DOI:10.27169/d.cnki.gwqgu.2020.000853.
[22] 姬莉莉, 闫雪. 食品中微生物限量要求及检测技术发展趋势[J]. 2021, 12(2): 460. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.02.008.
[23] 王成, 陆雨菲, 刘箐. 光谱技术在食源性致病菌检测中的应用[J]. 光学仪器, 2019, 41(1): 85-94. DOI:CNKI:SUN:GXYQ.0.2019-01-015.
[24] 郑桂丽, 廖绍安, 翟俊辉, 等. 环境中"活的非可培养(VBNC)"细菌的研究进展[J]. 微生物学免疫学进展, 2004, 32(4): 58-66. DOI:10.3969/j.issn.1005-5673.2004.04.016.
[25] KUMAR Y. Isothermal amplification-based methods for assessment of microbiological safety and authenticity of meat and meat products[J]. Food Control, 2021, 121: 107679. DOI:10.1016/j.foodcont.2020.107679.
[26] UMESHA S, MANUKUMAR H M. Advanced Molecular Diagnostic Techniques for Detection of Food-borne Pathogens; Current Applications and Future Challenges[J]. Critical Reviews in Food Science & Nutrition, 2018, 58(1): 84-104. DOI:10.1080/10408398.2015.1126701.
[27] CAPOBIANCO J A, CLARK M, CARIOU A, et al. Detection of Shiga toxin producing Escherichia coli (STEC) in beef products using droplet digital PCR[J]. International Journal of Food Microbiology, 2019, 319: 108499. DOI:10.1016/j.ijfoodmicro.2019.108499.
[28] LIU Y, CAO Y, WANG T, et al. Detection of 12 Common Food-Borne Bacterial Pathogens by TaqMan Real-Time PCR Using a Single Set of Reaction Conditions[J]. Frontiers in microbiology, 2019, 10: 222. DOI:10.3389/fmicb.2019.00222.
[29] FENG Y W, YAO H, CHEN S S, et al. Rapid Detection of Hypervirulent Serovar 4h Listeria monocytogenes by Multiplex PCR[J]. Frontiers in Microbiology, 2020, 11: 1309. DOI:10.3389/FMICB.2020.01309.
[30] AL?A A, ANDRADE M J, CORDOBA J J, et al. Development of a multiplex real-time PCR to differentiate the four major Listeria monocytogenes serotypes in isolates from meat processing plants[J]. Food microbiology, 2020, 87: 103367. DOI:10.1016/j.fm.2019.103367.
[31] 王瑞. 快速核酸擴增及可视化策略用于食源性致病菌和转基因作物检测[D]. 杭州: 浙江大学, 2019: 16. DOI:10.27461/d.cnki.gzjdx.2019.000339.
[32] REID M S, LE X C, ZHANG H. Exponential Isothermal Amplification of Nucleic Acids and Assays for Proteins, Cells, Small Molecules, and Enzyme Activities: An EXPAR Example[J]. Angewandte Chemie International Edition, 2018, 57(37): 11856-11866. DOI:10.1002/anie.201712217.
[33] LEDLOD S, BUNRODDITH K, AREEKIT S, et al. Development of a duplex lateral flow dipstick test for the detection and differentiation of Listeria spp. and Listeria monocytogenes in meat products based on loop-mediated isothermal amplification[J]. Journal of chromatography. B, Analytical technologies in the biomedical and life sciences, 2020, 1139(C): 121834. DOI:10.1016/j.jchromb.2019.121834.
[34] CHEN X, WU X, GAN M, et al. Rapid detection of Staphylococcus aureus in dairy and meat foods by combination of capture with silica-coated magnetic nanoparticles and thermophilic helicase-dependent isothermal amplification[J]. Journal of Dairy Science, 2015, 98(3): 1563-1570. DOI:10.3168/jds.2014-8828.
[35] RAJI M A, GARAWEEN G, EHRICHT R, et al. Genetic Characterization of Staphylococcus aureus Isolated from Retail Meat in Riyadh, Saudi Arabia[J]. Frontiers in Microbiology, 2016, 7: 911. DOI:10.3389/fmicb.2016.00911.
[36] 解沛燕, 朱龙佼, 许文涛. 适配体在食源性致病菌检测中的应用进展[J]. 生物技术通报, 2016, 32(4): 48-62. DOI:10.13560/j.cnki.biotech.bull.1985.2016.04.006.
[37] ZHU L, HE J, CAO X, et al. Development of a double-antibody sandwich ELISA for rapid detection of Bacillus Cereus in food[J]. Rep, 2016, 6(1): 16092. DOI:10.1038/srep16092.
[38] ZHAO Y, ZENG D, YAN C, et al. Rapid and accurate detection of Escherichia coli O157:H7 in beef using microfluidic wax-printed paper-based ELISA[J]. The Analyst, 2020, 145(8): 3106-3115. DOI:10.1039/d0an00224k.
[39] JIANG T, SONG Y, WEI T, et al. Sensitive detection of Escherichia coli O157:H7 using Pt-Au bimetal nanoparticles with peroxidase-like amplification[J]. Biosensors and Bioelectronics, 2016, 77: 687-694. DOI:10.1016/j.bios.2015.10.017.
[40] WANG Z, CAI R, GAO Z, et al. Immunomagnetic separation: An effective pretreatment technology for isolation and enrichment in food microorganisms detection[J]. Comprehensive Reviews in Food Science and Food Safety, 19(6): 3802-3824. DOI:10.1111/1541-4337.12656.
[41] BU T, YAO X, HUANG L, et al. Dual recognition strategy and magnetic enrichment based lateral flow assay toward Salmonella enteritidis detection[J]. Talanta, 2020, 206(C): 120204. DOI:10.1016/j.talanta.2019.120204.
[42] 周靜, 田风玉, 焦必宁, 等. 基于纳米材料的可视化比色检测技术在食源性致病菌检测中的应用研究进展[J]. 食品与发酵工业, 2019, 45(11): 259-267. DOI:10.13995/j.cnki.11-1802/ts.019960.
[43] ALHOGAIL S, SUAIFAN G A R Y, ZOUROB M. Rapid colorimetric sensing platform for the detection of Listeria monocytogenes foodborne pathogen[J]. Biosensors and Bioelectronics, 2016, 86: 1061-1066. DOI:10.1016/j.bios.2016.07.043.
[44] D?AZ-AMAYA S, ZHAO M, LIN L, et al. Inkjet Printed Nanopatterned Aptamer-Based Sensors for Improved Optical Detection of Foodborne Pathogens[J]. Small, 15(24): 1805342. DOI:10.1002/smll.201805342.
[45] XU M, WANG R, LI Y. Rapid detection of Escherichia coli O157:H7 and Salmonella Typhimurium in foods using an electrochemical immunosensor based on screen-printed interdigitated microelectrode and immunomagnetic separation[J]. Talanta, 2016, 148: 200-208. DOI:10.1016/j.talanta.2015.10.082.
[46] 王楷宬, 孙瑞妮, 姜楠, 等. 微流控芯片技术在微生物检测中的应用[J]. 中国动物检疫, 2021, 38(1): 93-99. DOI:10.3969/j.issn.1005-944X.2021.01.018.
[47] HAO L, XUE, HUANG F, et al. A Microfluidic Biosensor Based on Magnetic Nanoparticle Separation, Quantum Dots Labeling and MnO2 Nanoflower Amplification for Rapid and Sensitive Detection of Salmonella typhimurium[J]. Micromachines, 2020, 11(3): 281-296. DOI:10.3390/mi11030281.
[48] TOLEDO M, GUTI?RREZ M C, SILES J A, et al. Chemometric analysis and NIR spectroscopy to evaluate odorous impact during the composting of different raw materials[J]. Journal of Cleaner Production, 2017, 167: 154-162. DOI:10.1016/j.jclepro.2017.08.163.
[49] KRZYSZTOF B B, JUSTYNA G, CHRISTIAN W H, et al. Near-Infrared Spectroscopy in Bio-Applications[J]. Molecules, 2020, 25(12): 2948. DOI:10.3390/molecules25122948.
[50] BONAH E, HUANG X Y, AHETO J H, et al. Comparison of variable selection algorithms on vis-NIR hyperspectral imaging spectra for quantitative monitoring and visualization of bacterial foodborne pathogens in fresh pork muscles[J]. Infrared Physics & Technology, 2020, 107: 103327. DOI:10.1016/j.infrared.2020.103327.
[51] POLISETTI S, BAIG N F, MORALES-SOTO N, et al. Spatial Mapping of Pyocyanin in Pseudomonas Aeruginosa Bacterial Communities Using Surface Enhanced Raman Scattering[J]. Applied Spectroscopy, 2017, 71(2): 215-223. DOI:10.1177/0003702816654167.
[52] CHO I, BHANDARI P, PATEL P, et al. Membrane filter-assisted surface enhanced Raman spectroscopy for the rapid detection of E. coli O157:H7 in ground beef[J]. Biosensors and Bioelectronics, 2015, 64: 171-176. DOI:10.1016/j.bios.2014.08.063.
[53] FAASSEN S, HITZMANN B. Fluorescence spectroscopy and chemometric modeling for bioprocess monitoring[J]. Sensors, 2015, 15(5): 10271-10291. DOI:10.3390/s150510271.
[54] DUREK J, FR?HLING A, BOLLING J, et al. Non-destructive mobile monitoring of microbial contaminations on meat surfaces using porphyrin fluorescence intensities[J]. Meat Science, 2016, 115: 1-8. DOI:10.1016/j.meatsci.2015.12.022.
[55] 質量技术监督行业职业技能鉴定指导中心. 质量技术监督基础[M]. 2版. 中国质检出版社, 2014.
[56] TIMSORN K, THOOPBOOCHAGORN T, LERTWATTANASAKUL N, et al. Evaluation of bacterial population on chicken meats using a briefcase electronic nose[J]. Biosystems Engineering, 2016, 151: 116-125. DOI:10.1016/j.biosystemseng.2016.09.005.
[57] HASSAN A H A, BERGUA J F, MORALES-NARV?EZ E, et al. Validity of a single antibody-based lateral flow immunoassay depending on graphene oxide for highly sensitive determination of E. coli O157:H7 in minced beef and river water[J]. Food Chemistry, 2019, 297: 124965. DOI:10.1016/j.foodchem.2019.124965.
[58] ZHUANG L, GONG J, JI Y, et al. Lateral Flow Fluorescent Immunoassay Based on Isothermal Amplification for Rapid Quantitative Detection of Salmonella spp.[J]. The Analyst, 2020, 145(6): 2367-2377. DOI:10.1039/C9AN02011J.
[59] MUNIANDY S, DINSHAW I J, TEH S J, et al. Graphene-based label-free electrochemical aptasensor for rapid and sensitive detection of foodborne pathogen[J]. Analytical & Bioanalytical Chemistry, 2017, 409(29): 6893-6905. DOI:10.1007/s00216-017-0654-6.
[60] 王琦, 颜春蕾, 高洪伟, 等. 基于核酸适配体传感器检测食品致病菌的研究进展[J]. 生物技术通报, 2020, 36(11): 245-258. DOI:10.13560/j.cnki.biotech.bull.1985.2019-1273.

