复方斑蝥胶囊联合不同放化疗方案治疗原发性肝癌有效性与安全性的Meta分析及试验序贯分析
邝玉慧 徐方飚 赵哲 梁家琦 陈欣菊

中圖分类号 R735.7 文献标志码 A 文章编号 1001-0408(2021)08-0996-08
DOI 10.6039/j.issn.1001-0408.2021.08.17
摘 要 目的:系统评价复方斑蝥胶囊联合不同放化疗方案治疗原发性肝癌(PHC)的有效性和安全性,旨在为临床用药提供循证参考。方法:计算机检索中国生物医学文献数据库、中国知网、万方数据、维普网、PubMed、Embase、Cochrane图书馆等,检索时限均为各数据库建库起至2020年9月,收集复方斑蝥胶囊联合不同放化疗方案(试验组)对比不同放化疗方案(对照组)的随机对照试验(RCT)、队列研究。筛选文献、提取资料后,采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对RCT进行质量评价;采用纽卡斯尔-渥太华量表对队列研究进行质量评价;采用Rev Man 5.3软件进行Meta分析,采用TSA 0.9.5.10 Beta软件进行试验序贯分析,采用GRADE Profiler 3.6.1证据等级质量评价工具对RCT和队列研究进行证据质量等级评价。结果:共纳入15项RCT,共计1 148例患者。Meta分析结果显示,试验组患者的治疗有效率显示高于对照组[RR=0.80,95%CI(0.73,0.88),P<0.000 01];按化疗方案不同进行亚组分析的结果显示,试验组联合肝动脉化疗栓塞术(TACE)介入治疗方案、三维适形放疗方案患者的治疗有效率均显著高于对照组(P<0.05)。试验组患者的生存率显著高于对照组[RR=0.81,95%CI(0.74,0.89),P<0.000 1];按生存时间不同进行亚组分析的结果显示,试验组患者1年、2年、3年生存率均显著高于对照组(P<0.05)。试验组患者骨髓抑制发生率显著低于对照组,自然杀伤细胞计数、T细胞亚群计数均显著高于对照组(P<0.05);而两组患者甲胎蛋白含量、肝功能指标比较,差异均无统计学意义(P>0.05)。试验序贯分析结果显示,复方斑蝥胶囊联合TACE介入治疗的治疗有效率更优的证据确切。GRADE评价结果显示,治疗有效率的证据等级为中级,生存率及骨髓抑制发生率的证据等级为低级,其余指标均为极低级。结论:复方斑蝥胶囊联合不同放化疗方案用于PHC的疗效显著且安全性较好,尤以联合TACE介入治疗的疗效最佳,且治疗有效率的证据等级为中级。
关键词 复方斑蝥胶囊;原发性肝癌;疗效;安全性;Meta分析;试验序贯分析;GRADE评价
Meta-analysis and Trial Sequential Analysis of Effectiveness and Safety of Compound Banmao Capsules Combined with Different Chemoradiotherapy in the Treatment of Primary Hepatic Carcinoma
KUANG Yuhui1,XU Fangbiao1,ZHAO Zhe2,LIANG Jiaqi3,CHEN Xinju4(1. First School of Clinical Medicine, Henan University of TCM, Zhengzhou 450046, China; 2. Second School of Clinical Medicine, Henan University of TCM, Zhengzhou 450046, China; 3. Dept. of Hepatic Disease, Beijing TCM Hospital Affiliated to Capital Medical University, Beijing 100010, China; 4. First Ward of Spleen, Stomach, Liver and Gall, the First Affiliated Hospital of Henan University of TCM, Zhengzhou 450002, China)
ABSTRACT OBJECTIVE: To systematically evaluate the efficacy and safety of Compound banmao capsules combined with different chemoradiotherapy in the treatment of primary hepatic carcinoma (PHC). METHODS: Retrieved from CBM, CNKI, Wanfang database, VIP, PubMed, Embase and Cochrane Library during the inception to Sept. 2020, randomized controlled trial (RCTs), cohort study about Compound banmao capsules combined with different chemoradiotherapy plans (trial group) versus different chemoradiotherapy plans (control group) were collected. After literature screening and data extraction, the quality of included RCTs were evaluated with bias risk evaluation tool recommended by Cochrane system evaluator mannual 5.1.0. Newcastle Ottawa scale was used to evaluate the quality of cohort studies; Rev Man 5.3 software was used for Meta-analysis; TSA 0.9.5.10 Beta software was used for trail sequential analysis, and GRADE Profiler 3.6.1 software was used for evidence quality evaluation of RCT and cohort studies. RESULTS: A total of 15 RCTs were included, involving 1 148 patients. Meta-analysis showed that effective rate of trial group was significantly higher than that of control group [RR=0.80,95%CI(0.73,0.88),P<0.000 01]. The results of subgroup analysis according to different chemotherapy plan showed that the effective rate of trial group combined with TACE and three dimensional conformal radiotherapy were significantly higher than control group (P<0.05). The survival rate of trial group was significantly higher than control group [RR=0.81, 95%CI(0.74, 0.89), P<0.000 1]; the results of subgroup analysis according to different survival time showed that 1-year, 2-year and 3-year survival rates of trial group were significantly higher than control group (P<0.05). The incidence of myelosuppression in trial group was significantly lower than control group, and the natural killer cell count and T cell count of trial group were significantly higher than control group (P<0.05). There was no statistical significance in AFP content and liver function index between 2 groups (P>0.05). Trial sequential analysis showed that there was definite evidence for better effective rate of Compound banmao capsules combined with TACE. GRADE evaluation results showed that the evidence level of effective rate was intermediate, the evidence level of survival rate and incidence of myelosuppression was low, and other indicators were very low. CONCLUSIONS: Compound banmao capsules combined with different chemoradiotherapy in the treatment of PHC has significant efficacy and good safety, especially in combination with TACE, and the evidence level of effective rate is intermediate.
KEYWORDS Compound banmao capsules; Primary hepatic carcinoma; Efficacy; Safety; Meta-analysis; Trial sequential analysis; GRADE evaluation
原发性肝癌(PHC)是常见的消化道恶性肿瘤,据2018年美国癌症协会统计,肝癌是全球第六大常见的肿瘤,近10年来发病率呈逐年上升的趋势,其死亡率居全球恶性肿瘤第4位,每年新发病例约84万例、死亡约78万例[1]。目前,PHC的治疗方案主要有局部治疗和全身治疗。其中,局部治疗包括手术切除、肝移植、射频消融、肝动脉化疗栓塞术(TACE)和放疗等;全身治疗包括分子靶向、免疫治疗、系统化疗和中医药治疗等[2-3]。由于PHC发病较为隐匿,大部分患者在确诊时已属中晚期,失去了最佳手术治疗时机[4]。虽然,西医常规的放化疗和TACE介入治疗是目前PHC的有效治疗方法,但上述方法会损害患者的免疫功能、肝功能,并引发骨髓抑制等不良反应[3]。
中医药治疗肝癌具有缓解临床症状、提高临床疗效、延长生存期、改善生存质量、减少放化疗毒副反应等优势[3]。多项基础及临床研究表明,复方斑蝥胶囊能够抑制肿瘤细胞的增殖与分化、诱导肿瘤细胞凋亡、抑制血管生成、抑制肿瘤转移、调节免疫等,具有扶正祛邪的双重作用[5-6]。目前,已有研究报道指出,在西医常规放化疗、三维适形放疗、TACE介入治疗等基础上加用复方斑蝥胶囊对PHC具有较好的临床疗效,但这些研究多为单中心、小样本研究,且存在争议[7-21]。基于此,本研究采用Meta分析的方法系统评价了复方斑蝥胶囊联合不同放化疗方案治疗PHC的有效性和安全性,并结合试验序贯分析(TSA)及证据等级质量评价工具对指标质量进行评估,旨在为临床用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT)、队列研究;语种限定为中文和英文。
1.1.2 研究对象 均确诊为PHC,均符合《原发性肝癌诊断标准》中的相关诊断标准[4]。
1.1.3 干预措施 两组患者均给予常规基础对症治疗,如抗感染、补液、保护脏器功能、营养支持等;对照组在此基础上给予不同放化疗方案,试验组患者在对照组治疗基础上给予复方斑蝥胶囊。两组患者用药剂量、用法均不限。
1.1.4 结局指标 主要结局指标包括:①治疗有效率,②生存率;次要结局指标包括:③甲胎蛋白(AFP)含量,④自然杀伤细胞(NK)计数,⑤T细胞亚群计数,如CD3+、CD4+、CD8+、CD4+/CD8+,⑥肝功能指标,如总胆红素(TBIL)、丙氨酸转氨酶(ALT)含量;⑦骨髓抑制发生率。按照世界卫生组织(WHO)实体瘤疗效判定标准分为完全缓解(CR)、部分缓解(PR)、无变化(NC)和进展(PD),治疗有效率=(CR例数+PR例数)/总例数×100%[20]。
1.1.5 排除标准 ①分组方法、研究方法不合理的文献;②临床干预措施不严谨或治疗方法阐述不明确的文献;③个案、综述、基础研究、会议论文;④无法获取全文的文献。
1.2 文献检索策略
计算机检索中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方数据、维普网、PubMed、Embase、Cochrane图书馆等数据库。中文主题词为“原发性肝癌”,自由词为“肝肿瘤”“肝恶性肿瘤”“肝细胞癌”“肝脏肿瘤”“肝部肿瘤”“肝癌”,干预措施为“复方斑蝥胶囊”;英文主题词为“Carcinoma hepatocellular”,自由词为“Carcinomas hepatocellular” “Hepatocellular carcinomas”“Liver cell carcinoma”“Liver cancer”等,干预措施为“Fufang banmao capsule”。 采用主题词结合自由词进行检索。检索时限均为各数据库建库起至2020年9月。
1.3 文獻筛选与资料提取
由2位研究者独立阅读文献,按照纳入与排除标准进行文献筛选;如遇分歧则与第3位研究者讨论评判并综合双方意见后,再决定是否纳入。提取信息包括第一作者、发表年份、患者例数、性别、疗程、干预措施、结局指标等。
1.4 文献质量评价
采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对RCT进行质量评价,具体包括随机序列的产生、分配隐藏、研究对象和实施者的盲法、结局评估者盲法、结局数据完整性、选择性报告结果、其他偏倚来源;每项均分为高风险、低风险和不清楚[22]。采用纽卡斯尔-渥太华量表(NOS)对队列研究进行质量评价,具体包括研究人群的选择、组间可比性、暴露等3个项目共8个条目(具体标准略)[23]。
1.5 统计学方法
采用Rev Man 5.3软件对纳入研究进行Meta分析。计数资料以相对危险度(RR)及其95%置信区间(CI)表示;计量资料以均数差(MD)及其95%CI表示。若各研究间统计学异质性较小(I 2<50%且P>0.1),采用固定效应模型进行分析;反之,则采取随机效应模型进行分析。采用敏感性分析找出对异质性影响较大的文献,并分析具体原因。采用Eggers检验进行发表偏倚分析。采用TSA 0.9.5.10 Beta软件进行TSA[24]。P<0.05为差异有统计学意义。
1.6 证据等级评价
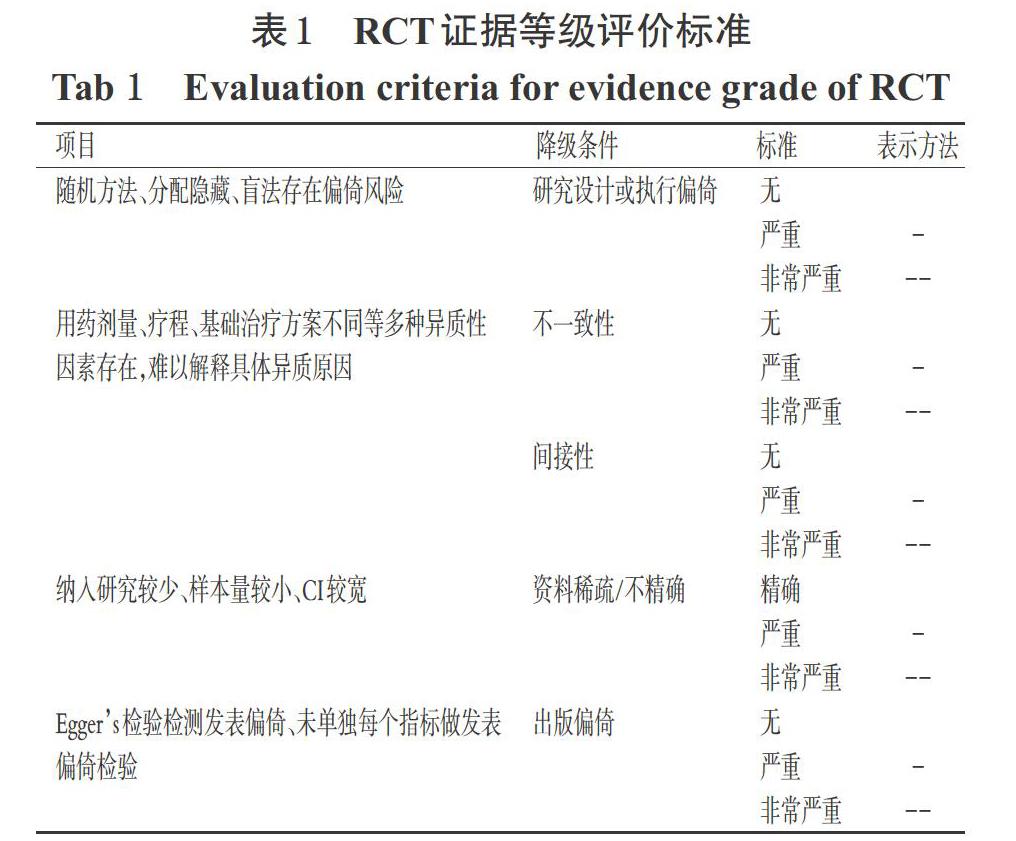
采用GRADE Profiler 3.6.1证据质量等级评价工具评价RCT和队列研究中各结局指标,因RCT目前认为其证据等级最高,故有5个降级因素[25]。RCT证据等级评价标准见表1(表中,“表示方法”项下无降级条件符合表示“高”;1个条件符合为“-”,表示“中”,2个条件符合为“--”表示“低”,3个条件符合为“---”,表示“极低”;队列研究的具体标准略)。
2 结果
2.1 文献检索结果与纳入研究基本信息
初检共获得相关文献210篇,经查重、阅读标题及全文后,最终纳入文献15篇[7-21],共计1 148例患者,其中试验组581例、对照组567例。文献筛选流程见图1,纳入研究基本信息见表2。
2.2 纳入文献质量评价结果
15篇文献均为RCT[7-21]。所有研究均提及随机分组,其中7项研究[7,10-11,13-14,16,19]明确阐述了随机分配方法(随机数字表法或信封法);所有研究均未提及盲法,结果数据均完整,均未选择性报告结果,均不清楚是否存在其他偏倚来源,结果见表3。
2.3 Meta分析结果
2.3.1 治疗有效率 11项研究报道了患者的治疗有效率[7,9,12-18,20-21]。各研究间无统计学异质性(P=0.24,I 2=21%),采用固定效应模型进行Meta分析,详见图2。Meta分析结果显示,试验组患者的治疗有效率显著高于对照组[RR=0.80,95%CI(0.73,0.88),P<0.000 01]。
按化疗方案的不同进行亚组分析。Meta分析结果显示,试验组联合TACE介入治疗方案[RR=0.79,95%CI(0.70,0.89),P<0.000 1]、三维适形放疗方案[RR=0.80,95%CI(0.69,0.93),P=0.04]患者的治疗有效率均显著高于对照组,而试验组联合FAP化疗方案患者的治疗有效率与对照组比较,差异无统计学意义[RR=0.86,95%CI(0.61,1.22),P=0.40],详见图2。
2.3.2 生存率 7项研究报道了生存率[8,11,14-16,20-21]。各研究间无统计学异质性(P=0.45,I 2=0),采用固定效应模型进行Meta分析,详见图3。Meta分析结果显示,试验组患者的生存率显著高于对照组[RR=0.81,95%CI(0.74,0.89),P<0.000 1]。
按生存时间不同进行亚组分析。Meta分析结果显示,两组患者的6个月生存率比较,差异无统计学意义[RR=0.99,95%CI(0.85,1.16),P=0.92];试验组患者的1年生存率 [RR=0.80,95%CI(0.69,0.93),P=0.004]、2年生存率[RR=0.77,95%CI(0.64,0.93),P=0.007]、3年生存率[RR=0.52,95%CI(0.30,0.92),P=0.02]均显著高于对照组,详见图3。
2.3.3 AFP含量 3项研究报道了AFP含量[7-9]。各研究间有统计学异质性(P<0.000 1,I 2=91%),采用随机效应模型进行Meta分析,详见图4。Meta分析结果显示,两组患者的AFP含量比较,差异无统计学意义[MD=22.08,95%CI(-1.28,45.43),P=0.06]。
2.3.4 NK细胞计数 3项研究报道了患者的NK细胞计数[10-11,19]。各研究间无统计学异质性(P=0.79,I 2=0),采用固定效应模型进行Meta分析,详见图5。Meta分析结果显示,试验组患者的NK细胞计数显著高于对照组[MD=-3.89,95%CI(-4.70,-3.09),P<0.000 01]。
2.3.5 T细胞亚群计数 6项研究报道了T细胞亚群计数[9-11,14,17,19]。各研究间有统计学异质性(P<0.000 01, I 2=99%),采用随机效应模型进行Meta分析,详见图6。Meta分析结果显示,试验组患者的T细胞亚群计数显著高于对照组[MD=-1.96,95%CI(-2.56,-1.36),P<0.000 01]。
按T细胞的不同进行亚组分析。Meta分析结果显示,试验组患者CD3+细胞计数[MD=-4.60,95%CI(-8.80, -0.40),P=0.03]、CD4+细胞计数 [MD=-3.32,95%CI(-6.26,-0.38),P=0.03]、CD4+/CD8+[MD=-0.18,95%CI(-0.31,-0.05),P=0.006]均顯著高于对照组;两组患者CD8+细胞计数比较,差异无统计学意义[MD=-1.78,95%CI(-4.15,0.59),P=0.14],详见图6。
2.3.6 肝功能指标 4项研究报道了肝功能指标[8-10,19]。各研究间有统计学异质性(P<0.000 01,I 2=97%),采用随机效应模型进行Meta分析,详见图7。Meta分析结果显示,两组患者的肝功能指标含量比较,差异无统计学意义[MD=4.09,95%CI(-5.02,13.20),P=0.38]。
按肝功能指标的不同进行亚组分析。Meta分析结果显示,两组患者TBIL含量[MD=-0.31,95%CI(-3.20,2.57),P=0.83]、ALT含量[MD=7.39,95%CI(-8.58,23.37),P=0.36]比较,差异均无统计学意义,详见图7。
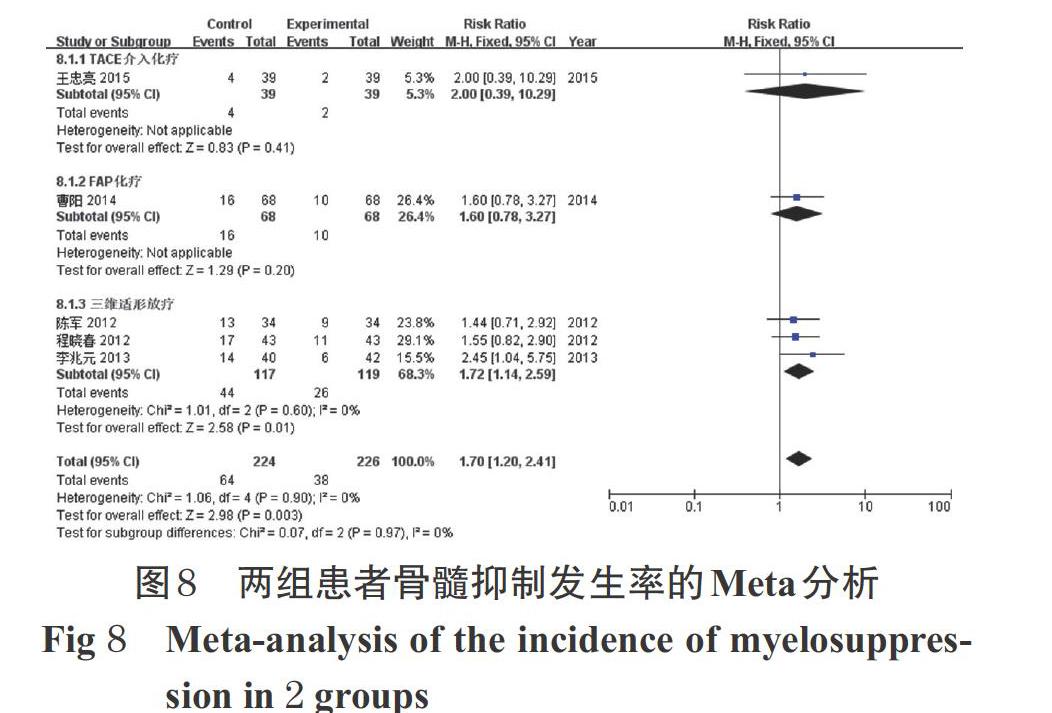
2.3.7 骨髓抑制发生率 5项研究报道了骨髓抑制发生率[12-16]。各研究间无统计学异质性(P=0.90,I 2=0),采用固定效应模型进行Meta分析,详见图8。Meta分析结果显示,试验组患者的骨髓抑制发生率显著低于对照组[RR=1.70,95%CI(1.20,2.41),P=0.003]。
按化疗方案的不同进行亚组分析。Meta分析结果显示,试验组联合三维适形放疗患者的骨髓抑制发生率显著低于对照组[RR=1.72,95%CI(1.14,2.59),P=0.01]。因TACE介入治疗和FAP化疗方案亚组各仅有1项研究[13-14],故对结果进行描述性分析,试验组联合TACE介入治疗和FAP化疗方案患者的骨髓抑制发生率与对照组比较,差异均无统计学意义(P>0.05),详见图8。
2.4 敏感性分析
以治疗有效率为指标进行敏感性分析,逐一剔除文献,发现在剔除李兆元等[14]的研究后,三维适形放疗亚组的统计学异质性降为(P=0.70,I 2=0);剔除后,试验组联合三维适形放疗患者的治疗有效率仍显著高于对照组。以生存率为指标进行敏感性分析,逐一剔除文献,发现各亚组的异质性无改变。
2.5 发表偏倚分析
分别以治疗有效率、生存率为指标,采用Eggers检验进行发表偏倚分析,结果见图9。由图9可见,治疗有效率Eggers检验的P=0.089>0.05,提示本研究存在发表偏倚的可能性较小;生存率Eggers检验的P=0.041<0.05,提示本研究存在发表偏倚的可能性较大。
2.6 TSA
本研究设定Ⅰ类错误概率α=0.05、Ⅱ类错误概率为β=0.2,以样本量为期望信息值(RIS)。根据治疗有效率的Meta分析结果对3个亚组进行TSA,结果见图10。由图10可见,FAP化疗方案组的累积Z值在纳入文献[13,17]时穿过了TSA界值,但未穿过传统界值,提示试验组联合FAP化疗方案患者的治疗有效率与对照组比较,差异无统计学意义的结果为真阴性。三维适形放疗组的累积Z值在纳入剩余两篇文献[15-16]时穿过了传统界值,但未穿过TSA界值,提示试验组联合三维适形放疗患者的治疗有效率与对照组比较,差异有统计学意义的结果为假阳性的可能性较大,有待进一步验证。TACE介入治疗组的累积Z值在纳入最后一篇文献[7]时,已达到所需样本量(RIS=436),即穿过了TSA界值,也穿过了传统界值,提示试验组联合TACE介入治疗患者的治疗有效率显著高于对照组的证据确切[23]。
2.7 GRADE证据质量等级评价
采用GRADE Profiler 3.6.1证据质量等级评价工具对结局指标进行证据质量评价,结果见表4。由表4可见,治疗有效率的证据等级为中级,生存率及骨髓抑制发生率的证据等级为低级,其余指标均为极低级。
3 讨论
PHC属中医“臌胀、症瘕、积聚”范畴[3]。《素问五脏生成论》曰:“肝藏,心行之,人动则血运于诸经,人静则血归于肝脏,……肝主血海故也”,提示其病机演变过程为肿瘤毒邪在体内蕴藏,入络客于血脉,影响氣、血、津、液的运行及输布;此外,肝气易郁结,常处于气郁血凝状态,使脉络失于流畅,导致毒滞络积聚,引起络中气滞、血瘀或津凝等病理改变[26]。复方斑蝥胶囊由斑蝥、人参、黄芪、三棱、刺五加、半枝莲、莪术、山茱萸、熊胆粉、女贞子和甘草等11味药材组成,方中斑蝥攻毒蚀疮,逐瘀散结为君药;莪术、三棱共为臣药,以加强斑蝥活血化瘀之功;人参、黄芪、刺五加、山茱萸、女贞子健脾补肾、补益气血、滋补肝肾、养阴生精,五药合用可驱邪而不伤正、并防止瘀毒扩散[27];半枝莲、熊胆粉为佐药,能清热解毒,化瘀利尿,助君药攻毒蚀疮;甘草调和诸药,为使药[28]。整方组合上扶正祛邪、攻补兼施,进而调节机体整体与局部的阴阳平衡,多用于治疗肝癌、肺癌、直肠癌、卵巢癌等相关疾病[29]。现代药理学研究表明,斑蝥所含的多种成分均具有抗肿瘤的特性,其主要活性成分斑蝥素可干扰肿瘤细胞核酸及蛋白质代谢,能明显抑制多种动物移植性肿瘤,具有抗癌作用[5,30]。
本研究结果显示,试验组在提高治疗有效率、生存率和NK细胞计数、T细胞计数(CD8+除外)、降低骨髓抑制发生率方面均显著优于对照组;在损害肝功能、降低AFP含量方面则无明显优势。敏感性分析结果显示,在以治疗有效率为指标进行的敏感性分析中发现,李兆元等[14]的研究为主要异质性来源;以生存率为指标进行敏感性分析,逐一剔除文献后,异质性无改变。发表偏倚分析结果显示,以治疗有效率为指标时提示本研究存在发表偏倚的可能性较小,以生存率为指标时提示本研究存在发表偏倚的可能性较大。TSA结果显示,试验组联合三维适形放疗方案治疗有效率结果存在假阳性可能,需扩大样本量进一步证实;试验组联合FAP化疗方案治疗有效率的结果为真阴性;试验组联合TACE介入治疗组患者的治疗有效率显著高于对照组的证据确切。GRADE证据评价结果显示,治疗有效率的证据等级为中级,生存率及骨髓抑制发生率的证据等级为低级,其余指标均为极低级。
综上所述,复方斑蝥胶囊联合不同放化疗方案用于PHC的疗效显著且安全性较好,尤以联合TACE介入治疗的疗效最佳,且治疗有效率的证据等级为中级。 但鉴于其余指标的证据等级不高,提示本研究仍存在偏倚的可能性。本研究局限性包括:(1)仅有7项研究明确了随机分配方法,其余虽提及随机分配但均未阐明具体方法,且无任一文献提及盲法和分配隐藏;(2)部分结局指标纳入的文献数量和患者例数较少;(3)西医常规治疗方案较为宽泛,对症治疗的措施因地域的差异而有所不同,可能会造成偏倚,从而影响最终结果的准确性。因此,结论仍需更多高质量、多中心、大样本的RCT进一步验证。
参考文献
[ 1 ] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Glo- bal cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[ 2 ] 江杰,胡宗强,陈刚,等.原发性肝癌转化治疗研究进展[J].临床肝胆病杂志,2020,36(8):1870-1873.
[ 3 ] 吴玉潇,盛庆寿.中医药治疗原发性肝癌的研究进展[J].广西医学,2020,42(4):483-485.
[ 4 ] 中国抗癌协会肝癌专业委员会.原发性肝癌诊断标准[J].中华肝脏病杂志,2000,8(3):135.
[ 5 ] 田劭丹,陈信义.中医药治疗恶性肿瘤特色与优势[J].现代中医临床,2019,26(2):8-17.
[ 6 ] 谢俊大,赵奎君,钟萌.复方斑蝥胶囊的药理与临床研究概况[J].国际中医中药杂志,2011,33(10):954-955.
[ 7 ] 洪桂花,陈思环,黄珊.复方斑蝥胶囊对原发性肝癌患者免疫功能及临床疗效的影响[J].世界中西医结合杂志,2020,15(2):365-368、373.
[ 8 ] 龙芳芳.观察疏肝健脾散结汤、复方斑蝥胶囊联合应用于原发性肝癌介入术后患者肝功能及生存率的影响[J].健康大视野,2020,(21):81、83.
[ 9 ] 赵士冲,谢长远,姚平刚.复方斑蝥胶囊对原发性肝癌介入治疗后细胞免疫功能的效果及机制[J].中华中医药学刊,2019,37(11):2785-2787.
[10] 赵延军,单宇鹏.复方斑蝥胶囊对原发性肝癌患者介入治疗后细胞免疫功能的影响[J].陕西中医,2018,39(1):77-79、134.
[11] 靳松,黄兆明,吴春明.复方斑蝥联合恩替卡韦治疗乙肝相关性肝癌TACE术后效果及对免疫功能、VEGF的影响[J].浙江中西医结合杂志,2018,28(11):939-941.
[12] 王忠亮.联用复方斑蝥胶囊和TACE对中晚期原发性肝癌患者进行治疗的效果分析[J].当代医药论丛,2015,13(22):260-261.
[13] 曹阳.复方斑蝥胶囊治疗原发性肝癌的有效性、安全性及经济性评价[J].中国医院用药评价与分析,2014,14(8):711-713.
[14] 李兆元,宁四清,易铁男,等.复方斑蝥胶囊联合化疗及放疗治疗中晚期原发性肝癌的疗效观察[J].中华全科医学,2013,11(8):1250-1251.
[15] 陈军,陈典.复方斑蝥胶囊联合三维适形放疗治疗中晚期原发性肝癌临床观察[J].现代肿瘤医学,2012,20(1):114-116.
[16] 程晓春,陈俊,郭建新,等.三维适形放疗联合复方斑蝥胶囊治疗中晚期原发性肝癌[J].中国基层医药,2012,19(18):2827-2828.
[17] 彭文达.复方斑蝥胶囊联合化疗治疗中晚期原发性肝癌的临床疗效观察[J].肿瘤药学,2011,1(6):518-519、543.
[18] 雷飞飞,李芳,谭华炳.复方斑蝥胶囊联合肝动脉栓塞化疗治疗原发性肝癌疗效观察[J].山西医药杂志,2011,40(10):1030-1031.
[19] 殷飞,李进军,曹凤,等.复方斑蝥胶囊对肝癌患者TACE治疗前后细胞免疫功能的影响[J].世界华人消化杂志,2011,19(17):1843-1846.
[20] 徐虎.復方斑蝥胶囊对晚期原发性肝癌生存率的影响[J].湖北中医杂志,2009,31(4):23-24.
[21] 李秋,陈红,张孟瑜.复方斑蟊胶囊联合肝动脉化疗栓塞治疗中晚期肝癌[J].中国中西医结合外科杂志,2005,11(2):130-131.
[22] 谷鸿秋,王杨,李卫. Cochrane偏倚风险评估工具在随机对照研究Meta分析中的应用[J].中国循环杂志,2014,29(2):147-148.
[23] 夏芸,孙瑛,刘兆兰,等.系统综述或Meta分析的样本量估算:试验序贯分析[J].北京中医药大学学报(中医临床版),2013,20(5):31-33.
[24] 曾宪涛,冷卫东,李胜,等.如何正确理解及使用GRADE系统[J].中国循证医学杂志,2011,11(9):985-990.
[25] 邝玉慧,陈欣菊,徐方飚.金龙胶囊联合放化疗治疗肝转移瘤的疗效与安全性Meta分析[J].肿瘤防治研究,2020,47(1):63-69.
[26] 高舒,华海清.中医药在肝癌免疫治疗中的研究进展[J].现代肿瘤医学,2013,21(6):1384-1387.
[27] 赵骏.复方斑蝥胶囊与吉非替尼联合对非小细胞肺癌患者疗效评价[J].中成药,2019,41(4):959-962.
[28] 姜洋,牛晓辉,高叶梅.复方斑蝥胶囊联合化疗治疗经典型骨肉瘤30例[J].中国中医骨伤科杂志,2020,28(2):63-65.
[29] 曾瑶波,刘晓玲,李创军,等.斑蝥化学成分及体外抗肿瘤活性研究[J].中国中药杂志,2016,41(5):859-863.
(收稿日期:2020-11-21 修回日期:2021-02-25)
(编辑:陈 宏)

