HPLC法测定贝林司他中有关物质的含量
孙朋杰 张莉 杜超 李伟 卓秋琪


中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2021)08-0973-06
DOI 10.6039/j.issn.1001-0408.2021.08.13
摘 要 目的:建立贝林司他中有关物质的含量测定方法。方法:采用高效液相色谱法检测并以加校正因子的主成分自身对照法进行计算。以ODS-AM为色谱柱,以1.02%磷酸二氢钾缓冲液(用磷酸调节pH值至3.5)-乙腈(85 ∶ 15,V/V)为流动相A、1.02%磷酸二氢钾缓冲液(用磷酸调节pH值至3.5)-乙腈(30 ∶ 70,V/V)为流动相B进行梯度洗脱,流速为1.0 mL/min,柱温为30 ℃,检测波长为220 nm,进样量为10 μL。结果:贝林司他及杂质A、D、F、G、H的线性范围分别为0.113~1.693、0.050~1.496、0.117~1.750、0.098~1.471、0.120~1.799、0.100~1.506 μg/mL(r≥0.999 7),后5个杂质的校正因子分别为1.0、1.0、1.2、1.5、1.0;检测限分别为0.250、0.590、0.490、0.600、0.500 ng,定量限分别为0.500、1.170、0.980、1.200、1.000 ng,回收率为90.18%~111.48%(RSD为1.52%~4.78%,n=9),稳定性(100 h)、精密度试验的RSD均不大于16%,耐用性良好。3批贝林司他原料药中检测出杂质A、D、H,含量分别为0.030%~0.038%、0.019%~0.022%、0.012%~0.013%,其他最大单体杂质含量为0.012%~0.013%,总杂质含量为0.075%~0.084%,未检出杂质B、C、F、G。结论:成功建立了测定贝林司他中有关物质含量的方法,且方法准确、专属性好。
关键词 贝林司他;有关物质;高效液相色谱法;加校正因子的主成分自对照法
Content Determination of Related Substances in Belinostat by HPLC
SUN Pengjie1,ZHANG Li1,DU Chao1,2,LI Wei2,ZHUO Qiuqi1(1. Shenzhen Wanle Pharmaceutical Co., Ltd., Shenzhen 518000, China; 2. School of Chemistry and Biological Engineer, Yichun University, Jiangxi Yichun 336000, China)
ABSTRACT OBJECTIVE: To establish the method for the content determination of related substances in belinstat. METHODS: HPLC method was adopted and the principal component self-control comparison method with correction factor was used to calculate the contents of related substances. The determination was performed on ODS-AM column with 1.02% potassium dihydrogen phosphate buffer (pH value adjusted to 3.5 with phosphoric acid)-acetonitrile (85 ∶ 15,V/V) as mobile phase A, 1.02% potassium dihydrogen phosphate buffer (pH value adjusted to 3.5 with phosphoric acid)-acetonitrile (30 ∶ 70, V/V) as mobile phase B (gradient elution), at the flow rate of 1.0 mL/min. The column temperature was set at 30 ℃, and the detection wavelength was 220 nm. The sample size was 10 μL. RESULTS: The linear ranges of belinstat and impurities A, D, F, G, H were 0.113-1.693, 0.050-1.496, 0.117-1.750, 0.098-1.471, 0.120-1.799, 0.100-1.506 μg/mL (r≥0.999 7). The correction factors of the last 5 impurities were 1.0, 1.0, 1.2, 1.5, 1.0; the detection limits were 0.250, 0.590, 0.490, 0.600, 0.500 ng, respectively. The quantification limits were 0.500, 1.170, 0.980, 1.200, 1.000 ng, respectively. The recoveries were 90.18%-111.48% (RSD=1.52%-4.78%, n=9). RSDs of stability (100 h) and precision tests were no more than 16%, and the durability was good. Impurities A, D and H were detected in 3 batches of belinlestat, the contents were 0.030%-0.038%, 0.019%-0.022% and 0.012%-0.013%, respectively. The contents of other maximum monomer impurities were 0.012%-0.013% and the total impurities were 0.075%-0.084%. Impurities B, C,F, G were not detected. CONCLUSIONS: The method for the content determination of related substances in belinstat has been successfully established, and the method is accurate and specific.
KEYWORDS Belinostat; Related substances; HPLC; Principal component self-control comparison method with correction factor
贝林司他(结构式见图1)是一种组蛋白去乙酰化酶(HDAC)抑制剂,由美国Spectrum Technologies公司和丹麦TopoTarget公司联合研发生产,主要用于治疗复发性或难治性外周T细胞淋巴瘤(PTCL)[1-5]。贝林司他于2009年被授予孤儿药地位,用于治疗PTCL;2013年,贝林司他的PTCL二期临床结果超过预期值,其新药申请于2014年2月6日被美国FDA受理,并于2014年7月3日通过审批获准上市。目前,在国内已有盛世泰科生物医药技术(苏州)有限公司和石药控股集团有限公司对其进行仿制药临床申报[6]。
临床前体外药效学研究显示,贝林司他对各种HDAC的抑制作用较好,其不仅能够提高组蛋白的乙酰化水平,还能够促进细胞凋亡;更重要的是,贝林司他可优先杀伤肿瘤细胞而非正常细胞,并可抑制纳摩尔浓度HDAC的活性[7-11]。毒性研究显示,贝林司他有一定的毒性,但是相对于该药给复发性、难治性淋巴瘤患者带来的临床获益,这些毒性反应是可以接受的[12-14]。此外,贝林司他用于治疗卵巢癌、胸腺上皮癌、骨髓异常增生癥、恶性腹膜间皮瘤等其他肿瘤的二期临床试验研究结果均显示,其具有较好的疗效[14-17]。由此可见,贝林司他的临床使用前景良好。
有关物质主要是在生产过程中带入的起始原料、中间体、聚合体、副反应产物,以及贮藏过程中的降解产物等,其中生产过程中带入的列为工艺杂质,贮藏过程中新增或含量出现增长的杂质列为降解杂质。有关物质是药品质量研究的关键项目之一,其含量高低是反映药品纯度的直接指标。有研究指出,对药品的纯度要求,应基于安全性和生产实际情况两方面的考虑[18]。基于此,本研究采用高效液相色谱法(HPLC)联合加校正因子的主成分自身对照法针对贝林司他生产及贮藏中可能引入的7种杂质进行定性分析,考虑到杂质对照品的可获得性仅对其中5种杂质进行定量分析,以期能将各杂质及主成分有效分离,并为贝林司他的质量控制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括e2695型HPLC仪(美国Waters公司)、XP205型电子分析天平(瑞士Mettler Toledo公司)等。
1.2 主要药品与试剂
贝林司他原料药(批号171201、180101、180102,纯度≥99%)、杂质A对照品(批号140813,纯度99.3%)、杂质B对照品(批号140810,纯度99.5%)、杂质C对照品(批号140822,纯度99.4%)、杂质D对照品(批号140801,纯度99.9%)、杂质F对照品(批号140806,纯度99.1%)、杂质G对照品(批号150416,纯度99.5%)、杂质H对照品(批号140903,纯度98.6%)均由深圳万乐药业有限公司提供;乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 色谱条件
以ODS-AM(250 mm×4.6 mm,5 μm)为色谱柱,以1.02%磷酸二氢钾缓冲液(用磷酸调节pH值至3.5)-乙腈(85 ∶ 15,V/V)为流动相A、1.02%磷酸二氢钾缓冲液(用磷酸调节pH值至3.5)-乙腈(30 ∶ 70,V/V)为流动相B进行梯度洗脱(洗脱程序见表1),流速为1.0 mL/min,柱温为30 ℃,检测波长为220 nm,进样量为10 μL。
2.2 溶液的制备
2.2.1 供试品溶液 取贝林司他原料药约50 mg,置于100 mL量瓶中,加流动相B溶解并定容,摇匀,制成质量浓度为0.5 mg/mL的供试品溶液。
2.2.2 自身对照溶液 取“2.2.1”项下供试品溶液1 mL,置于1 000 mL量瓶,加流动相B稀释并定容,摇匀,制成质量浓度为0.5 μg/mL的自身对照溶液。
2.2.3 杂质单一对照品溶液 取杂质A、B、C、D、F、G、H对照品适量,均用流动相B溶解、稀释,摇匀,制成质量浓度均为0.5 mg/mL的单一对照品溶液。
2.2.4 系统适用性混合溶液 取“2.2.1”项下供试品溶液和“2.2.3”项下杂质A、B、C、D、F、G、H的单一对照品溶液各适量,用流动相B溶解、稀释,摇匀,制成贝利司他质量浓度为0.5 mg/mL,杂质A、B、C、D、F、G、H质量浓度均为5 μg/mL的系统适用性混合溶液。
2.3 系统适用性试验
精密量取系统适用性混合溶液和空白溶液(流动相B)适量,按“2.1”项下色谱条件进样测定,记录色谱图。结果,杂质F、杂质B、贝林司他、杂质H、杂质D、杂质G、杂质C、杂质A的出峰时间依次为16.123、18.475、19.222、21.699、29.609、35.165、38.227、42.317 min;以贝林司他峰计,各峰的相对保留时间分别为0.84、0.96、1.00、1.13、1.54、1.83、1.99、2.20;分离度均大于1.5,理论板数均大于80 000;空白溶液对测定无干扰,详见图1。
2.4 破坏试验
取贝林司他原料药适量,分别进行高温(100 ℃下放置48 h)、光照[(5 000±500)lx下放置45天]、酸(加2 mol/L盐酸溶液2 mL,于60 ℃下加热1.5 h)、碱(加2 mol/L氢氧化钠溶液2 mL,于60 ℃下加热1.5 h)、氧化(加5%H2O2溶液2 mL,于60 ℃下加热6 h)破坏试验,按“2.2.1”项下方法制成供试品溶液后,再按“2.1”项下色谱条件进样测定,记录峰面积,并与未破坏的供试品溶液进行对比。结果表明,在不同的破坏条件下,贝林司他与各降解物均能有效分离,其中贝林司他对温度、光照均较稳定,对酸、碱、氧均较敏感,且其主要降解杂质均为杂质D,详见图2(以主成分为参照,根据相对保留时间判定各色谱峰的归属)。
2.5 线性关系和校正因子考察
精密称取贝林司他原料药和杂质A、D、F、G、H对照品各约10 mg,置于100 mL量瓶,加甲醇溶解并稀释至刻度,混匀;移取上述溶液5 mL,置于100 mL量瓶,加流动相B稀释至刻度,得混合线性对照品贮备液。取贮备液适量,用流动相B稀释至各杂质含量分别为主成分的0.02%、0.04%、0.08%、0.10%、0.12%、0.24%、0.30%,按“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,以主成分为参比物质计算校正因子(即主成分贝林司他的线性斜率/对应杂质的线性斜率)。贝林司他和5个杂质的线性关系及校正因子见表2。
2.6 检测限与定量限考察
取“2.5”项下混合线性对照品贮备液以流动相B进行逐级稀释,按“2.1”项下色谱条件进样测定,以信噪比3 ∶ 1、10 ∶ 1分别计算检测限和定量限。结果,杂质A、D、F、G、H的检测限分别为0.250、0.590、0.490、0.600、0.500 ng,定量限分别为0.500、1.170、0.980、1.200、1.000 ng。
2.7 准确度试验
取贝林司他原料药适量,精密称定,加入“2.5”项下混合线性对照品贮备液,制成对应单个杂质浓度为0.05%、0.10%、0.20%的样品溶液,各配制3份,按“2.1”項下色谱条件进样测定,记录峰面积并计算回收率。结果,杂质A、D、F、G、H的回收率分别为99.21%~106.78%、95.01%~111.48%、100.19%~104.45%、90.18%~100.56%、95.03%~104.33%,RSD分别为2.37%、4.78%、1.52%、3.65%、3.86%(n=9),表明该方法的准确度良好。
2.8 溶液稳定性试验
取“2.2.1”项下供试品溶液适量,分别在室温(放置0、12、52、100 h)、冰箱冷藏(2~8 ℃,放置0、50、100 h)下保存,分别于上述时间点精密量取10 μL,按“2.1”项下色谱条件进样测定,记录峰面积并按加校正因子的主成分自身对照法计算含量。结果,主成分和总杂质含量基本稳定,无新杂质出现;检出杂质A、D、H,未检出杂质B、C、F、G,提示供试品溶液在上述条件下放置100 h稳定,详见表3、表4。
2.9 精密度试验
2.9.1 重复性 按“2.2.1”项下方法制备供试品溶液,平行制备6份,再按“2.1”项下色谱条件进样测定,记录峰面积,并按加样正因子的主成分自身对照法计算含量。结果,供试品溶液中只检测出杂质A、D、H,未检出杂质B、C、F、G,详见表5。
2.9.2 中间精密度 分别由2名试验人员于不同时间按“2.2.1”项下方法制备供试品溶液,平行制备6份,再按“2.1”项下色谱条件进样测定,记录峰面积并按加校正因子的主成分自身对照法计算含量。结果,供试品溶液中只检测出杂质A、D、H,未检出杂质B、C、F、G,详见表6。
2.10 耐用性试验
按“2.2.1”“2.2.2”项下方法制备供试品溶液和自身对照溶液,在“2.1”项下色谱条件基础上,调整流速(0.8、1.0、1.2 mL/min)、柱温(25、30、35 ℃)、色谱柱[ODS-AM(250 mm×4.6 mm,5 μm),批号054、055、056],分别进样测定,记录峰面积并按加样正因子的主成分自身对照法计算含量。结果,在不同色谱条件下,杂质A、D、H含量变化值最大分别为0.002%、0.004%、0.002%,最大单杂含量变化值最大为0.002%,总杂质含量变化值最大为0.008%,杂质B、C、F、G均未检出,详见表7。
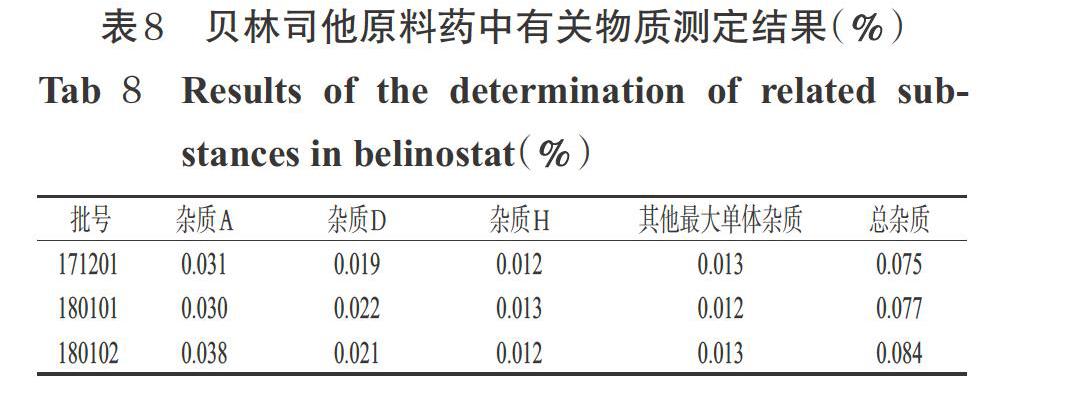
2.11 贝林司他原料药中有关物质含量的测定
取3批贝林司他原料药,按“2.2.1”项下方法制成供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按加校正因子的主成分自身对照法计算含量。结果,贝林司他样品中只检测出了杂质A、D、H,且含量均符合规定(本研究根据ICH指导原则[19]及本品实际生产情况,拟定最大单杂不得过0.1%),杂质B、C、F、G均未检出,详见表8。
3 讨论
3.1 色谱条件的筛选
经笔者查询,国内外药典均无贝林司他有关物质检查方法和含量测定方法的相关规定。本研究首先经过预实验摸索拟定初步的色谱条件,之后根据所需要研究的杂质情况对色谱条件进行优化。结果,所建方法不受空白溶剂的干扰,主峰与前后相邻杂质分离度均大于1.5。
3.2 稀释剂的选择
贝林司他原料药及杂质对照品在水中的溶解度均较差,在有机溶剂中的溶解度较好。为了减少样品稀释剂与流动相差异引起的基线波动,经预实验发现,流动相B[1.02%磷酸二氢钾缓冲液(pH 3.5)-乙腈(30 ∶ 70,V/V)]对贝林司他和杂质的溶解性均较好,且对其测定无干扰,因此选择流动相B作为溶剂。
3.3 检测波长的选择
本研究预实验发现,贝林司他及各杂质在220 nm波长附近均有较大吸收,因此选择220 nm作为贝林司他有关物质的检测波长。
综上所述,本研究所建立的HPLC法能使贝林司他的主峰与杂质A、B、C、D、F、G、H得到良好分离。同时,破坏试验结果显示,贝林司他降解过程中质量基本稳定,且主峰与各降解杂质均能达到良好分离。经检验,本研究中所使用的3批贝林司他原料药中仅存在杂质A、D、H,且含量均较低,杂质B、C、F、G均未检出。可见,本研究成功建立了测定贝林司他中有关物质含量的方法,且方法准确、专属性好。
参考文献
[ 1 ] LU P,GU Y,LI L,et al. Belinostat suppresses cell proli- feration by inactivating Wnt/β-catenin pathway and promotes apoptosis through regulating PKC pathway in breast cancer[J]. Artif Cells Nanomed Biotechnol,2019,47(1):3955-3960.
[ 2 ] ATTIA S M,AL-HAMAMAH M A,ALOTAIBI M R,et al. Investigation of belinostat-induced genomic instability by molecular cytogenetic analysis and pathway-focused gene expression profiling[J]. Toxicol Appl Pharmacol,2018,350(1):43-51.
[ 3 ] TAKEBE N,BEUMER J H,KUMMAR S,et al. A phase Ⅰ pharmacokinetic study of belinostat in patients with advanced cancers and varying degrees of liver dysfunction[J]. Br J Clin Pharmacol,2019,85(11):2499-2511.
[ 4 ] PASSERO F C,RAVI D,MCDONALD J T,et al. Combinatorial ixazomib and belinostat therapy induces NFE2L2- dependent apoptosis in Hodgkin and T-cell lymphoma[J]. Br J Haematol,2020,188(2):295-308.
[ 5 ] 賈文华,毛慧,陈婉如,等.组蛋白去乙酰化酶抑制剂Belinostat对髓源性树突状细胞免疫功能的作用研究[J].中华血液学杂志,2018,39(1):41-46.
[ 6 ] 周付科,郭晓赟,迟丽娜,等.贝利司他药物专利分析[J].中国新药杂志,2019,28(17):2069-2075.
[ 7 ] ABBOTT K L,CHAUDHURY C S,CHANDRAN A,et al.Belinostat,at its clinically relevant concentrations,inhi- bits rifampicin-induced CYP3A4 and MDR1 gene expression[J]. Mol Pharmacol,2019,95(3):324-334.
[ 8 ] POH C,ARORA M,GHUMAN S,et al. Belinostat in relapsed/refractory T-cell large granular lymphocyte leukemia[J]. Acta Haematol,2020,29(1):1-5.
[ 9 ] STEWART A,YATES I,MUDIE D,et al. Mechanistic study of belinostat oral absorption from spray-dried dispersions[J]. J Pharm Sci,2019,108(1):326-336.
[10] LIEW W C,SUNDARAM G M,QUAH S,et al. Belinostat resolves skin barrier defects in atopic dermatitis by targeting the dysregulated miR-335:SOX6 axis[J]. J Allergy Clin Immunol,2020,146(3):606-620.
[11] MARAMPON F,DI NISIO V,PIETRANTONI I,et al.Pro-differentiating and radiosensitizing effects of inhibi- ting HDACs by PXD-101(belinostat)in in vitro and in vivo models of human rhabdomyosarcoma cell lines[J]. Cancer Lett,2019,461(1):90-101.
[12] ZHENG S,GUO S,ZHONG Q,et al. Biocompatible boron-containing prodrugs of belinostat for the potential treatment of solid tumors[J]. ACS Med Chem Lett,2018,9(2):149-154.
[13] AGARWAL N,MCPHERSON J P,BAILEY H,et al. A phase I clinical trial of the effect of belinostat on the pharmacokinetics and pharmacodynamics of warfarin[J]. Cancer Chemother Pharmacol,2016,77(2):299-308.
[14] ZHANG J H,MOTTAMAL M,JIN H S,et al. Design,synthesis and evaluation of belinostat analogs as histone deacetylase inhibitors[J]. Future Med Chem,2019,11(21):2765-2778.
[15] 彭斌,何敏,李正茂,等.贝利司他抑制骨肉瘤细胞活力的分子机制[J].中国病理生理杂志,2020,36(3):552-556.
[16] 赵倩,屈慧新,史慧静,等.治疗复发或难控型外周T细胞淋巴瘤新药:贝林司他[J].医药导报,2016,35(5):551- 554.
[17] 王娅莉,刘月,班璐,等.非达霉素原料药中有关物质的检查方法研究[J].中国药房,2020,31(5):581-585.
[18] 雷成康,郭玲. 2015年版《中国药典》环磷酰胺有关物质检测方法的验证与改进[J].中国药房,2016,27(36):5122-5124.
[19] ICH. Impurities in new drug substances:Q3A(R2)[S]. 2006- 10-25.
(收稿日期:2020-12-29 修回日期:2021-03-30))
(编辑:邹丽娟)

