镉诱导小鼠原代神经细胞程序性坏死的机制
何邵波,蒋传命
邵阳学院医学检验学院,湖南 邵阳 422000
镉作为常见的具有高毒性的重金属污染物,通常以二价化合物的形式存在于水体和土壤中[1]。镉目前已被国际癌症研究机构列为强致癌物质,由于其分布广、半衰期长以及易摄取等特点,容易在动物体内积累,从而导致慢性中毒,如肾中毒[2]。长时间镉暴露也可引起器官纤维化或衰竭[3],甚至癌症[4]。镉导致上述疾病的机制可能与细胞所受的外界刺激密切相关:当刺激较大时,细胞死亡途径被激活从而介导细胞死亡;而当刺激不足以导致细胞死亡时,细胞可能失控而出现恶性转化[5]。镉暴露导致的细胞死亡可分为细胞凋亡和细胞坏死,现阶段关于凋亡的研究较多,主要有凋亡样、Caspase 依赖或非依赖的细胞凋亡途径。
细胞坏死包括程序性坏死和非程序性坏死[6]。其中,细胞程序性坏死通常与活性氧(reactive oxygen species,ROS)导致的膜脂过氧化,ATP 产生不足导致的质膜离子泵功能紊乱,以及有毒物质的直接化学攻击有关[6]。以往的研究大多关注镉诱导细胞凋亡的机制,而其导致细胞程序性坏死的机制目前仅有少量报道。研究表明肠外急性镉暴露可导致大鼠睾丸和非人灵长类动物睾丸出血坏死,而急性口服镉溶液则可引起胃和肠黏膜坏死[7]。同时也有研究报道,浓度大于50 μmol·L-1的氯化镉会引起肾细胞坏死,而低浓度镉会引起细胞凋亡[8]。最新的研究也显示重金属镉诱导的氧化应激通过调控淋巴细胞的miR-216a-PI3K/AKT信号途径促进细胞凋亡和坏死[9]。此外,关于骨肉瘤的一项异种移植研究发现,镉诱导骨肉瘤坏死并降低骨肉瘤残余细胞的存活能力[10]。
细胞程序性坏死并不是一个孤立的生物学过程,细胞自噬在细胞程序性坏死过程中发挥作用。自噬的发生及发展受到精密调控,从自噬相关基因1(autophagy related gene 1,Atg1)发现以来,在酵母以及哺乳动物中相继鉴定出了一系列自噬相关基因[11],其中自噬相关基因8(autophagy related gene 8,Atg8)[哺乳动物中为自噬微管相关蛋白1 轻链3(microtubule-associated protein 1 light 3,LC3),包 括LC3A~C],由于其能结合到自噬体膜的脂质分子上,其活化形式可以作为自噬发生的标志之一[12]。相反,若细胞或组织中自噬降解底物p62 蛋白积累或阳性,则说明自噬流被阻断[13]。在神经细胞中有研究表明细胞自噬和细胞凋亡可以共同调控细胞死亡[14]。
为探究镉诱导细胞程序性坏死的机制,本研究将以小鼠原代神经细胞为材料,首先用氯化镉处理细胞计算其存活率,然后用流式细胞仪分别检测其细胞周期和细胞程序性坏死相关基因[受体相互作用丝氨酸苏氨酸激酶3(receptor interacting serine threonine kinase 3,RIPK3)和混合系列蛋白激酶样结构域蛋白(mixed lineage kinase domain-like,MLKL)]转录水平,最后检测自噬相关蛋白p62 的蛋白表达水平以及p62和LC3-B 蛋白的荧光积累量,探讨镉诱导细胞程序性坏死是否依赖细胞自噬途径。
1 材料与方法
1.1 主要材料与仪器
DMEM 培养基(Sigma,美国),NeurobasalTMMedia(Gibco,美国),HBSS 培养基(Gibco,美国),Trypsin(Sigma,美国),胎牛血清(Gibco,美国),p62 抗 体(Sigma,美 国),GAPDH 抗 体 (TransGen Biotech,中国),羊抗鼠IgG-HRP 抗体(TransGen Biotech,中国),GFP-LC3-B 腺病毒、mCherry-p62 腺病毒(Beyotime,中国),氯化镉(国药,中国),多聚甲醛(国药,中国),碘化丙啶(propidium iodide,PI)、台盼蓝、天冬氨酸蛋白酶抑制试剂Pepstatin A、丝氨酸和半胱氨酸蛋白酶抑制剂Leupeptin(Sigma,美国),RNase A、HEPES、PBS、NaCl、Glycerol、PMSF、Triton-X(上海生工,中国),WB 增强型化学发光试剂(Vazyme,中国),RNA 提取以及实时荧光定量试剂盒(上海生工,中国),BCA 试剂盒(Beyotime,中国),Annexin V-FITC/PI 双染试剂盒(BestBio,中国)。
-80℃超低温冰箱(Thermo,美国),7500 型实时荧光定量PCR 仪(ABI,美国),IX73 型倒置显微镜(Olympus,日本),H2050R 高速冷冻离心机(湘仪,中国),二氧化碳培养箱(Salvis,瑞士),全波长酶标仪(Molecular devices,美国),BD LSR Fortessa 流式细胞仪(BD,美国)。
1.2 原代小鼠神经元的分离和培养
取妊娠10~12 d 的ICR 小鼠(25~30 g)脱臼处死,用75%的乙醇浸泡15 min,在生物安全柜中取出小鼠子宫,放置于4℃预冷的HBSS 中备用。然后迅速取出胎鼠再在解剖镜下剥离大脑皮质置于培养皿中。将上述组织剪碎后转移至离心管中,用体积分数0.01%的胰酶消化至组织块逐渐消失。取等量的含10% FBS 的DMEM轻轻吹打终止消化,100×g离心5 min,弃上清,用1 mL NeurobasalTMMedia重悬细胞并计数。取1×106个细胞接种于经10 ng·L-1多聚赖氨酸包被过的6 孔板中培养,体积2 mL。每48 h进行培养基半量换液,经3次换液后即可用于后续实验[15]。本实验已通过邵阳学院实验动物伦理委员会审批(无编号)。
1.3 台盼蓝染色检测细胞存活率
取1×106个小鼠原代神经元细胞接种到含2 mL 培养液的12 孔板中(经10 ng·L-1多聚赖氨酸包被),培养2 d 后用10 μmol·L-1氯化镉(用超纯水配制)处理2、4、6、12、24、48 h,用台盼蓝染色法计算细胞存活率。实验组和对照组各设6个重复孔。
1.4 流式细胞分析细胞周期和细胞程序性坏死
取1×106个小鼠原代神经元细胞培养24 h 后,分别用10 μmol·L-1氯化镉处理24、48 h。胰酶消化并离心收集细胞,弃上清,用预冷PBS 洗细胞两次,加入预冷70%乙醇固定。然后离心去上清并用1 mL 的PBS洗一次,加入500 μL PBS(含40 mg·L-1PI、100 mg·L-1RNase A),4℃避光处理30 min 后用流式细胞仪检测细胞周期。
通过Annexin V-FITC/PI 双染试剂盒检测细胞程序性坏死水平,将10 μmol·L-1氯化镉处理48 h,细胞消化重悬后,1×PBS清洗3次,然后200 μL的1×PBS重悬,依次加入Annexin V-FITC及PI染色液,室温孵育30 min后用流式细胞仪检测细胞程序性坏死状况。
1.5 实时荧光定量PCR 法检测细胞程序性坏死相关基因
参照试剂盒(上海生工)的说明书进行了RNA 提取以及实时荧光定量。引物序列如下,Actin正向引物:5’-CAACGAGCGGTTCCGATG-3’,Actin反向引物:5’-GCCACAGGATTCCATACCCA-3’;RIPK3正向引物:5’-GAAGACACGGCACTCCTTGGTA-3’,RIPK3反向引物:5’-GGTGGTTCTTGA TG ACGGAGTTC-3’;MLKL正向引物:5’-CTGAGGGAACTGCTGGATAGAG-3’,MLKL反向引物:5’-TAGTCGTCGAGGTCAAAGGAGC-3’。基因反转录和扩增程序如下:50℃反转录5 min,95℃预变性3 min,95℃变性10 s,60℃退火、延伸,采集荧光信号30 s,共扩增40 个循环。
1.6 自噬相关蛋白p62和LC3-B 蛋白检测
1.6.1 蛋白免疫印迹法检测p62 蛋白含量原代神经元细胞培养24 h 后,分 别用5、10、20 μmol·L-1氯化镉处理24 h 后用离心管收集细胞,预冷PBS 冲洗两次,加入1 mL 预冷的裂解缓冲液[含50 mmol·L-1HEPES(pH=7.4)、137 mmol·L-1NaCl、10% Glycerol、1%TritonX-100、Pepstatin A(1 mg·L-1)、Leupeptin(1 mg·L-1)、PMSF(1 mmol·L-1)]置于冰上,超声裂解10 s,冰浴10 min。13 000×g,4℃离心10 min,取上清,用BCA试剂盒(碧云天)测定蛋白浓度[16]。一抗p62、GAPDH按照1∶3 000的比例用PBST 进行稀释,4℃孵育过夜。经PBST 漂洗后,二抗羊抗鼠IgG-HRP以1∶4 000进行稀释,室温孵育2 h,用PBST漂洗后进行检测。
1.6.2 显微荧光观察法检测p62 和LC3-B 蛋白积累水平将5×106个小鼠原代神经元细胞接种到含2 mL 培养基的6 孔板(已用多聚赖氨酸包被)上培养1 d,然后用GFP-LC3-B、mCherry-p62 腺病毒感染细胞24 h,用于标记LC3-B、p62(荧光显微镜下分别显示为绿色荧光、红色荧光)。用10 μmol·L-1氯化镉处理上述细胞,每个处理组设6 个平行重复,处理完毕后将所含有细胞的盖玻片用PBS 漂洗3次,用4%多聚甲醛于室温固定45 min,PBS 漂洗3 次,封片,于荧光显微镜下成像拍照[17]。饥饿细胞(即营养匮乏,用HBSS 培养基代替DMEM 培养基)作为阳性对照。
1.7 统计学分析
采用SPSS 25.0 软件进行统计学分析,数据以均数±标准差表示。多组间比较采用单因素方差分析。检验水准α=0.05。
2 结果
2.1 镉离子导致原代小鼠神经元细胞活力降低
如图1所示,经台盼蓝染色以及统计分析发现,用镉离子处理4 h 后,实验组较对照组细胞存活率明显下降(P<0.05)。

图1 不同染毒时间10 μmol·L-1氯化镉处理组小鼠原代神经元细胞存活率(n=6)Figure 1 Survival rate of mouse primary neurons treated with 10 μmol·L-1 CdCl2 for different exposure time (n=6)
2.2 镉离子导致细胞周期停滞G0期
如图2所示:对照组49.62%细胞停留在G0―G1期,10 μmol·L-1镉离子处理24 h 组60.88%细胞停留在G0―G1期,处理48 h组82.94%细胞停留在G0―G1期。
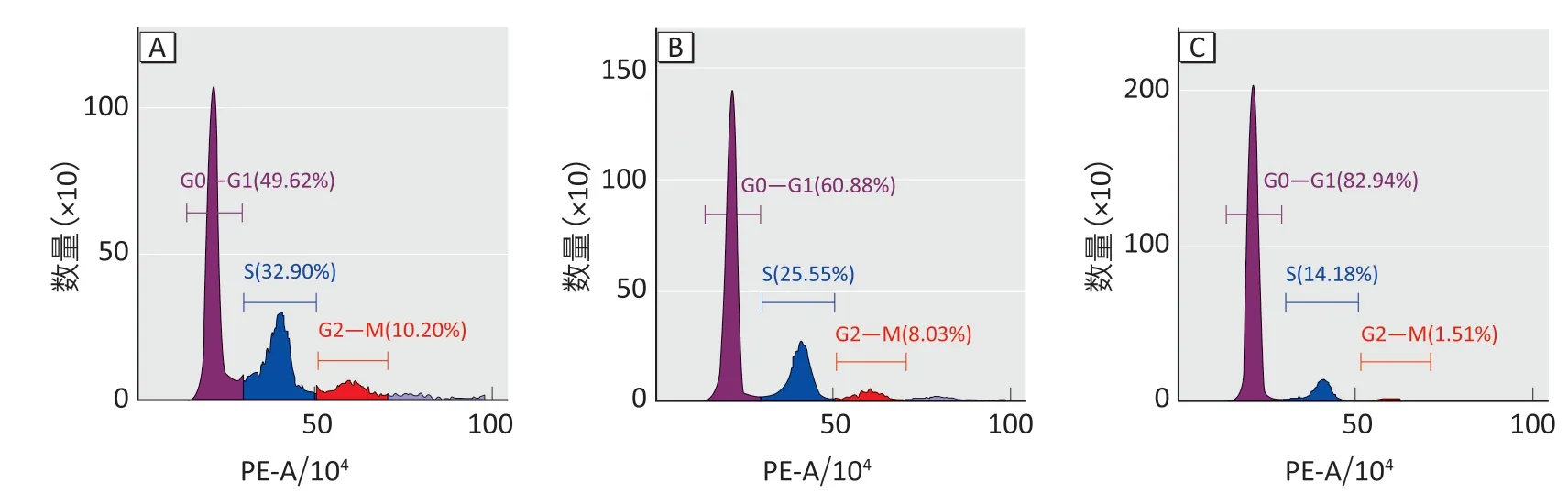
图2 镉离子处理后小鼠原代神经元经细胞周期检测结果Figure 2 Cell cycle of mouse primary neurons after treatment with cadmium ions
2.3 镉离子处理导致神经元细胞程序性坏死
相对于对照组而言,经10 μmol·L-1镉离子处理48 h后,细胞出现PI 单染阳性的水平明显提高(47.50%)(图3A、3B)。进一步荧光定量PCR 结果显示,经镉离子处理后,细胞程序性坏死相关基因RIPK3以及MLKL的mRNA水平是对照组的6.9 倍和3.7 倍(图3C)。
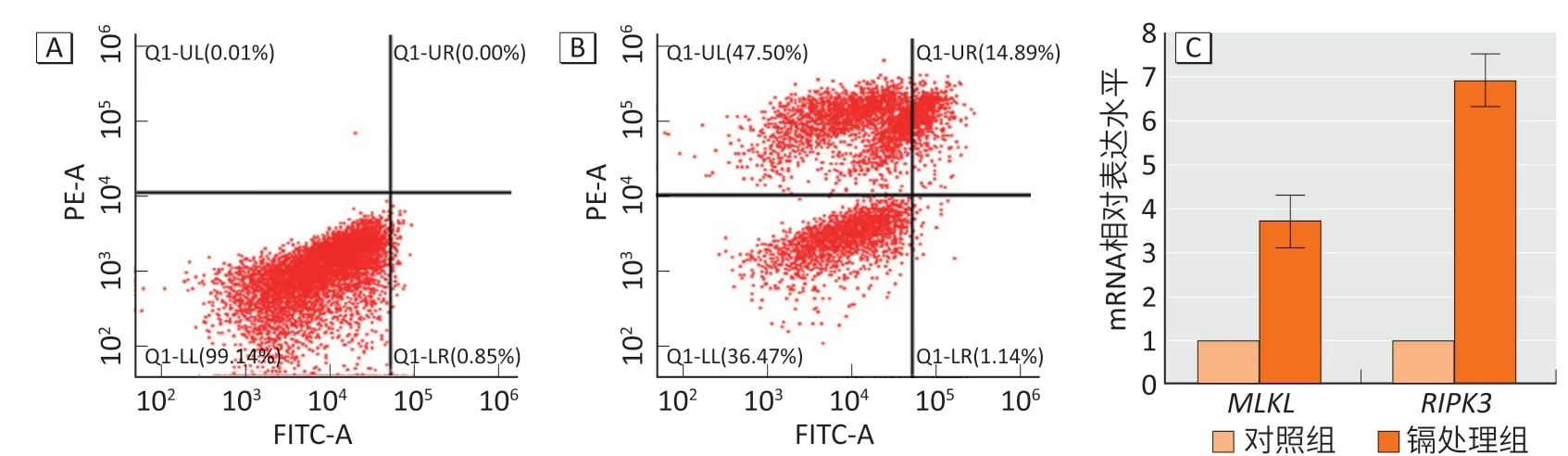
图3 小鼠原代神经元经镉离子处理48 h后细胞程序性坏死水平Figure 3 Cell necroptosis of mouse primary neurons after treatment with cadmium ions for 48 h
2.4 镉离子处理导致神经元细胞自噬流阻断
蛋白免疫印迹结果发现(图4A),经5、10、20 μmol·L-1氯化镉处理24 h后小鼠原代神经元细胞自噬相关蛋白p62 表达分别上调(587±17)%、(609±14)%、(893±16)%。进一步,荧光检测细胞自噬流的关键指标LC3-B发现,与对照组相比,经10 μmol·L-1氯化镉处理后GFP-LC3-B斑点数量明显增多,荧光强度提高约3.24倍(图4B)。GFP-LC3-B和mCherry-p62荧光位置能完全叠加,镉离子处理组GFP-LC3-B 和mCherry-p62 荧光斑点数量和亮度高于对照组、阳性对照组(图4C)。
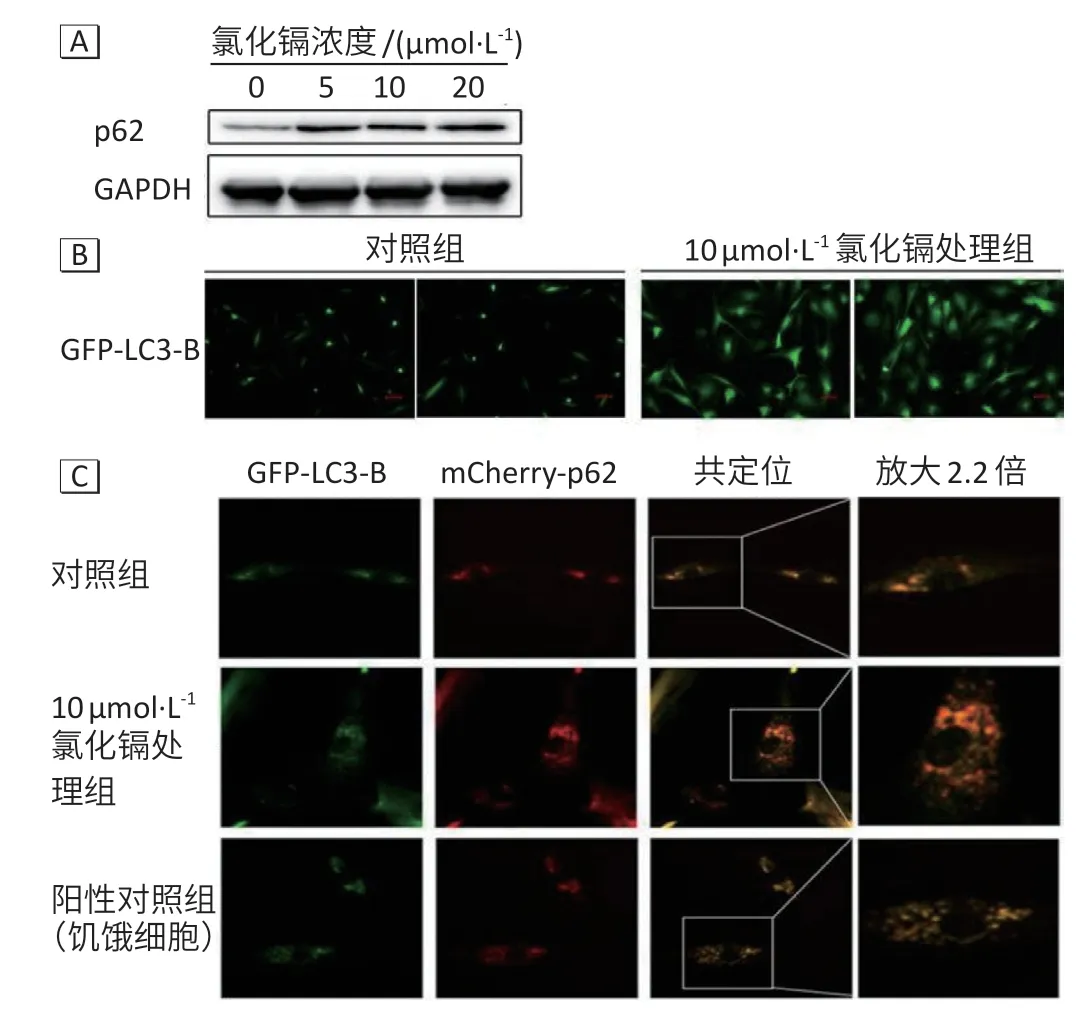
图4 镉离子染毒后小鼠原代神经元自噬相关蛋白表达Figure 4 Expressions of autophagy-related proteins in mouse primary neurons after treatment with cadmium ions
3 讨论
镉离子污染引起的人群健康风险近年来越来越受到学者们的重视[18],其不仅可以影响基因表达,抑制DNA 损失修复,也可导致细胞凋亡、坏死以及氧化应激反应等[19]。然而,镉引起神经细胞程序性坏死的具体机制仍有待深入研究。本研究发现镉离子可通过抑制小鼠原代神经细胞的自噬流进而引起细胞程序性坏死。当小鼠原代神经细胞经10 μmol·L-1镉离子处理后,细胞活性在4 h 后开始降低,且处理时间越长,细胞活力降低越明显(图1)。本研究推测细胞活力降低的原因主要有二:其一,细胞周期检测结果显示,10 μmol·L-1镉离子处理24 h 或48 h 分别有60.88%或82.94%停留在G0―G1 期,无法进入S 期(图2);其二,细胞程序性坏死检测结果显示,经镉离子处理的细胞,其细胞程序性坏死率可达47.50%(图3),证实镉离子能导致神经细胞损伤,降低细胞活力。
目前,对细胞程序性坏死机制的研究主要集中在肿瘤坏死因子(tumor necrosis factor,TNF)介导的通路[20]。TNF首先与其受体肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)结合,然后招募RIPK1、肿瘤坏死因子受体相关因子2(TNF receptorassociated factor 2,TRAF2)、凋亡抑制蛋白1/2(cellular inhibitor of apoptosis protein-1/2,cIAP1/2)以及线性泛素链组装复合物(linear ubiquitin chain assembly complex,LUBAC)等蛋白形成复合物I,其解聚可进一步形成复合物 II-a、II-b 和 II-c,前两者与细胞凋亡相关,而 II-c又称坏死体,则与细胞程序性坏死有关[21]。细胞程序性坏死的过程依赖激酶RIPK1、RIPK3 以及MLKL 的表达[22]。本研究发现镉离子处理神经元细胞后,细胞出现了大量的碎片化,其细胞程序性坏死率可达47.50%,同时,经镉离子处理后RIPK3以及MLKL转录水平也明显上升(图3B),说明镉暴露确实导致了细胞程序性坏死。此研究为明确镉离子引起神经元细胞程序性坏死提供了较直接的依据。
另外,本研究证明了镉离子引起小鼠原代神经细胞程序性坏死的机制与细胞自噬密切相关。当用镉离子处理小鼠原代神经细胞后,p62 蛋白表达水平明显上升,同时通过荧光观察发现GFP-LC3-B 和mCherry-p62 斑点的数量也明显增多(图4)。p62 以及GFP-LC3-B常被作为自噬流的检测指标,细胞内p62表达上升以及GFP-LC3-B 数量增多,通常提示自噬流受阻。因此,本研究结果说明镉离子诱导的神经细胞程序性坏死与自噬流阻滞有关。
综上,本研究结果表明镉离子可通过诱导小鼠神经细胞自噬流阻滞进而促进细胞程序性坏死。但镉离子经细胞自噬依赖途径诱导细胞死亡过程中的分子机制尚未完全明确,仍需进一步探究。

