系统毒理学研究进展
靳远,刘玉真,戚光帅,于典科
青岛大学公共卫生学院,山东 青岛 266073
毒理学(toxicology)作为一门应用型学科,其发展依赖于医学和生物学技术的整体进步。近年来,随着系统生物学概念的兴起,整合细胞、机体及人群等多组学数据的研究成为毒理学领域新的热点。现在普遍认为,外源化学物进入机体后一方面影响DNA、RNA 和蛋白质等生物大分子的功能及相互作用(水平方向),另一方面依次扰动细胞、组织、器官和个体等多个生命系统的结构层次(垂直方向),进而产生动态的生物学变化[1]。
系统毒理学作为一门新兴学科,应用传统毒理学的研究参数,借助系统生物学研究方法尤其是生物信息学和计算生物学技术,将细胞、机体及人群数据与基因组、蛋白组、代谢组等组学数据有机整合,力图从空间上和时间上系统解析外源化学物和机体的相互作用[2-3]。基于研究内容,系统毒理学的相关进展涉及毒代动力学(toxicokinetics)和毒效动力学(toxicodynamics),前者关注外源化学物在机体内的迁移转化,后者则聚焦于外源化学物对机体的作用与机制;基于研究方法,系统毒理学研究可分为毒理多组学技术及计算毒理学技术。近20年来,暴露组学、基因组学、蛋白组学和代谢组学等多组学技术的飞速发展,为解析化学物的毒作用机制和相关的生物标志物提供了数据基础;而基于化学物结构-活性关系(quantitative structure-activity relationship,QSAR)、分子对接、机器学习和数学建模等计算毒理学手段的进步,则为建立新的危害识别和风险评估方法提供了有力支撑[4]。本文介绍了系统毒理学研究的几个关键概念,并就毒效动力学近年的研究工作进行综述。
1 毒代动力学相关进展
毒代动力学是毒理学的一个分支,主要研究化学物在生物体内吸收、分布、代谢及排泄(absorption,distribution,metabolism,and excretion,ADME)过程,揭示其动态变化规律[5]。毒代动力学关注的核心问题是机体内化学物代谢的时间/剂量关系,主要通过实验或计算机方法建立的动力学模型和可靠的动力学参数来描述暴露过程中机体内化学物的变化情况,为探讨化学物的毒作用机制,实现不同暴露途径、种属以及体外-体内的剂量外推提供信息。
基于生理的毒代动力学模型(physiologically based toxicokinetic,PBTK)概念起源于基于生理的药代动力学模型(physiologically based pharmacokinetic,PBPK),该模型基于生理学、生物化学和解剖学等学科的知识背景,首先利用各器官和ADME 过程的相关参数作公式化描述,进而借助血液与淋巴循环体系,将机体各器官整合成整体模型,以期系统研究化学物在体内的代谢进程[6]。PBPK/PBTK 模型被认为是模拟化学物在人体内ADME 过程最可靠的方法,其构建过程通常包括化学物及机体信息资料的收集、模型结构与血液循环流程图的设计、模型运算以及模型的验证和修订等步骤[7-8]。
1937年,学者首次提出了一个简单的多室PBPK模型,用来研究药物在机体各器官内的分布,模拟药物到达组织的终浓度[9]。计算机的普及和应用极大地加快了复杂PBPK 模型的研究进程,PBPK 模型现已成为研究临床药理和剂量优化的常规手段[10-11]。PBPK模型在毒理学中的应用可追溯到20世纪70年代,陶氏公司研发团队利用PBPK 模型研究杀虫剂、塑料单体等多种外源化学物的体内消除路径。1985年,Clewell和Andersen[12]首次将PBPK 模型用于有害化学物的风险评估,随后越来越多的官方机构陆续将PBPK 模型应用于化学物的风险评估及决策制定[13-14]。如今,PBPK/PBTK 模型广泛应用于混合化学物,生物大分子如单克隆抗体,小分子如纳米颗粒等的毒代动力学研究,该模型在种属间外推中显示出特有优势。例如,全氟辛烷磺酸(perfluorooctane sulfonate,PFOS)是一种广泛存在于环境中的持久性有机污染物,其毒代动力学的物种间差异较大。为解决这一问题,Chou等[15]在2019年分别建立了小鼠、大鼠、猴子和人类静脉注射和口服PFOS 的PBPK 模型,利用贝叶斯分析和蒙特卡罗模拟对模型进行优化,表征化学特性参数的不确定性和物种间差异性,为改进PFOS 的种属间外推和定量风险评估方法作出贡献;2020年,他们基于贝叶斯的剂量-反应评估和PBPK 建模方法,整合PFOS的体外、体内毒理学和流行病学证据,完成该化学物的健康风险评估[16]。
总之,PBPK/PBTK 模型应用于化学物风险评估有以下优势:①通过精确化ADME 过程中的各类参数,降低剂量外推的不确定性;②通过数据整合有效识别毒作用模式,明确有害效应起点;③通过模拟化学物活化产物的内暴露剂量,为构建毒效用模型提供更真实可靠的生理生化基础[17]。
2 毒效动力学相关进展
毒效动力学是毒理学的另一个分支,主要研究毒物进入机体后与靶部位的相互作用中,在分子、细胞、组织、器官、系统直至机体的各个层次所发生的生理功能、生化反应、病理变化等毒作用反应全过程,其关注的核心问题是化学物的毒作用机制、结构-效应关系和剂量-效应关系。近年来,化合物对毒性通路(toxicity pathway)扰动情况、毒作用模式(mode of action,MOA)的研究和有害结局路径(adverse outcome pathway,AOP)的构建是系统毒理学在毒效动力学领域的热点话题。
2.1 毒性通路、MOA框架和AOP框架的发展历程
2007年,美国国家研究委员会(National Research Council,NRC)发表了一项题为《21世纪毒性测试》(Toxicity Testing in the 21st Century,TT21C)的报 告,首次提出“毒性通路”的概念,将其定义为受到充分干扰时可导致有害健康效应的细胞应答通路[18]。更重要的是,该报告指明应基于毒性通路构建未来的毒性评价体系,鼓励基于体外细胞学证据结合计算毒理学手段来取代传统的动物实验。当前毒性通路的研究集中在通路识别和通路预测方面,前者基于人类组织或细胞的组学数据来确立受化学物扰动的信号通路,后者则基于动物模型数据推断人类在相同化学物刺激时的通路扰动情况。相对而言,通路预测的结果判定应更为谨慎,具体解决策略包括寻找动物和人类的同源基因,利用机器学习分析相同暴露时动物和人类通路扰动的相似性等[19-20]。
毒理通路概念主要描绘了细胞水平的关键事件,而机体在暴露于足量的有害化学物或环境刺激后会引发一系列生物过程,对这些生物过程的理解将有助于对化学物的危害进行识别。同时,将作用机制和有害结局相似的化学物聚类,有助于对更多相似化学物的潜在健康风险进行预测。从这个角度来说,对生物系统认识得越深入,对化学物和生物分子相互作用了解得越广泛,我们的毒性预测和风险评估就会越有据可信。基于这一诉求,在过去十几年里,系统性收集、衡量、整合机制信息的多种尝试应运而生,这其中就包括MOA和AOP 框架。
MOA 框架是指以特定化学物和生物分子相互作用作为起始,途径可检测、可定量的一系列关键事件,直到毒性终点[21]。MOA 概念最早由国际生命科学院(International Life Sciences Institute,ILSI)提出[22-23],由国际化学品安全项目(International Program on Chemical Safety,IPCS)进行发展和推广[24-25],现已被美国环保署(US Environment Protection Agency,EPA)等多个官方机构应用于常见化学物的毒性评价和暴露限值评估[26-28]。MOA 的构建通常需要遵循以下原则:①一个MOA 不必反映该化合物的完整毒性机制信息,但应聚焦于最可能发生的作用模式;②应尽可能地整合早期关键事件;③关键事件必须是发展为毒性结局的关键步骤,必须可测量,进而实现关键事件间因果关系的建立;④关注量化,关注人类相关性,以实现MOA在健康风险评估中的应用。近些年,科学家们在协力同步化AOP 和MOA 的框架构建;对化学物MOA 的良好理解无疑能为链接不同生物学层面效应,构建AOP框架提供有力支持。
在NRC 指南的指导之下,2010年,美国EPA 毒理学专家Ankley 等[29]首次提出AOP 的概念,用于描述化学物暴露或环境刺激后在细胞或组织发生的关键事件的证据链条,最终连接至毒效应终点[30]。与MOA 框架不同的是,AOP 框架是一个跨化学物,跨实验对象(物种)的概念,即不同的化学物质如果在细胞和组织中引发同样的关键事件,则判断这些物质可引发相同的毒效应终点。因此,AOP 概念的提出为建立高通量的毒性评价体系及解析新型化学物的毒作用机制提供了理想的工具。同年,经济合作与发展组织(Organization for Economic Coordination and Development,OECD)召开专家组会议,针对如何将化学物依照毒作用机制进行聚类和如何识别关键事件等问题进行讨论[31],最终制定了AOP 框架构建指南和应用手册,对AOP 的定义、构建和应用进行了规范化描述[32-33]。根据指南,一个标准的AOP应包含三类元素(图1):分子起始事件(molecular initiating event,MIE)、有害结局(adverse outcome,AO),以及连接MIE和AO的多个关键事件(key events,KE)。自2014年以来,OECD开发了一系列工具,统称为AOP知识库(AOP knowledge base,AOP-KB),为AOP 的建立和发展提供了标准化的系统构架[34]。AOP-wiki (https://aopwiki.org/)是AOP-KB旗下一个工具型网站,整合了通过专家评议的AOP。截至2021年初,AOP-wiki 共纳入300多个处于不同建设阶段的AOP,包含近1 400 个关键事件和1 800多个关键事件关系(key event relationships,KERs)。
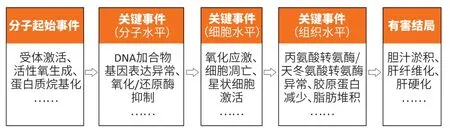
图1 与肝损伤相关的AOP框架示意图Figure 1 Schematic diagram of AOP leading to liver injury
2.2 AOP网络与多组学技术
目前,AOP 框架已在化学物的毒作用机制解析和毒性测试中显示出巨大潜力。比如,AOP 对于分子起始事件的定义与验证,可以为化学物的结构活性关系分析提供实验证据[35];鉴定化学物在细胞和组织内的关键事件有助于判断体外毒性实验的效应终点,为毒性通路识别和机制解析提供科学依据[36]。早期的AOP 框架构建多采用专家共识或文献综述,重点关注细胞和组织中易检测、可定量的关键事件,形成线性AOP 证据链条。一方面越来越多的证据显示不同AOP框架可能共有某些关键事件;另一方面,线性AOP 也难以描述化学物毒作用的生物学真相。因此,以关键事件或毒性通路为骨架,运用计算毒理学或生物信息学分析方法构建AOP 网络,可能是解决化学物毒效应的生物复杂性问题的有效手段。
2015年,Knapen 等[37]整合AOP-wiki 上与鱼类生殖发育毒性相关的AOP信息,基于五个AOP框架(#21、23、25、29 和30),开创性地提出AOP 网络概念。该研究发现,颗粒细胞的关键事件“雌二醇合成下降”可链接到两个分子起始事件,干细胞中的“卵黄生成素合成下降”可链接到三个分子起始事件,而膜细胞中的关键事件“睾丸素水平下降”仅与分子起始事件“雄激素受体活化”相连,然而这三个关键事件均指向有害结局“雌性生育力下降”。在该研究的基础上,Knapen 等[38]于2018年对AOP 网络的构建方法进行系统性论述,提出基于利用AOP-wiki 数据库的AOP 信息,运用数据挖掘和网络推导来构建AOP 网络的研究思路,将“拓扑”概念引入AOP 网络结构,并强调AOP 网络的简化过滤和可视化处理的重要性。同年,Villeneuve 等[39]进一步对AOP 网络的结构解析进行详细阐述,介绍了“问题公式化”“证据权重法”“基于生物或毒理学法”和“经验识别法”等识别AOP 网络关键路径的方法,并分析了网络模型中各线性AOP 间的交互作用类型。可以预见,AOP 网络的构建方法和模块分析将随着计算毒理学和生物信息学的发展而日益完善。
以基因组学、转录组学、蛋白组学和代谢组学为代表的组学技术在毒理学中应用已有十几年历史,多组学数据的整合可带来深层次的生物学见解,更全面地解析毒作用机制。此外,多组学数据也能提高化学物剂量外推的可信度,有助于化学物的识别、分类、表征和筛选,且在鉴定化学物相关的暴露、效应和易感标志物方面起重要作用。如何将组学数据应用于化学物毒性测试和风险评估因争议不断而进展缓慢,但多组学数据的整合无疑会对AOP 网络的构建提供扎实的数据基础。2014年9月,第二届国际环境组学研讨会初步商讨了将组学数据集纳入人类和生态健康风险评估的AOP 框架的可行性[40]。Davidsen 等[41]在2016年将计算生物学方法应用于AOP 框架的构建过程,提出了生物标志物发现、网络推理和计算建模三种计算类型,其中基因、蛋白质和代谢生物标志物可通过单变量或多变量分析作为关键事件纳入AOP 框架。此外,Antczak 等[42]通过分析组学数据集确定钙信号毒性通路在麻醉毒性AOP 框架的关键作用。这些证据表明多组学数据在AOP 框架的构建与完善方面均可发挥关键作用。
目前,有多个权威毒理学数据库对毒物的化学信息和组学数据进行储存和管理,如美国EPA的CompTox Chemicals Dashboard(https://comptox.epa.gov/dashboard)收录了超过88 万种化合物的结构、活性与毒性信息,而比较毒理基因组数据库(Comparative Toxicogenomics Database,CTD;https://ctdbase.org)通过对已发表研究论文的筛查,揭示了上千万的“化学物-基因-疾病”交互作用信息。将组学数据纳入AOP框架和网络面临的首要问题是如何从上述海量数据中鉴定可作为关键事件的分子变化或毒性通路改变。在2018年第二届国际环境组学研讨会上,专家们提出应用分层方法来降低组学数据的维度,将其应用于AOP构建[40]。2020年,南京大学张效伟教授应用转录组学分析联合体外生物测定的方法尝试进行化学物联合暴露的生态和人类健康的效应评估。该研究通过多个剂量的转录组数据描绘了化学物进行生物扰动的剂量-效应关系,判断相关的关键事件和毒性通路,并通过体外生物测定对相关事件和通路进行验证,成功建立基于AOP的风险评估模型[43]。2020年,青岛大学于典科团队以芳香烃受体激活为分子起始事件,整合CTD 和创新通路分析知识库(Ingenuity Pathway Analysis knowledgebase,IPA knowledgebase)等毒理学权威数据库中毒物-基因、基因-基因和基因-疾病交互作用关系,明确芳香烃受体经典配体在肝脏和肺脏中扰动的关键毒性通路,通过调控力分析(upstream regulators analysis,URA)界定毒性通路的应答顺序,最后基于毒性通路启动的先后顺序和各通路应答基因间的上下游调控关系,成功绘制芳香烃受体激活直至肝脏损伤和肺脏损伤的两个AOP 网络,为基于毒性通路构建AOP 网络提供新的思路和研究策略[44]。
2.3 AOP具体应用
近年来,OECD 推行集成方法用于毒性测试和评估(integrated approaches to testing and assessment,IATA),即策略性地整合和衡量相关数据,用于进行危害/风险识别和测试选择相关的决策制定,最终实现测试项目的优化和数量的精减。AOP 框架的发展无疑为IATA的推行提供了有力支持:它能对有害结局进行机制解析,对某一关键事件提供具有证据权重的评估,对化学品进行毒性归类和交叉参照(read-across)等。具体来说,AOP 框架支持的IATA 应用包括:为OECD的官方软件—定量构效关系工具箱(quantitative structure-activity relationship toolbox,QSAR toolbox)提供基础数据[45],为欧洲化学品相关法规提供测试流程[46],为美国EPA 内分泌干扰物相关项目的化合物筛选提供决策基础[47];为欧洲2013年以来化妆品无动物测试的全面推行提供毒效终点信息[48-49]等。总之,AOP在化学品评估方面的应用正受到广泛关注,以通路为导向的机制信息集成平台和应用软件处于大力发展中,基于AOP框架的系统毒理学将与替代毒理学相互支持,为人类与环境健康相关决策提供有力证据。
3 展望
系统毒理学是后基因组时代的新兴学科,研究范围涉及从分子、通路直到整体效应之有害结局等多个层面,如何明确各层次间的因果关系一直是该领域的核心科学问题,AOP 概念的出现为解决该问题提供了新的思路,但也面临着挑战。
定量AOP 是目前该领域的研究挑战之一,也被视为将AOP 概念应用于毒性测试与风险评估的关键。定量AOP 与其他以生物学为基础的模型(包括剂量-反应模型、毒代动力学模型和种群模型)具有相同的属性,即模型相关的生物学描述越准确,该模型预测的精确性就越高。另外,定量AOP 模型中,毒物的剂量与AOP 中所定义的所有关键事件密切相关,需对每个关键事件进行量化分析,并将其转化为上、下游关键事件的效应-效应关系[50]。目前,针对定量AOP 的有限研究发现基于概率的贝叶斯模型和基于机制的回归模型可能是进行AOP 定量分析的有效方法[51]。表观遗传因素(如DNA 甲基化、组蛋白修饰和非编码RNA)可调控毒物代谢酶,进而影响毒物代谢和毒效应的个体差异,部分表观遗传分子性状稳定,是良好的候选生物标志物。目前认为表观遗传因素可作为关键事件纳入MOA 或AOP 框架,但现有的零星报道仅涉及个别应答基因或表观遗传分子,缺乏对表观遗传因素和毒性通路的系统整合。
综上,与传统毒理学相比,系统毒理学在毒作用机制解析和化学物毒性测试与风险评估方面具有的独特优势,包括:可对生物体产生损伤的整个过程进行检测与分析;关注生物作用网络中关键分子、细胞、功能事件的因果链,进而对毒作用的生物学机制进行系统描述;通过高通量技术筛选与毒性测试和风险评估相关的生物标志物,描述从暴露到不良效应和疾病结局的系统扰动过程,从而使剂量-反应关系和剂量外推结果更加可靠。然而,如何将这种理想的优势转变为现实,则需要毒理学和系统生物学领域科学家的不懈努力与密切合作。

