肠道菌群失调对甲基汞染毒小鼠组织汞及粪汞含量的影响
黄红茜,李凤敏,张爱华,b,韩雪
贵州医科大学 a.公共卫生学院 b.环境污染与疾病监控教育部重点实验室,贵州 贵阳 550025
甲基汞是汞的甲基化产物,是一种具有神经毒性的环境污染物。环境中任何形式的汞(金属汞、无机汞等)均可在一定条件下转化为甲基汞,并在动植物体内蓄积[1],摄入含甲基汞的食物是普通人群甲基汞暴露的主要途径[2-3]。甲基汞主要经由肠道吸收,约超过90%的甲基汞经肠道吸收后分布于全身各处[4]。
人体肠道中存在600多种、约1013~1014个微生物,从辅助消化食物、提供特定营养物质,到占据消化道表层、抵御病原体入侵,再到参与对免疫系统的训练等,肠道菌群在调节和维持正常的身体机能方面有着不可或缺的作用[5-6]。已有研究证实,肠道菌群是调节外源化学物(如药物、重金属等)生物利用度和毒性的重要因子[7-8]。
甲基汞主要经口暴露,在人体内需经过广泛的肝肠循环过程,其半衰期约为70 d,因此甲基汞与肠道菌群之间有着“亲密而持久”的接触,但肠道微生物在甲基汞转运转化中的具体作用及机制尚未明晰。本研究通过构建抗生素诱导的肠道菌群紊乱动物模型,探讨肠道微生物在甲基汞吸收、分布、排泄中的作用,为甲基汞中毒的防治研究提供思路和资料。
1 对象与方法
1.1 主要试剂与仪器
主要试剂:万古霉素、硫酸新霉素、甲硝唑、氨苄青霉素(上海源叶,中国),粪便DNA 提取试剂盒(QIAGEN,德国),TRIzol 试剂(Invitrogen,美国),甲基氯化汞(Sigma,美国),荧光标记的右旋糖酐(Sigma,美国)。
主要仪器:3020-426 多功能全波长酶标仪(Thermo,美国),实时荧光定量PCR 仪(Eppendorf,美国),PHSJ-4F 精密pH 计(上海精科仪器厂,中国),AFS-8520 原子荧光光度计(北京海光仪器有限公司,中国),高压密闭消解罐 (东台市中凯亚科技有限公司,中国)。
1.2 实验动物和暴露方法
1.2.1 实验动物及分组20 只7 周龄SPF 级健康雌性BALB/c 小鼠购自辽宁长生生物技术股份有限公司[合格证号:SCXK(辽)2015-0001],饲养于贵州医科大学医学实验动物中心,12 h 亮/暗循环,自由摄水摄食,适应性饲养一周后将小鼠随机分为4 组(每组5 只):空白组、菌群失调组(单独抗生素干预组)、甲基汞组、菌群失调+甲基汞组。本动物实验遵循贵州医科大学实验动物伦理委员会规定(编号:No.1900249)。
1.2.2 肠道菌群紊乱模型构建及甲基汞染毒方案参照文献[9-10],使用四联抗生素构建肠道菌群紊乱模型,四联抗生素混合液含万古霉素100 mg·kg-1(以体重计,后同)、硫酸新霉素200 mg·kg-1、甲硝唑200 mg·kg-1、氨苄青霉素200 mg·kg-1。BALB/c 小鼠经四联抗生素混合液处理4 d,1 次·d-1,灌胃量10 mL·kg-1。抗生素给药完毕后无菌收集小鼠粪便,提取粪便微生物DNA,通过PCR 验证细菌16S rRNA 的V4 区基因水平[11],设空白管为阴性对照。根据细菌16S rRNA 的V4 区基因水平判断建模是否成功,抗生素干扰后小鼠粪便DNA无法扩增出信号,则可表明大多数肠道细菌已被清除,菌群紊乱模型建立成功,造模成功后给予甲基汞染毒3 d(0.5 mg·kg-1,1 次·d-1,灌胃量10 mL·kg-1)。
1.3 主要实验指标
1.3.1 体重与脏器系数称量并记录小鼠染毒前及终末期体重。终末取血结束后,颈椎脱臼处死小鼠并立即进行解剖,称量小鼠肝脏、肾脏、脑及整段盲肠,计算脏器系数。脏器系数=脏器湿重(mg)/总体重(g)。
1.3.2 汞含量检测甲基汞组和菌群失调+甲基汞组进行甲基汞染毒3 d,每天固定时间点灌胃。第一次甲基汞染毒后24、48、72 h 收集各组粪便,检测粪便总汞含量;染毒结束采用5%水合氯醛麻醉小鼠,眼球取血,处死小鼠后收集肝脏、肾脏、脑、盲肠及结肠内容物样本,液氮瓶中速冻,-80℃冰箱冷冻保存。参考GB 5009.17―2014《食品安全国家标准 食品中总汞及有机汞的测定》中总汞的测定方法,采用压力罐消解对样本进行预处理,原子荧光光谱分析法检测粪便、血液、肝脏、肾脏及脑组织中总汞含量。方法检出限为0.003 mg·kg-1,加标回收率为83%~117%。
1.3.3 盲肠、结肠内容物pH 的检测实验结束,处死小鼠后收集小鼠盲肠及结肠内容物,称取盲肠内容物60 mg,按1 mg 盲肠内容物添加7 μL 预冷的去离子水配置混合液,利用组织研磨仪匀浆(45 Hz,150 s),在4°C、3 500×g的条件下离心10 min,取上清于新的EP管中,重复提取一次,将两次提取液合并后用pH计检测pH值。
1.3.4 肠组织病理形态学观察体积分数4%的多聚甲醛固定回肠组织,常规脱水,石蜡包埋,组织切片,进行苏木精-伊红染色(hematoxylin and eosin staining,HE染色),光学显微镜下观察肠组织病理学变化。
1.3.5 肠道紧密连接蛋白mRNA 水平检测提取肠组织RNA鉴定其纯度及完整性,反转录合成cDNA,反转录PCR(reverse transcription PCR,RT-PCR)检测肠道紧密连接蛋白Zo-1、Claudin-1、Occludin基因mRNA 的水平。引物序列见表1。

表1 肠道紧密连接蛋白基因RT-PCR反应引物Table 1 Primers for RT-PCR of intestinal tight junction protein genes
1.4 统计学分析
采用SPSS 20.0统计软件进行数据统计分析。各组数据以均数±标准差表示,组间比较采用方差分析,两两比较采用LSD或Games-Howell检验法。总汞含量比较用独立样本t检验进行统计分析,检验水准α=0.05。
2 结果
2.1 肠道菌群失调模型造模结果
空白组和甲基汞组都未给予抗生素处理,默认空白组和甲基汞组肠道菌群的状态一致,因此,选择空白组为对照。如图1,空白组小鼠粪便微生物DNA 含量为(51.07±31.65)μg·g-1,抗生素处理小鼠粪便未检测到明显DNA 含量。紫外光下细菌16S rRNA 通用引物PCR 扩增产物电泳结果显示,空白组小鼠具有良好的16S rRNA基因信号,抗生素处理的小鼠未检测到明显信号,表明抗生素处理清除了小鼠肠道内的细菌,即肠道菌群失调建模成功。
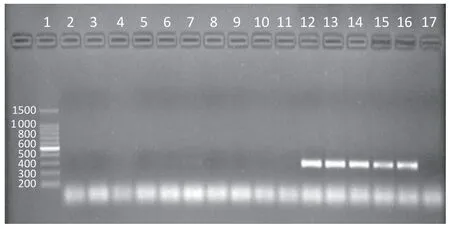
图1 小鼠16s rRNA V4通用引物PCR产物凝胶电泳图Figure1 The gel electrophoresis diagram of the PCR product of 16s rRNA V4 of mice using universal primers
2.2 脏器系数
各组小鼠肝脏、盲肠脏器系数的差异具有统计学意义(F肝=9.901,P=0.001;F盲肠=14.529,P<0.001),脑及肾脏脏器系数差异无统计学意义。与空白组相比,菌群失调组肝脏脏器系数下降(P<0.05),盲肠脏器系数升高(P<0.05);与甲基汞组相比,菌群失调+甲基汞组肝脏脏器系数下降(P<0.05),盲肠脏器系数升高(P<0.05)。见表2。
表2 小鼠脑、肝、肾、盲肠的脏器系数(mg·g-1,±s,n=5)Table 2 Organ coefficients of brain,liver,kidney,and cecum of mice(mg·g-1,±s,n=5)
[注]a:与空白组比较,P<0.05;b:与甲基汞组比较,P<0.05。
盲肠脏器系数空白组 21.64±0.83 44.15±2.85 11.28±0.98 16.03±5.57甲基汞组 22.35±0.26 45.62±3.09 11.28±0.80 15.04±4.45菌群失调组 22.90±0.25 39.29±0.95a 11.12±0.86 33.31±8.21a菌群失调+甲基汞组 23.25±2.77 39.09±2.03b 11.67±0.54 32.78±4.76b分组 脑脏器系数肝脏脏器系数肾脏脏器系数
2.3 血及粪便总汞含量
随着甲基汞的暴露时间延长,小鼠粪汞的排泄量增加。第一次甲基汞暴露后24、48、72 h,甲基汞组的粪汞含量分别为(259.87±90.94)、(616.83±197.90)、(1 322.50±377.77)ng·g-1;菌群失调+甲基汞组分别为(90.39±27.56)、(366.75±81.82)、(641.33±354.24)ng·g-1。与甲基汞组相比,菌群失调+甲基汞组小鼠粪便总汞含量降低(t24h=3.650,P=0.011;t48h=2.828,P=0.022;t72h=3.015,P=0.024)。菌群失调+甲基汞组与甲基汞组血汞含量分别为(40 290.00±5 515.11)、(28 392.00±5 813.25)ng·g-1,血汞含量升高(t=-2.623,P=0.031);空白组及菌群失调组总汞含量差异无统计学意义,详见图2。

图2 甲基汞暴露期间小鼠粪便总汞(A)和血液总汞(B)含量(n=5)Figure 2 Total mercury level in feces (A) and blood (B) of mice during methylmercury exposure (n=5)
2.4 肝、肾、脑总汞含量
甲基汞组肝、肾、脑总汞含量分别为(2752.86±566.09)、(4 502.08±105.76)、(827.54±106.50)ng·g-1,菌群失调+甲基汞组分别为(4 090.38±929.44)、(8 539.97±1 242.64)、(1 348.24±336.69)ng·g-1。与甲基汞组相比,菌群失调+甲基汞组小鼠肝、肾、脑总汞含量均升高(t肝=-2.748,P=0.025;t肾=-6.476,P=0.001;t脑=-3.297,P=0.011)。空白组及菌群失调组总汞含量差异无统计学意义。
2.5 盲肠及结肠内容物pH
各组小鼠盲肠及结肠内容物pH 值差异有统计学意义(F盲肠=11.295,P<0.001,F结肠=54.081,P<0.001)。与空白组相比,菌群失调组盲肠及结肠内容物pH值升高(均P<0.05);与甲基汞组相比,菌群失调+甲基汞组盲肠及结肠内容物pH值升高(均P<0.05)。见表3。
表3 小鼠盲肠及结肠内容物pH值(±s,n=5)Table 3 pH values of cecum and colon of mice (±s,n=5)
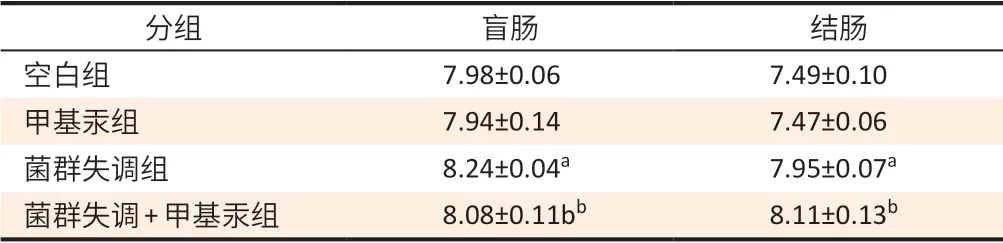
表3 小鼠盲肠及结肠内容物pH值(±s,n=5)Table 3 pH values of cecum and colon of mice (±s,n=5)
[注]a:与空白组比较,P<0.05;b:与甲基汞组比较,P<0.05。
分组 盲肠 结肠空白组 7.98±0.06 7.49±0.10甲基汞组 7.94±0.14 7.47±0.06菌群失调组 8.24±0.04a 7.95±0.07a菌群失调+甲基汞组 8.08±0.11bb 8.11±0.13b
2.6 肠组织病理形态学观察
如图3所示,空白组回肠组织结构完整,肠绒毛较长且较为整齐,肠绒毛被覆单层柱状上皮,黏膜下层、肌层和外膜连接紧密,未见明显病理变化;菌群失调组肠绒毛坏死溶解,上皮细胞脱落,固有层轻微水肿等改变。
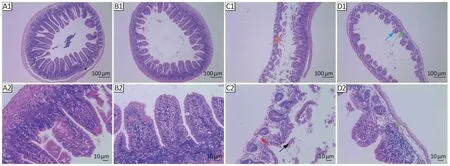
图3 各组小鼠肠组织病理学变化(HE染色)Figure 3 Pathological changes of intestine of mice in each group (HE staining)
2.7 肠道紧密连接蛋白mRNA的表达
各组小鼠肠组织肠道紧密连接蛋白mRNA表达水平差异有统计学意义(FOccludin=8.855,P=0.006;FZo-1=7.748,P=0.009;FClaudin-1=13.753,P=0.002)。与空白组相比,菌群失调组肠组织Occludin、Zo-1、Claudin-1mRNA 表达水平下降(均P<0.05);与甲基汞组相比,菌群失调+甲基汞组肠组织Occludin、Zo-1、Claudin-1mRNA表达水平下降(均P<0.05)。见图4。

图4 小鼠Claudin-1(A)、Occludin(B)和Zo-1(C) mRNA表达水平Figure 4 The expression levels of Claudin-1 (A),Occludin (B),and Zo-1 (C) mRNA of mice
3 讨论
作为接触外源化学物的第一批“细胞”,肠道某些益生菌可与外源化学物螯合使其随着菌株通过粪便排泄,或将外源化学物进行代谢转化,改变其溶解性进而将其清除。甲基汞向无机汞的生物转化被认为是甲基汞消除的必要中间步骤,来自甲基汞的“汞”转化为不易吸收的无机汞后主要经粪便排泄。Caito等[12]观察到人类在服用抗生素后,体内甲基汞的消除速度明显降低。Bisanz 等[13]则发现与对照组相比,每天食用益生菌(即酸奶)的坦桑尼亚孕妇血汞浓度显著降低。Jadán-Piedra 等[10]的研究也发现益生菌即嗜酸乳杆菌BL17 和干酪乳杆菌BL23 可促进甲基汞暴露小鼠粪汞的排出,减少体内汞水平。与以往研究相似,在本研究中,相对于正常小鼠,菌群紊乱小鼠体内血、肝、肾、脑组织的汞含量升高,而排出的粪汞含量降低,提示肠道菌群可能是甲基汞代谢和汞循环的重要参与者。
肠黏膜屏障由肠道上皮细胞连接复合体及其分泌物、肠相关免疫细胞及肠内正常菌群组成,主要包括生物屏障、化学屏障、机械屏障和免疫屏障。肠黏膜屏障作为控制有毒化学物进入机体的第一道防线,能限制肠腔内有害物质如毒素或细菌穿过肠黏膜进入血液循环和体内其他组织器官,其完整性依赖于微生物与宿主的相互作用。肠道微生物可通过影响肠道上皮通透性和紧密连接,调控肠道上皮细胞凋亡等多种作用影响肠道机械屏障。体外研究结果显示,肠道菌群可通过改善肠道机械屏障功能阻止肠上皮细胞对粪便中浓缩甲基汞的再吸收[14]。紧密连接蛋白Zo-1、Occludin表达量及分布的变化可以代表肠屏障功能的变化[15]。本研究发现相对于空白组,菌群紊乱小鼠的肠道出现了肠绒毛坏死溶解、上皮细胞脱落等病理改变;同时,菌群紊乱小鼠的紧密连接蛋白Claudin-1、Occludin、Zo-1mRNA表达水平下降,提示肠黏膜机械屏障可能受损,通过增加肠道通透性可使甲基汞更易通过肠屏障或直接从肠细胞间渗漏,增加甲基汞的吸收。
肠道微生物除构成肠道的生物屏障外,还可通过促进黏液的分泌和产生特殊代谢产物影响肠内环境的稳态,调节肠道化学屏障[16]。肠道菌群产生的水解酶催化底物生成的有机酸及短链脂肪酸可降低肠腔pH 值,而肠道pH 值则可影响金属离子的溶解性和细胞表面基团的电离状态,进而干扰其转运。本研究发现菌群紊乱小鼠盲肠及结肠内容物pH值高于空白组,提示肠道菌群通过参与维持肠道内环境的稳态影响甲基汞的吸收。
盲肠是汞吸收的主要部位之一,本研究发现菌群紊乱小鼠盲肠的重量大约是空白组的两倍。已有研究发现,无菌鼠的盲肠比普通鼠大5~7 倍[17],因此推测盲肠的重量及体积受到肠道微生物的影响。盲肠内容物的增多、变稀可使小鼠肠动力下降[18],使肠内容物在盲肠内的停留时间延长,从而增加小鼠体内甲基汞的吸收,这也是本研究观察到血汞及组织汞浓度增加的可能原因之一。
本研究结果表明,肠道菌群直接参与或间接影响着甲基汞的吸收、分布与排泄,肠道菌群紊乱可促进甲基汞的吸收,减少其排泄,增加其在组织中的分布。肠道菌群是一个复杂而庞大的系统,不同的菌群在物质转运转化中扮演着不同的角色,因此,肠道菌群在甲基汞体内动力学过程中的具体作用机制还需要进一步的研究与探索。

