锌离子在PM2.5致小鼠肺部炎症中的作用
李娟,贺玲,王春枝,马艳美,张竞方,安珍,姜静,吴卫东
1.新乡医学院公共卫生学院,河南 新乡 453003
2.陆军第八十三集团军医院眼耳鼻喉科,河南 新乡 453003
近年来,伴随经济的高速发展,大气污染已经成为全球范围内影响生态环境和人群健康的主要因素。细颗粒物(fine particulate matter,PM2.5)是大气污染物的主要成分之一,也是近年来我国雾霾污染的首要成因,可以对人体造成潜在的健康危害[1]。虽然近几年来我国各地区大气中PM2.5的浓度较前期有所下降,但是其浓度仍然较高。大量的研究证实PM2.5可以损害机体多种组织器官,尤以呼吸系统最为严重[2-4]。北京地区2004―2009年间,PM2.5质量浓度(后简称:浓度)每升高10 μg·m-3,呼吸系统疾病的发病率和死亡率分别升高4.60%(95%CI:3.84%~4.60%) 和4.48%(95%CI:3.53%~5.41%)[5]。我国的PM2.5污染与工业生产、城市化进程和汽车保有量等社会经济发展各类因素有关,我国大多数城市居民在较长时期内可能仍然会生活在PM2.5等大气污染物超标的环境中。
我国大气中PM2.5的来源及形成原因复杂且其毒性组分和致病机制尚不清楚,因此在研究方面不能完全照搬国外的研究模式和结果解析,要结合我国的大气污染物的特点来开展对其组分的毒理学和健康危害研究。流行病学及毒理学研究结果均显示,PM2.5的毒性效应除与其浓度有关外,还与其组分密切相关[6-7]。
大量PM2.5成分分析发现,PM2.5重金属含量较高,而锌离子(Zn2+)是大气颗粒物的主要水溶性金属成分[8]。已有研究表明,给予实验动物吸入或灌注外源性锌离子可以诱发其急性呼吸道炎症损伤[9]。课题组前期发现锌含量较高的大气PM10和外源性锌离子溶液对人呼吸道上皮细胞和动物肺脏具有急性炎性作用[10],并且外源性锌离子可能引起环境氧化性肺损伤[11]。本研究拟构建PM2.5暴露的小鼠动物模型,进一步探讨PM2.5及锌离子是否引起机体肺脏炎性损伤。
1 对象与方法
1.1 材料
1.1.1 实验动物采用6~8周龄雄性BALB/c小鼠(北京维通利华实验动物技术有限公司),共计24 只。全部实验动物饲养于新乡医学院公共卫生学院IVC 动物房并适应性饲养一周(19~22℃,湿度40%~70%)。本实验已通过新乡医学院实验动物福利和伦理委员会审查(无编号)。
1.1.2 主要仪器与试剂大流量粉尘采样器(T-6070C,Tisch Environmental,美国),真空冷冻干燥机(2-4LD Plus,Christ,德国),光学显微镜(Motic AE2000,麦克奥迪实业有限公司,中国),酶标仪(Enspire,PerkinElmer,美国),超声清洗仪(KQ-500E,昆山市超声仪器有限公司,中国),流式细胞仪(Accuri C6,BD,美国),ZnSO4(Sigma,美国),BCA蛋白测定试剂盒(北京鼎国昌盛生物技术有限责任公司,中国),白介素(interleukin,IL)-1β 检测试剂盒(深圳达科为生物技术股份有限公司,中国)。
1.2 实验方法
1.2.1 PM2.5 收集、分析和悬液的制备本研究采集地点位于新乡医学院科技楼顶部(距离地面30 m),采样点周边无明显遮挡物及污染源。使用大流量采样器将PM2.5收集在玻璃纤维滤膜上。采样时间:2015年11月―2016年3月(雨雪天和大风天除外),每次连续采样24 h,采样流量100 L·min-1。采样结束后用锡箔纸包裹采样膜保存。实验前将玻璃纤维滤膜裁剪至2 cm×4 cm 的长条状,随后转移至烧杯后加入50 mL超纯水,使用超声清洗仪震荡3 次,每次20 min。使用8 层纱布过滤颗粒物混悬液后将其转移至培养皿置于真空冷冻干燥机中冻干、干燥。将获取的颗粒物于-20℃冰箱内避光保存。实验使用前用磷酸盐缓冲液配成PM2.5悬液备用。取部分PM2.5悬液于4℃和14 000×g速度离心30 min,收集上清液。采用ICP-MS对PM2.5水溶性金属成分进行分析。
1.2.2 PM2.5和锌离子染毒剂量选择本研究采用气管滴注法对小鼠进行染毒,具体染毒浓度通过以下方式来确定:①重度雾霾天气情况下,新乡市PM2.5浓度可达500 μg·m-3;②成年小鼠的呼吸速率为53 mL·min-1。根据计算可知,成年小鼠的每日呼吸量为0.076 m3,每只小鼠每天吸入PM2.5的量约为0.038 mg。每2 天每只BALB/c 小鼠的PM2.5染毒量为4 mg·kg-1(以体重计,后同)。因此,本次染毒时间设定为1 周,PM2.5染毒量为4 mg·kg-1,隔日染毒,共计3次。同时,检测细颗粒物中锌离子浓度,并用外源性锌离子浓液进行染毒,低浓度ZnSO4组锌离子浓度(30 μg·kg-1)与PM2.5样品中锌离子相同,高浓度ZnSO4组锌离子浓度(60 μg·kg-1)是PM2.5样品中锌离子的2倍。
1.2.3 实验动物分组和染毒实验动物适应性喂养1 周后,将24 只雄鼠随机分为对照组(PBS)、PM2.5组(4 mg·kg-1)、低浓度ZnSO4组(30 μg·kg-1)和高浓度ZnSO4组(60 μg·kg-1),每组6 只。采用气管滴注法对实验动物进行PM2.5和外源性Zn2+染毒。使用乙醚将实验动物麻醉后,用自制的小鼠固定仪器固定小鼠并暴露口腔,用线挂住上切牙后,迅速用镊子夹住小鼠舌部并拉出口腔,将PM2.5悬液缓慢注入小鼠咽部,然后迅速捏紧小鼠鼻腔,迫使小鼠经口呼吸,使液体吸入肺内,当听到肺部湿 音后即染毒成功。全部染毒结束后,按常规正常饲养实验小鼠。对照组、低浓度ZnSO4组和高浓度ZnSO4组采用相同方式进行染毒。
1.2.4 肺脏组织病理学检测末次染毒次日处死小鼠,取右肺于4%多聚甲醛固定,石蜡包埋后切片(厚度为5 μm),采用HE染色,光镜下观察肺脏的组织结构和形态学改变。参照以往方法对肺组织进行炎症评分和计算肺泡平均截距(mean linear intercept,Lm)[12-13]。选取3~4 个中型支气管和肺泡,观察支气管周围炎症程度,分为0~3 级。0 级:无炎症反应;1 级:轻度炎症伴支气管或肺泡间隔炎性细胞灶,伴轻度支气管上皮损伤;2 级:中度炎症伴斑片状或局部炎症,支气管壁、肺泡间隔或支气管上皮损伤,不到1/3的支气管上皮横断面受累;3 级:重度炎症,即支气管壁和肺泡间隔弥漫性炎症细胞,支气管上皮损伤,1/3~2/3 的支气管上皮受累。光学显微镜下(放大倍数200)随机选取10个视野计算Lm,用Image-Pro Plus 6.0软件对Lm进行定量。
1.2.5 肺泡灌洗液(bronchoalveolar lavage fluids,BALFs)细胞数分析处死小鼠后,迅速结扎小鼠右肺,对左肺行肺泡灌洗术。每只小鼠灌肺3 次,每次0.5 mL,共计1.5 mL,灌洗液回收率为80%。收集好的灌洗液于4℃,500×g离心20 min,分别收集上清液和下层细胞,并用流式细胞术检测肺泡灌洗液中的细胞数目。
1.2.6 BCA 蛋白测定试剂盒检测总蛋白水平用BCA蛋白测定试剂盒测定反映肺损伤情况。
1.2.7 乳酸脱氢酶(lactic acid dehydrogenase,LDH)的检测用LDH 检测试剂盒测定BALFs 中LDH 含量。
1.2.8 炎症细胞因子测定采用ELISA 法检测支气管肺泡灌洗液中IL-1β 水平,以反映肺部炎性损伤情况。
1.3 统计学分析
统计学分析采用SPSS 21.0 软件。结果以均数±标准差表示;方差分析用于多组间均数的比较,组间比较采用LSD 检验。检验水准为α=0.05。
2 结果
2.1 大气PM2.5中金属成分分析
如图1A 所示,光学显微镜下观察到染毒悬液中PM2.5分散,未出现明显聚集现象。本研究检测了PM2.5中水溶性金属元素和阴离子的质量分数(如表1),包括11 种金属元素(Ca、Mg、Zn、Mn、Al、Cu、Ni、Cr、Pb、Cd、Se)和8 种阴离子(F-、Ac-、Br-、Cl-、NO3-、HPO42-、SO42-、NO2-)。
其中PM2.5可溶性金属元素中Ca、Al 和Zn 含量最多,其质量分数分别为(21.83±0.15)、(4.55±0.25)、(4.38±0.06)μg·mg-1。
2.2 小鼠肺脏病理形态的变化
图1B 显示,实验动物吸入PM2.5后,其主要分布在肺泡区域,并被巨噬细胞吞噬。如图2所示,对照组中小鼠暴露于PBS 后,其肺组织结构未发现明显的病理变化;而PM2.5暴露组中小鼠肺脏显示炎性损伤,包括炎性细胞(巨噬细胞和中性粒细胞)浸润至呼吸道周围,低浓度ZnSO4组和高浓度ZnSO4组也同样观察到明显的炎细胞浸润现象及肺脏正常生理结构破坏,高浓度ZnSO4组上述病理改变更为明显。炎症评分和Lm结果如图3所示,与对照组相比[(0.40±0.22)分],PM2.5组[(1.64±0.31)分]、低浓度ZnSO4组和高浓度ZnSO4组[(1.30±0.34)、(1.90±0.20)分]炎症评分明显升高(P<0.05),且高浓度ZnSO4组得分高于低浓度ZnSO4组(P<0.05)(图3A)。与对照组[(51.40±4.72)μm]相比,PM2.5组[(61.00±1.41)μm]、低浓度ZnSO4组和 高浓度ZnSO4组[(62.40±2.41)、(65.00±2.55)μm]BALF 中Lm 距离变宽(P<0.05),但染毒各组间没有差异(图3B)。
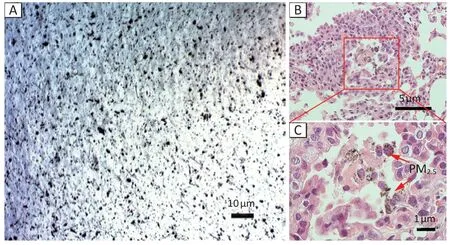
图1 PM2.5在小鼠肺脏蓄积Figure 1 Accumulation of PM2.5 in the lungs of mice
2.3 小鼠肺脏炎性损伤
如图4A所示,与对照组[(14.78±2.82)×104个·mL-1]相比,PM2.5组[(24.11±5.30)×104个·mL-1]、低浓度ZnSO4组和高浓度ZnSO4组[(24.00±4.61)×104、(24.00±4.61)×104个·mL-1]BALF中总细胞数量升高(P<0.05),但染毒各组间没有差异。如图4B 所示,与对照组[(1.40±0.14)g·L-1]相比,PM2.5组、低浓度ZnSO4组和高浓度ZnSO4组BALF中总蛋白浓度升高[(2.58±0.50)、(2.69±0.41)、(3.62±0.98)g·L-1](P<0.05),并且高浓度ZnSO4组较PM2.5组升高更为明显(P<0.05)。与对照组[(44.18±11.54)U·L-1]相比,PM2.5组[(443.02±123.33)U·L-1]、低浓度ZnSO4组和高浓度ZnSO4组[(185.16±64.00)、(428.37±70.71)U·L-1]BALF 中LDH 水平升高(P<0.05),并且PM2.5组和高浓度ZnSO4组升高更明显(图4C)。与对照组[(9.54±2.38)×103ng·L-1]相比,PM2.5组[(20.51±3.04)×103ng·L-1]、低浓度ZnSO4组和高浓度ZnSO4组[(15.98±0.53)×103、(26.36±4.87)×103ng·L-1]BALF 中IL-1β 水平升高(P<0.05),并且高浓度ZnSO4组较另外2 组升高更明显(P<0.05,图4D)。
表1 大气PM2.5中可溶性金属离子及阴离子质量分数(±s)Table 1 Concentrations of soluble metals and anions in PM2.5 (±s)

表1 大气PM2.5中可溶性金属离子及阴离子质量分数(±s)Table 1 Concentrations of soluble metals and anions in PM2.5 (±s)
水溶性金属元素 质量分数/(μg·mg-1) 水溶性阴离子 质量分数/(μg·mg-1)Ca 21.83±0.15 F- 4.14±0.05 Mg 3.62±0.09 Ac- 22.80±0.17 Zn 4.38±0.06 Cl- 45.56±0.54 Mn 0.20±0.03 NO2- 0.85±0.04 Al 4.55±0.25 Br- 0.51±0.02 Cu 0.17±0.02 NO3- 236.41±5.40 Ni 0.09±0.01 HPO4 2- 180.22±5.25 Cr 0.69±0.12 SO4 2- 0.83±0.11 Pb 0.33±0.02 Cd 0.01±0.005 Se 0.28±0.03
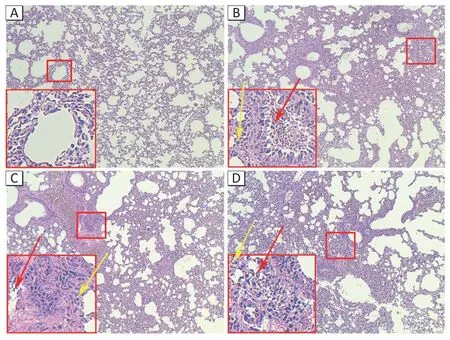
图2 PM2.5和Zn2+暴露诱导小鼠肺部形态的变化(HE染色,×10)Figure 2 Exposure to PM2.5 and Zn2+ induce changes of lung morphology in mice (HE staining,×10)

图3 PM2.5和Zn2+暴露诱导小鼠肺部炎症损伤评分和肺泡平均截距的变化Figure 3 Exposure to PM2.5 and Zn2+ induce changes of lung inflammation score and mean linear intercept in mice

图4 PM2.5和Zn2+暴露诱导小鼠肺部炎性损伤Figure 4 PM2.5 and Zn2+ exposure induce inflammatory lung injury in mice
3 讨论
一项关于大气颗粒物对全球疾病负担贡献的研究显示,1990―2015年,长期暴露于PM2.5导致420万人死亡,占全球总死亡人数的7.6%,而PM2.5污染在健康危险因素中排名第五[14]。研究报道,预计至2050年,因大气污染的持续存在而引起各类相关疾病死亡人数可达660 万[15]。而PM2.5主要进入呼吸系统诱发或进行性加重呼吸系统疾病,导致相关发病率和死亡率明显升高,其在空气污染导致的死亡中贡献较大[16]。因此,研究PM2.5毒理学机制,对预防空气污染造成的健康危害具有重要的意义。目前众多学者对PM2.5毒理学机制进行了大量研究,早期研究也发现PM2.5可以引起呼吸道急慢性损伤,但是目前其确切的毒作用机制尚不清楚。
细颗粒物成分复杂,其成分包括有机物、重金属、微生物等。以往的大部分研究主要将收集的颗粒物直接进行毒理学实验,并未对其主要组分的毒理学贡献进行分析研究[17]。也有学者对提取的颗粒物上有机物成分进行分析,表明其有一定的毒性作用[18]。但是,关于PM2.5的另一重要组成成分重金属毒性的研究还较少。已有大量的研究表明,重金属是PM2.5最主要的组成成分之一,而其中的锌离子含量较多,并且主要以离子的形式存在[19]。本研究通过对水溶性金属离子的测定,发现PM2.5样品中钙和铝含量最高,钙是建筑扬尘标志性元素,而铝是地壳源的代表性元素,这表明新乡市的建筑尘和土壤扬尘对大气PM2.5贡献较多。除上两种元素外,本研究进一步证实了新乡市PM2.5中锌离子含量较高,处于第三位,其质量分数可达4.38 μg·mg-1,这也与其他城市研究结果相似[20]。锌是一类重要的过渡金属,研究表明锌也普遍存在于大气PM2.5中,并且PM2.5上的锌多以硫酸锌的形式存在[21]。
鉴于前期检测新乡市PM2.5中锌离子含量较多,在雾霾天气吸入过量的PM2.5后,其上附着的锌离子是否也是呼吸道损伤的诱因之一,是本研究要探讨的问题。肺脏是环境污染物研究的重要靶器官之一,它不仅是人体进行气体交换的重要器官,还是机体防御的初级屏障。BALF中总蛋白浓度是反映肺部血管通透性的指标之一,BALF中的蛋白主要来自血浆渗出,总蛋白可反映肺泡上皮毛细血管屏障损伤,是肺泡气血屏障完整性的指标[22]。LDH主要来源于细胞膜损伤后的胞质内释放,可以反映肺内细胞损伤水平[23]。IL1-β 是一种急性反应的细胞因子,可诱导多种细胞产生细胞因子,还可激活B 淋巴细胞和T 淋巴细胞[24]。IL-1β 还可以直接引起炎症性肺损伤,并诱导炎症级联反应,使损伤进一步加重和扩大。在本研究中发现,PM2.5组、低浓度ZnSO4组和高浓度ZnSO4组小鼠BALF 中LDH 均明显高于PBS 对照组,上述研究结果表明PM2.5和与PM2.5中等量的外源性Zn2+均可以影响小鼠肺部血管通透性和造成肺部细胞损伤;炎性因子检测结果进一步显示PM2.5组、低浓度Zn2+组和高浓度Zn2+组小鼠BALF 中IL-1β 水平均明显高于PBS 对照组,提示 PM2.5由气管进入小鼠肺部后,其上的Zn2+也会对小鼠气道产生炎性刺激作用,释放炎性介质,引起肺部炎性损伤;小鼠肺部HE 染色病理切片也证实PM2.5和Zn2+可引起小鼠肺组织结构改变,导致肺泡壁断裂融合增宽,支气管内炎性细胞聚集,肺组织的正常结构遭到一定程度破坏。本研究表明,PM2.5及同等量的Zn2+暴露均能引起小鼠肺组织炎症反应。这也进一步提示新乡市重度雾霾天气中吸入的细颗粒物上的Zn2+可以造成肺部的炎症损伤。以往研究也发现,锌组分的含量与吸入颗粒物毒性效应之间常常存在正相关关系[25]。因此,PM2.5诱导的呼吸系统炎症反应可能与其过渡金属成分锌离子相关。
锌是人体必不可少的一类重要微量元素,对维持机体的正常生理功能至关重要。但是摄入或者接触过量的锌也会导致健康损伤。职业人群长期接触锌及其氧化物可以诱发机体损伤。而过量吸入含ZnO 颗粒物的烟雾可以直接导致急性呼吸道损伤并且伴气道高反应性[26]。研究表明,外源性锌离子诱导的细胞毒性反应主要包括促进活性氧释放,促进细胞凋亡及炎症反应相关基因的表达升高[20]。课题组前期的研究也发现,PM2.5可以诱导呼吸道上皮细胞活性氧释放,引起氧化应激反应,进而加重呼吸道炎症[27]。因此,推测PM2.5中锌离子组分可能通过影响肺脏氧化应激稳态而造成肺炎性损伤。但是本次研究未对此进行进一步的研究,PM2.5中过多的锌离子组分是否可通过引起呼吸道氧化应激反应失衡,进而参与PM2.5暴露导致的呼吸道炎症的过程,而其具体的机制又是通过哪些信号通路进行调控,这是下一步要进行的研究。
综上所述,本研究表明与PM2.5中等量的锌离子可以引起肺组织损伤和急性呼吸道炎症反应,这提示锌离子组分可能是PM2.5毒性效应的潜在研究靶点,为更深入地探索PM2.5暴露导致的呼吸系统疾病发生机制提供了潜在的研究靶点和实验依据。

