微透析结合代谢组学探究佐剂性关节炎大鼠的代谢扰动及牛膝总皂苷的干预作用
张 衡,吴 虹,卜妍红,孙明慧,邓 然,王 言,王梦蝶,王荣慧,吴 欢
(1. 安徽中医药大学药学院,安徽 合肥 230012;2. 新安医学教育部重点实验室,中药研究与开发安徽省重点实验室,中药复方安徽省重点实验室,安徽 合肥 230012)
类风湿关节炎 (rheumatoid arthritis,RA) 是一种慢性、系统性自身免疫疾病,病理特征为慢性滑膜炎性增生、侵蚀性血管翳形成及关节软骨退化等[1]。中药牛膝为苋科植物牛膝 (achyranthes bidentata BI) 的干燥根[2],主要含有皂苷、植物甾酮以及糖类等成分,其主要有效成分牛膝总皂苷 (achyranthes bidentate saponins, ABS) 为五环三萜类化合物,具有抗炎镇痛,抗肿瘤以及调节免疫等作用[3],对类风湿关节炎,骨关节炎和骨质疏松等疾病具有良好的治疗作用[4]。
微透析技术 (microdialysis,MD) 是一种实时在体微量取样技术,能针对靶部位细胞外液中的化合物 (包括内源性、外源性) 进行连续在体的取样。MD技术采集到的样品由于通过透析膜,生物大分子无法通过,可直接用于分析检测而无需预处理[5]。本研究将MD探针植入AA大鼠关节腔采样,结合UPLC-Q-TOF/MS技术寻找并鉴定与RA相关的生物标志物,解析可能的代谢途径,从代谢组学角度阐明ABS干预RA的作用机制。
1 材料与方法
1.1 实验动物健康的SD大鼠,♂,体质量(180-220) g,SPF级,许可证号SCXK (鲁) 20190003,购于安徽中医药大学实验动物中心,在恒温 (24 ℃)、自然光暗周期和自由饮水条件下饲养1周,待其适应环境后进行实验。
1.2 药材与试剂牛膝药材购自同仁堂,由安徽中医药大学药学院生药教研室刘守金教授鉴定为怀牛膝;弗氏完全佐剂(FCA) (F5881);乙醇(TEDIA公司,色谱纯);甲酸(阿拉丁公司,色谱纯);乙腈(批号:106246,美国Fisher公司,色谱纯)。
1.3 仪器KQ-200KDB 型超声清洗器(昆山市超声仪器有限公司) ;SYZ-C石英第二沸腾高纯水蒸馏器 (杰瑞尔电气有限公司,中国) ;微透析灌注泵 CMA400 (瑞典CMA公司) ;微透析灌注器Ms-gan250、微透析收集器CMA470 (瑞典CMA公司) ;微透析探针 (MAB 6.14.4.C,膜长10 mm,直径0.6 mm, 截留分子量15 kDa) ;YLS-7C型足趾容积测量仪 (北京凯辉盛达科技发展有限公司) ;Waters Acquity UPLC超高效液相色谱系统 (Waters Corporation,美国) ;Waters QTOF 高分辨率飞行时间质谱仪 (Waters Corporation,美国) ;ME204电子天平 (瑞士METTLE TOLEDO公司)。
1.4 SD大鼠分组随机把SD大鼠分成空白对照组、ABS组 (60 mg·kg-1) 及AA模型组,每组6只,除对照组外,大鼠右后足均用FCA (0.1 mL) 注射,建立AA大鼠模型,对照组注射同体积生理盐水,造模成功d 1 (致炎d 17)后ABS组连续灌胃给药7 d,每日1次,模型组及对照组用同体积的生理盐水灌胃。
1.5 ABS的提取与定量测定怀牛膝样品粉碎成均匀粉末,称取100 g,放入圆底烧瓶 (2 L) 加入1 L乙醇加热回流提取3次,1 h/次,合并提取液,70 ℃水浴旋蒸浓缩至无醇味,剩余提取液加入纯水定容至1 L,超声10 min,抽滤后量取150 mL过D101型大孔吸附树脂柱,先用600 mL纯水洗脱水溶性成分,弃去;然后用500 mL 70 %乙醇洗脱,洗脱液收集干燥至恒重[7]。采用紫外可见分光光度法测定提取后ABS的含量达55.34%。
1.6 UPLC-Q-TOF/MS检测AA大鼠关节腔微透析液
1.6.1制备林格氏液 林格氏液由8.6 g的NaCl,0.28 g的CaCl2和0.3 g的KCL溶于1 000 mL超纯水,使用前过0.22 μm的微孔滤膜。
1.6.2样品的处理及QC样品的制备 微透析探针植入大鼠膝关节腔,实时检测大鼠的体温使其维持在37 ℃。收集每只大鼠的720 μL微透析液样品 (灌流速度1.5 μL·min-1, 收集周期为8 h) 并贮藏于-80 ℃。在分析之前,将透析液样品通过真空离心器干燥。然后用甲醇重新复溶,涡旋,并在4 ℃,14 000 r·min-1离心10 min。所有微透析样品各取10 μL,用作QC样品。
1.7 组织病理学检查将大鼠麻醉,腹腔取血。取大鼠膝关节滑膜,用10% (v / v) 多聚甲醛固定,经脱钙、脱水、石蜡包埋切片后,用苏木精-伊红 (HE) 染色法染色,显微镜下观察滑膜组织病理形态变化。
1.8 关节肿胀度、关节炎评分测定实验前使用足趾容积测量仪测定各组大鼠的足趾肿胀度,AA大鼠在造模后d 7开始,对各组大鼠进行足趾容积测定 (3 d/次),肿胀度:△=造模后足趾容积平均值-造模前足趾容积平均值。采用关节炎指数 (arthritic index,AI) 评分法对各组大鼠评分 (3 d/次)。
1.9 液质联用条件UPLC色谱条件 色谱柱:HILIC column (waters公司, 2.1 mm×100 mm, 1.7 μm); 柱温35 ℃;样品室温度保持6 ℃ 流速 200 μL·min-1;流动相为乙腈(A)-0. 1%甲酸水溶液 (B),梯度洗脱 (0-3 min,95% A; 3-8 min,90%-82% A; 8-12 min,82%-65% A; 12-15 min,65%-90%A;15-18 min, 95%A )。
质谱条件电喷雾离子源 (ESI) 在正、负离子模式分别进行MSE扫描;低碰撞电压:6 V;高碰撞电压:20-30 V;离子源温度:120 ℃;锥孔电压:40 V;电喷雾电压:2.5 kV;干燥气温度:350 ℃;扫描范围:50-1 200 m/z。
1.10 代谢组学数据处理
1.10.1多元统计分析 依次将UPLC-Q-TOF/MS在ESI+和ESI-模式下采集的各组质谱数据导入Progenesis QI v3.03软件用于自动数据处理 (包括峰值拾取、保留时间 (tR) 校正和归一化)。通过QI软件的阈值 (P<0.05, fold changes ≥ 1.5, CV<30%) 进一步筛选数据。然后将筛选数据集导入Ezinfo 3.0软件中进行多元统计分析,包括无监督的主成分分析 (PCA) 及有监督的正交偏最小二乘法判别分析 (OPLS-DA)。根据VIP >1.0来选出差异离子。
1.10.2潜在生物标志物的识别和代谢通路分析 将筛选过的差异代谢物的m/z和质谱高能量下的离子碎片信息与Human Metabolome Database (HMDB) (https://hmdb.ca/) 以及查阅文献自建的数据库进行匹配来确认筛选后的潜在代谢物。使用网络分析平台MetaboAnalyst 4. 0 (https://www.metaboanalyst.ca) 对ABS干预RA相关的潜在生物标志物进行代谢通路富集分析及拓扑分析。
2 结果
2.1 各组大鼠足肿胀度与关节炎评分各组大鼠的关节炎评分及左后肢的继发性足肿胀见Fig 1 (A、B)。与AA组相比,ABS组在给药d 6 (造模d 23后) 对AA大鼠的足肿胀具有抑制作用并能改善其关节炎评分 (P<0.05)。这些结果表明AA大鼠模型构建成功,ABS能明显改善RA症状。

Fig 1 Secondary paw swelling, arthritis score and pathological changes of synovial tissues in each group of rats
2.2 各组大鼠滑膜组织病理形态学变化HE染色结果如Fig 1 (C、D、E) 所示:对照组大鼠关节滑膜组织的细胞表面排列均匀、整齐,未出现滑膜异常增生(Fig 1C);AA组大鼠滑膜组织明显观察到滑膜间质有大量炎性细胞浸润,滑膜细胞增殖、呈错乱排列 (Fig 1D) ;ABS组 (60 mg·kg-1) 滑膜细胞排列尚整齐,但有少量炎性细胞浸润 (Fig 1E)。
2.3 关节腔微透析液中代谢物的分离采用UPLC-Q-TOF/MSE在正、负离子模式下采集AA组、ABS组、对照组微透析样品的LC-MS数据,总离子色谱图 (Fig 2)。生成的原始UPLC-Q-TOF/MS数据集经Progenesis QI v3.03软件导入Ezinfo 3.0进行无监督的PCA以及有监督的OPLS-DA分析。PCA图 (Fig 3) 表明对照组、AA组、ABS组代谢轮廓具有明显差异。ABS组的数据矩阵有从模型组到对照组的回归趋势,表明ABS给药组对AA大鼠的代谢紊乱有纠正作用。
Fig 2 Representative TICs of microdialysis sample
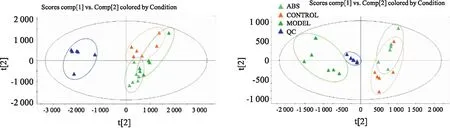
Fig 3 PCA score plots of QCP samples and all tested samples of Control,AA,ABS groups in ESI+ mode (A) and ESI- mode (B)
2.4 潜在生物标志物的筛选和鉴定OPLS-DA分析结果显示:在正、负离子模式下,对照组和AA组以及AA组和ABS给药组均可以被明显地区分(Fig 4)。S-plots (Fig 4)中,距离中心区域越远代表代谢物在两组之间分离度越大。其中红框中的代谢物为VIP>1.0,这些化合物为潜在的生物标志物。OPLS-DA及S-plots筛选出的差异代谢物,在正、负离子模式下共获得了19种与ABS干预AA相关的生物标志物,见Tab 1。由潜在的生物标志物生成的heatmap呈现了3组之间的差异,见Fig 5。其中,与AA组相比,上述19种生物标志物在ABS干预后能在不同程度上接近对照组水平。例如,在AA组中Asparaginylarginine,15-Deacetylcalonectrin,AMP,Palmitoleoyl Ethanolamide,Pentadecanoylcarnitine,Sebacic acid,Stearic acid,GMP,Uridine 5′-monophos-phate,Palmitic acid, 3,5-Dichloro-4-hydroxy-2-methoxy-6-methylbenzoic acid和Cortisol等生物标志物水平明显增加,但ABS组与之相比呈下降趋势。同样地,AA组中Cytidine,PA(18:0/14:1(9Z)),xi-3-(4-Isopropylphenyl)-2-methylpropanal,Prenyl glucoside,Diisobutyl phthalate,Kinetensin 1-3和Arnamiol等标志物水平明显降低,但ABS组与之相比呈增加趋势。
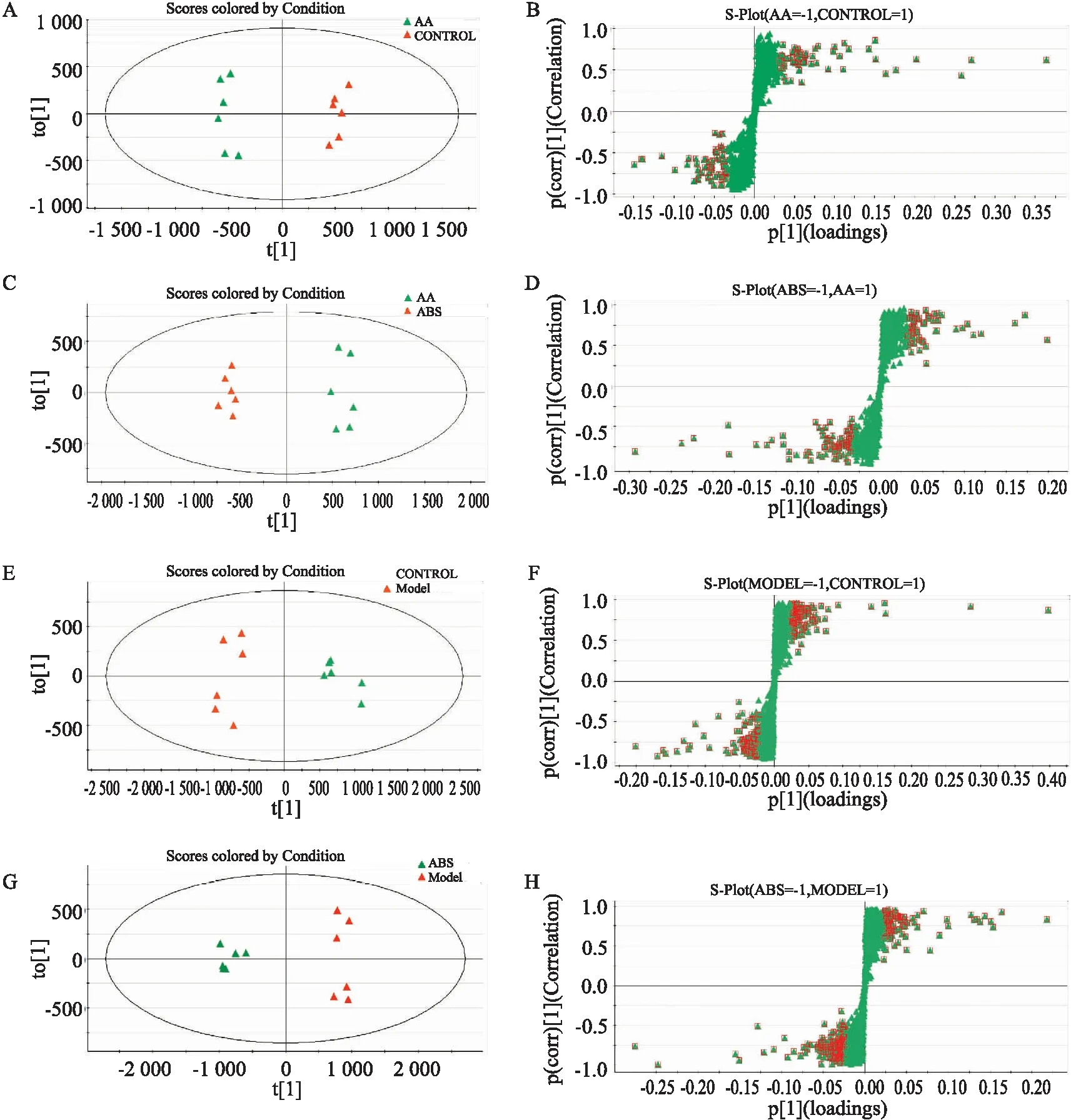
Fig 4 OPLS-DA score plot and S-plot plot of rat microdialysis samples

Fig 5 Heat map of metabolite levels in control,AA and ABS groups
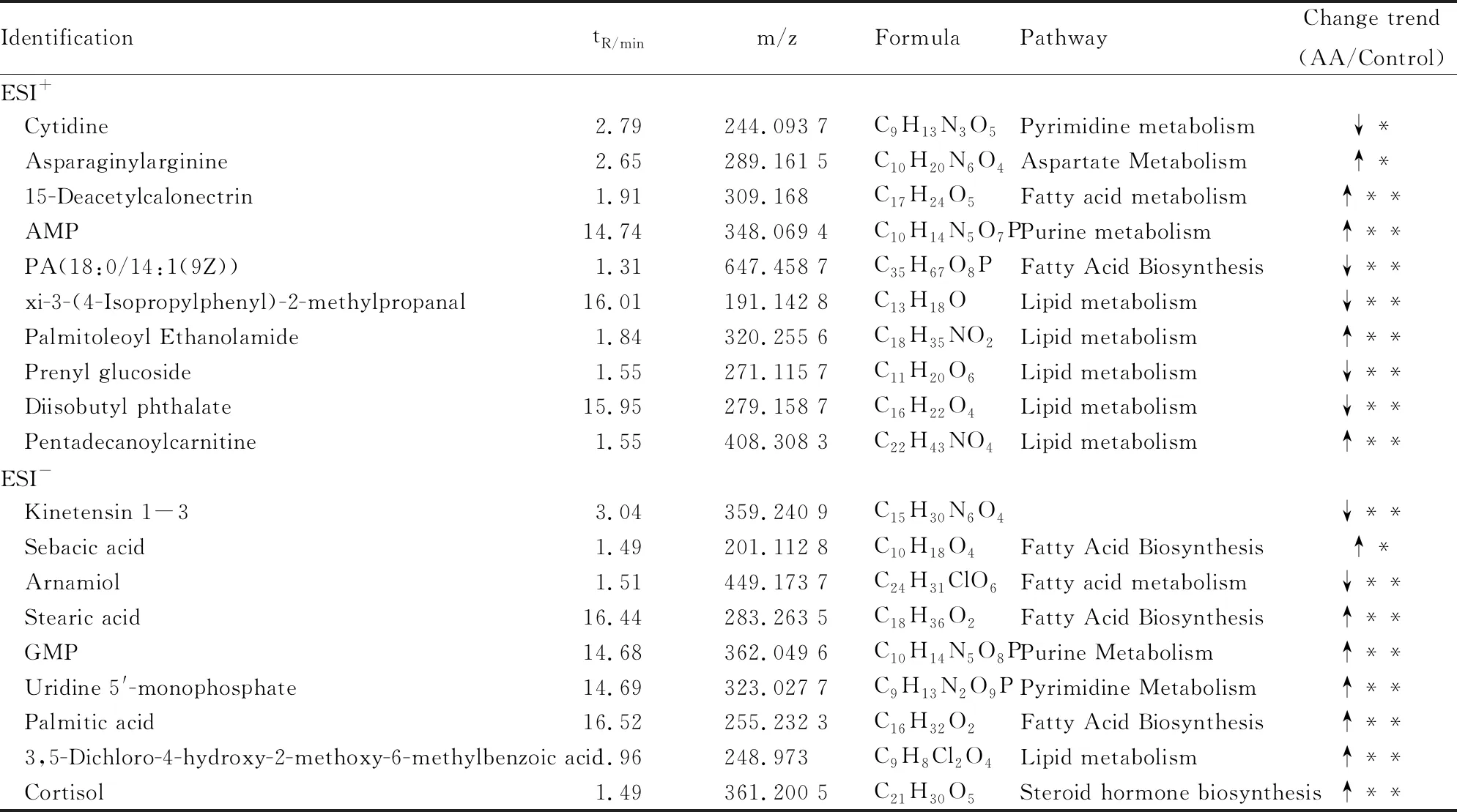
Tab 1 Potential biomarkers identified by UPLC-QTOF/MS
2.5 代谢通路分析为了识别受ABS影响的可能代谢途径,通过MetaboAnalyst 4.0软件构建代谢途径分析发现,ABS治疗RA的代谢途径主要涉及嘌呤、嘧啶、脂肪酸等代谢,见Fig 6。
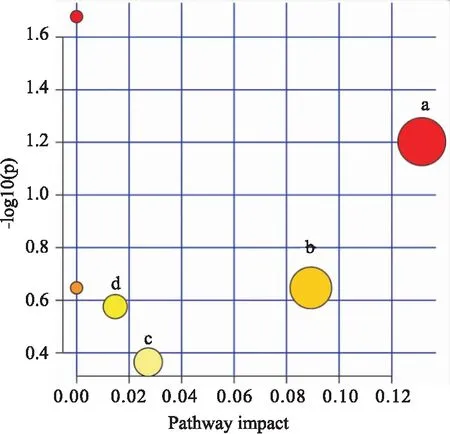
Fig 6 Pathway enrichment analysis of 19 potential biomarkers responsible in treatment of ABS
3 讨论
中药牛膝具有活血化瘀、滋补肝肾及引药下行等功效。本课题组前期研究了牛膝不同极性提取部位的抗炎、镇痛效果,结果显示,正丁醇萃取的三萜皂苷类化合物能显著减轻小鼠耳肿胀度,降低胸腺指数及脾指数,提示其能抑制体内的免疫反应并具有显著的抗炎镇痛作用[6]。已有研究证明,ABS对RA具有疗效,但其干预机制尚不明确,需要进一步探究[7]。
在关节腔微环境中,内源性代谢物与基质可能存在特异性或非特异性结合。传统的样本处理方法通过加入试剂解除其相互作用。适宜规格的微透析探针能阻断大分子物质穿过而选择性采集小分子代谢物,其“采样”与“纯化”的双重功能,可得到无生物大分子的微透析样品,相比于血样和组织样品纯净度高,无需样品前处理可直接进样分析,避免了前处理的冗长及可能带来的误差,使代谢组学结果更加客观[8]。
本研究表明,ABS给药能有效抑制AA大鼠的继发性肿胀,且明显改善滑膜增生和炎性细胞浸润。建立基于UPLC-Q-TOF/MS结合微透析技术的代谢组学方法,从内源性差异代谢物的角度来探究ABS抗RA的机制。代谢组学的PCA图表明,ABS组有向对照组水平回归的趋势,故ABS具有改善RA病理过程代谢紊乱的作用,并鉴定出19个与ABS干预RA有关的生物标志物。这些生物标志物主要涉及嘌呤代谢、脂肪酸代谢、嘧啶代谢和类固醇激素代谢等途径。结合关节炎评分、足肿胀度及滑膜组织病理形态学变化等指标的变化,发现ABS组比AA模型组更接近对照组,表明ABS主要通过调节嘌呤、嘧啶、脂肪酸和类固醇激素的代谢紊乱以及抑制炎症和调节免疫来缓解RA的进程。
3.1 嘌呤代谢的变化越来越多的研究结果表明RA的发展与嘌呤代谢紊乱有关。嘌呤代谢参与多种生理和病理过程,通过参与炎症反应,在RA的病理过程中发挥作用[9-11]。在炎症部位中,各种细胞(如免疫细胞)分泌一系列细胞间效应分子,将三磷酸腺苷(ATP)释放到胞外,ATP和二磷酸腺苷(ADP)通过胞外二磷酸三磷酸核苷水解酶1 (CD39)转化为一磷酸腺苷(AMP),从而导致AMP水平上升[12]。CD39和胞外ATP在FOXP3+调节性T细胞的免疫抑制功能中也起着重要作用。CD39在FOXP3+调节性T细胞中表达并促进腺苷的产生,腺苷的产生会使FOXP3+调节性T细胞分泌免疫抑制细胞因子如IL-10。此外,研究表明腺苷的产生会使细胞内AMP水平增加。在本实验中,AA大鼠的嘌呤代谢出现了明显的变化,其中,AMP水平明显升高,ABS给药后恢复到正常水平。表明ABS干预后的AA大鼠嘌呤代谢紊乱得到逆转,ABS可能通过干预嘌呤代谢途径发挥治疗RA作用。
3.2 脂肪酸代谢的变化脂肪酸,包括饱和脂肪酸和不饱和脂肪酸,参与多种疾病代谢过程,如RA、II型糖尿病和心血管疾病的发展[13]。研究表明,在RA中炎性细胞因子TNF-α刺激脂肪组织分解释放游离脂肪酸,导致血浆中游离脂肪酸水平升高[14]。也有研究表明,硬脂酸和棕榈酸在RA中均具有显著变化,是预测RA的重要生物标志物[15-16]。本研究结果表明,AA大鼠的硬脂酸和棕榈酸水平显著增高,并在ABS的干预下回调至正常水平,提示ABS可能通过降低游离脂肪酸水平,改善脂肪酸生物合成途径的代谢紊乱而达到干预RA的作用。
3.3 嘧啶代谢的变化本研究发现,与对照组相比,模型组中的胞苷水平下降,一磷酸尿嘧啶水平升高。在ABS给药后,胞苷和一磷酸尿嘧啶的水平均恢复到接近对照组的水平,结果表明ABS具有改善嘧啶代谢紊乱的作用。嘧啶核苷酸衍生物也能对细胞信号和能量代谢起到调节作用。然而,与嘌呤核苷酸衍生物在细胞生物功能中的作用相比,嘧啶核苷酸衍生物的相关报道较少,推测ABS可能通过调节嘧啶代谢紊乱干预RA。
3.4 类固醇激素的变化皮质醇是类固醇激素的一种,在离子运输、心血管系统、免疫功能和中枢神经系统等方面具有调节作用[17]。研究表明,RA炎性条件下,炎性细胞因子TNF-α和IL-1β激活肝脏中11b-羟基类固醇脱氢酶 (11b-HSD) 使血清中皮质醇水平升高[18]。实验结果发现相比于对照组,模型组皮质醇水平升高,ABS下调过高的皮质醇水平,表明ABS可能通过调节类固醇激素代谢发挥治疗RA的作用。
本研究将微透析技术与UPLC-Q-TOF/MS相结合,检测AA大鼠关节腔微透析液中代谢物的变化。经多元统计分析,共筛选出19个与牛膝总皂苷干预AA相关的潜在生物标志物,通过通路富集分析发现它们主要涉及嘌呤代谢、嘧啶代谢、脂肪酸合成及类固醇激素合成途径。研究表明微透析结合代谢组学研究能揭示ABS干预AA的代谢相关机制,为ABS作用机制的深入探讨奠定。

