黄芪多糖对抑郁大鼠海马Nrf2-ARE通路的影响
宿宏佳,王冬梅,张 腾,张 翔,毛淑梅,李承德
(1.潍坊医学院药理学教研室、山东省高校重点应用药理学实验室,山东 潍坊 261053;2.泰山护理职业学院药理学教研室,山东 泰安 271000;3.潍坊医学院临床药学教研室、山东省高校重点应用药理学实验室,山东 潍坊 261053)
近年抑郁发病率逐年升高,临床常用的5-HT再摄取抑制药、三环类药物等,久用不良反应较大。研究表明,氧化应激反应参与了抑郁的发生、发展[1]。Nrf2在机体调节氧化应激反应中具有重要作用,可与抗氧化反应元件(ARE)结合,启动抗氧化酶的基因转录,形成Nrf2-ARE信号通路,调节机体氧化应激水平。报道显示调控Nrf2-ARE通路活性可改善动物的抑郁行为[2]。此外,资料证实海马损伤与抑郁的发生有关,修复海马损伤有利于改善机体抑郁行为[3]。黄芪提取物APS在多种疾病的动物模型中显示出抗氧化活性[4],但APS是否可通过调节Nrf2-ARE通路改善海马氧化应激损伤,从而发挥抗抑郁作用,研究较少。
1 材料与方法
1.1 动物分组健康雄性Wistar大鼠(SCXK鲁20130001),体质量(200±20) g购于山东鲁抗公司。适应性饲养后大鼠随机分为4组:正常组(Control)、抑郁组(Depression)、APS低剂量组(APS-low)、APS高剂量组(APS-high),每组10只。
1.2 药品试剂与仪器Nrf2抗体(ab137550)、HO-1抗体(ab13248):英国Abcam公司;SOD(A001-2)、MDA(A003-1)、GSH-Px(A005-1)、CAT(A007-1-1)试剂盒:南京建成公司;羊抗兔IgG(ZDR-5306):北京Zsbio生物公司;APS(纯度:70%):广东省惠州市东方公司;逆转录试剂盒(FSQ-101):日本TOYOBO公司;扩增试剂盒(204052):德国QIAGEN公司;大鼠束缚盒、游泳箱、敞箱:根据文献自制。
1.3 方法
1.3.1抑郁模型制备[5]除正常组外其余大鼠每天接受两种慢性不可预见性应激(chronic unpredictable mild stress,CUMS),连续28 d。应激包括:冷水强迫游泳、热环境、昼夜节律改变、夹尾、躯体活动束缚、倾斜鼠笼、禁水、进食剥夺、噪音环境、电击足底、潮湿垫料等。
1.3.2药物治疗 自大鼠接受CUMS开始,予以200、400 mg·kg-1APS进行治疗,连续治疗4周。其余大鼠予以等容量的溶剂。
1.3.3抑郁行为评价 糖水偏好评价, 根据文献[5],大鼠事先饮食剥夺、饮水剥夺24 h,然后进行糖水偏好监测:大鼠单笼饲养,鼠笼放置1瓶纯水、1瓶1%蔗糖水,为排除位置偏好等因素干扰,每0.5 h更换一次两瓶的位置,大鼠自由摄水2 h(上午8-10点),分别测定大鼠对两种液体的摄取量,计算糖水偏好度。糖水偏好度/%=糖水消耗量/(纯水消耗量+糖水消耗量)×100%
强迫游泳实验 大鼠于游泳箱(水迷宫设备的金属圆筒:直径100 cm,高度60 cm)中自由游泳5 min,水深35 cm、水温(24-26) ℃,录像并计时大鼠漂浮不活动时间。实验前1 d,让大鼠练习游泳15 min。
悬尾实验 用胶带绑缚大鼠尾部,悬挂于吊钩6 min,头距地面30 cm,录像并计时后5 min不挣扎静止时间。
1.3.4PCR检测 TRIzol法从大鼠海马组织中提取总RNA,经逆转录合成cDNA(37 ℃ 15 min,95 ℃ 5 min)。PCR扩增分采用引物Nrf2 5′-CTGGCT GATACTACCGCTGTT-3′(正向)、5′-GTGGAGAG GATGCTGCTGAA-3′(反向),β-actin 5′-TCACCCA CACTGTGCCCCATCTACGA-3′(正向)、5′-CAGCGG AACCGCTCATTGCCAATGG-3′(反向),扩增条件:95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s(40次循环)。采用比较阈值循环(CT)法,用方程2-ΔΔCT进行数据处理。
1.3.5Western blot检测 分别提取海马组织中总蛋白与核蛋白,取40 μg样品电泳,转膜后封闭1 h,一抗溶液(Nrf2、HO-1、β-actin均为 1 ∶1 000)中孵育(4 ℃过夜),洗涤后羊抗兔IgG溶液(1 ∶5 000)室温孵育1 h,洗膜、显影、定影,通过ImageJ进行灰度分析,蛋白相对表达量=目的蛋白条带灰度/相应β-actin条带灰度。
1.3.6氧化应激指标 将海马组织匀浆,用检测试剂盒检测海马组织匀浆液中CAT、SOD、GSH-Px、MDA的水平。
1.3.7HE染色 10%多聚甲醛固定大鼠海马组织,标本常规蜡块包埋、切片(厚4 μm),进行HE染色,光镜下分析大鼠海马的组织学变化,高倍镜下计数海马CA1区神经元数量(每个样本取15个视野,取均值)。
1.3.8统计学处理 用SPSS 21.0软件(美国IBM公司)对资料进行单因素方差分析,各组间两两比较,分别采用Tukey HSD检验(方差齐时)或Dunnett T3检验(方差不齐时)。
2 结果
2.1 APS对抑郁行为的影响Tab 1显示,抑郁组大鼠糖水偏好度明显低于正常组(P<0.05),且抑郁组大鼠强迫游泳实验中漂浮不动时间、悬尾实验中静止不动时间均较正常组明显延长(P<0.05)。与抑郁组比较,APS干预改善了抑郁大鼠的抑郁行为(P<0.05);且APS高剂量组改善程度优于APS低剂量组(P<0.05)。

Tab 1 Effects of APS on depressive behaviors of
2.2 APS对海马Nrf2基因、Nrf2总蛋白、Nrf2核蛋白的影响由Fig 1可见,与正常组比较,抑郁组海马Nrf2 mRNA、Nrf2总蛋白、Nrf2核蛋白升高(P<0.05)。与抑郁组比较,APS低、高剂量组海马Nrf2 mRNA、Nrf2总蛋白、Nrf2核蛋白水平进一步升高(均P<0.05),且APS高剂量组上述物质水平升高更为明显(均P<0.05)。
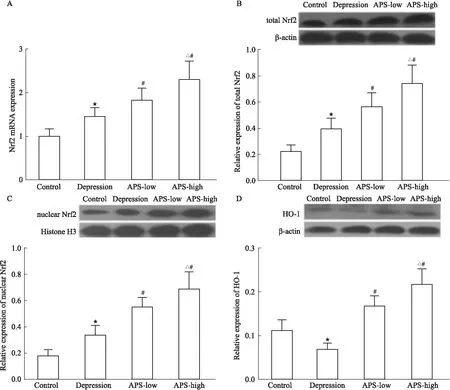
Fig 1 Effects of APS on Nrf2 mRNA,Nrf2 and HO-1
2.3 APS对海马氧化应激指标的影响Fig 1D、Tab 2显示,与正常组比较,抑郁组大鼠海马匀浆液MDA水平明显升高,而HO-1、SOD、GSH-Px、CAT水平则明显降低(P<0.05)。与抑郁组比较,APS干预可明显降低抑郁大鼠海马MDA水平,升高HO-1、SOD、GSH-Px、CAT水平(P<0.05),且APS高剂量组上述指标的改善较APS低剂量组更为明显(P<0.05)。
Tab 2 Effects of APS on hippocampal levels of oxidative
2.4 APS对海马组织结构变化的影响Fig 2显示,正常组大鼠海马的CA1区神经元分布密集,细胞排列规则,未见明显损伤。抑郁组大鼠CA1区神经元数量较正常大鼠减少(P<0.05),且细胞排列欠规则,部分细胞的结构不完整。与抑郁组比较,APS高剂量组大鼠CA1区神经元数量明显增加(P<0.05)。

Fig 2 HE staining(×400)
3 讨论
目前临床常用抗抑郁药可引起多种不良反应,且临床资料显示对多种类型的抑郁症疗效欠佳。近年学者在天然产物治疗抑郁方面进行了大量探索,多种中药有效成分被证实具有抗抑郁活性,为抗抑郁新药的发现开辟了新途径[6]。本研究采用CUMS对大鼠进行刺激,采用强迫游泳实验与悬尾实验对大鼠绝望程度进行了评价,并对大鼠的快感缺乏表现进行了监测(糖水消耗实验),结果显示经过多种慢性应激性刺激后,大鼠呈现绝望表现、且存在快感缺乏,表明大鼠存在抑郁行为;经APS干预后,大鼠的绝望程度及快感消失得到显著改善。上述行为学变化表明APS干预可改善大鼠的抑郁行为,但APS抗抑郁的机制,目前尚未明了。
大脑海马与机体的情绪调节有关,研究表明抑郁模型动物的海马往往存在组织损伤,药物改善海马损伤后,抑郁行为减轻,故改善抑郁机体海马病变被认为是一项有效的抗抑郁措施[3]。本研究显示,大鼠经过CUMS刺激后,海马发生病理损伤,这与既往报道一致[3]。而经APS干预后,发现大鼠海马损伤明显减轻。鉴于海马在情绪调节中的重要作用,推测APS的抗抑郁活性可能与保护海马有关。
CUMS刺激诱发海马损伤及抑郁行为的机制复杂,其中氧化应激异常增强被认为是关键因素之一。除CUMS诱发的抑郁模型外,其他多种抑郁动物模型及抑郁患者亦被证实存在过强的氧化应激反应,而动物及临床试验则证实抑制过强的氧化应激可减轻机体抑郁行为,是治疗抑郁的重要策略之一[7-8]。中药及提取物具有多作用靶点的特性,研究表明APS在多种疾病模型中具有抗氧化作用[9],但APS是否在抑郁机体海马中发挥抗氧化应激作用,尚未见研究报道。体内MDA含量可反映机体氧自由基水平;SOD、GSH-Px、CAT等酶则在体内发挥重要的抗氧化作用,上述物质水平失衡可诱发多种疾病。本研究中抑郁大鼠海马MDA水平较正常组升高,而海马SOD、GSH-Px、CAT水平降低,表明抑郁大鼠海马存在过强的氧化应激反应,这与文献报道一致[10]。而经APS干预后,大鼠SOD、GSH-Px、CAT水平较正常组升高,但MDA水平明显降低,表明本研究中APS下调了抑郁大鼠海马组织中的氧化应激水平。除上述抗氧化酶外,HO-1亦是机体防御氧化应激的重要机制之一,其表达水平降低时机体抗氧化能力下降,其表达异常参与了多种疾病的发生,而上调HO-1表达可改善氧化应激引起的机体损伤[11]。新近几项研究显示,HO-1也参与了抑郁的发病[12]。本研究表明CUMS显著降低了抑郁大鼠海马HO-1的表达水平,可能因HO-1清除大鼠体内异常增多的氧化物质被消耗所致;而APS干预可显著增加其表达。上述结果表明APS可通过多途径调控抑郁大鼠海马氧化应激反应。鉴于氧化应激反应在海马损伤及抑郁中的作用,推测APS的海马保护作用及抗抑郁作用可能与其抑制CMUS诱发的海马氧化应激反应有关。
上述抗氧化酶系的表达受多种因素调控,其中Nrf2被认为是一个重要的调控抗氧化酶系的转录因子[13],参与了肿瘤、炎症、免疫性疾病、内分泌疾病等的发病与转归[14-15]。现有理论认为,keap1为Nrf2的抑制蛋白,通常情况下二者结合使Nrf2的活性被抑制;当机体存在过强的氧化应激反应时,活性氧等引起keap1构象变化,Nrf2被解除抑制、并由细胞浆移位进入细胞核,在核内与ARE结合,使ARE调控的SOD、GSH-Px、CAT、HO-1等抗氧化酶的基因表达增加,从而发挥抗氧化应激作用。本研究中抑郁组大鼠海马Nrf2基因、Nrf2总蛋白及核蛋白较正常组表达增加,可能为CUMS引起大鼠氧化应激水平增高,过强的氧化应激反馈性激活Nrf2,对氧化应激反应发挥调控作用,但自然状态下机体内在的反馈性调节作用相对较弱,不能有效地对抗体内存在的过强的氧化应激反应。与本研究结果类似,文献中多种氧化应激疾病模型存在Nrf2被激活的现象[15]。本研究采用APS对抑郁大鼠进行了干预,结果显示,与抑郁组比较,APS干预提升了抑郁大鼠海马Nrf2基因、Nrf2总蛋白及核蛋白水平,该结果表明APS可增加抑郁大鼠Nrf2表达并促进Nrf2活化和向核内转位,增强大鼠的抗氧化应激机制。结合上述APS对SOD、GSH-Px、CAT、HO-1等的作用,可见APS激活了抑郁大鼠海马的Nrf2-ARE通路。
综上所述,APS可剂量依赖性的改善抑郁大鼠的海马损伤及抑郁行为,其作用可能与激活大鼠Nrf2-ARE通路有关。

