陈皮HPLC指纹图谱色谱条件优化
李 影,尚尔雨,孙 爽,吕邵娃
(1.黑龙江中医药大学药学院,哈尔滨 150040; 2.黑龙江省森林保护研究所,哈尔滨 150040)
高效液相色谱法将组分分离与定量分析或定性鉴定相结合,为中药研究提供了一种分析复杂样品的有效方法,已成为21世纪最重要的色谱技术之一,并得到国际认可[1-5]。 将HPLC应用于中药研究,可鉴定中药的物质基础并了解其作用机理。建立中药指纹图谱时,要求所得图谱一定要符合系统性、特征性和稳定性等特征,其前期色谱条件的选择会直接影响指纹图谱质量,因此建立指纹图谱前,需要花费大量时间对色谱条件进行考察[6-9]。陈皮(CitriReticulataePericarpium)为临床常用中药,是芸香科植物橘(CitrusreticulataBlanco)及其栽培变种的干燥成熟果皮,道地药材为广东新会的茶枝柑果皮[10]。优化陈皮药材的HPLC色谱条件,以期为后期指纹图谱建立提供基础,为陈皮的鉴定和质量控制提供参考依据。
1 仪器与试药
1.1 仪器
Thermo Ultimate 3000高效液相色谱仪(美国Thermo Fisher公司生产),BJH-W300K电陶瓷锅(广东天际电器股份有限公司生产),AB265-S托利多十万分之一电子分析天平(瑞士托利多国际贸易有限公司生产),SB-5200D SCIENTZ超声波清洗机(宁波新芝生物科技股份有限公司生产),BUCHI R-210型旋转蒸发仪(瑞士BUCHI有限公司生产)。
1.2 试药
陈皮购于哈尔滨市同仁堂大药房,以上药材经黑龙江中医药大学药学实训教研室吕邵娃教授鉴定为正品,标本存放于黑龙江中医药大学药学院实验室。对照品川陈皮素(批号17050510)、芸香柚皮苷(批号18030408)、橙皮苷(批号171203)、橙皮素(批号171121)、3,5,6,7,8,3′,4′-七甲氧基黄酮(批号171108)、维采宁-2(批号170610)、甜橙黄酮(批号180117)、异甜橙黄酮(批号180366)、橘皮素(批号170510)、5-去甲川陈皮素(批号170816)。以上对照品均购自北京世纪奥科生物科技有限公司,质量分数≥98%。甲醇,乙腈,色谱纯(美国 Mreda 公司生产),甲酸,色谱纯(天津市科密欧化学试剂有限公司生产)。实验用水为娃哈哈纯净水。
2 实验方法与结果
2.1 供试品溶液制备
将陈皮洗净并晾干,取陈皮100 g加入10倍水浸泡1.5 h,煮沸60 min,过滤得其滤液,再次加入适量水煮沸30 min,过滤并将两次滤液合并,浓缩至200 mL,保存备用。取4 mL(0.5 g生药/mL) 继续浓缩至浸膏,将浸膏用甲醇溶解,并用100 mL容量瓶定容, 离心,过一次性微孔滤膜得到0.02 g生药/mL,保存备用。
2.2 萃取条件的选择
分别将陈皮水煎液用正丁醇、乙酸乙酯+正丁醇进行萃取,各萃取三次,旋转蒸干溶剂后,用水溶解并定容至50 mL,过0.22 μm滤膜后进样分析,并与其进行比较,结果见图1。
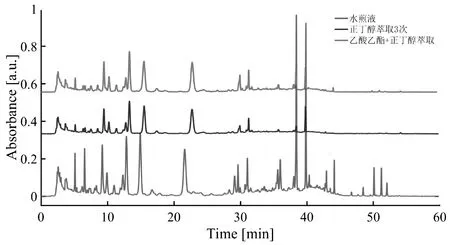
图1 样品前处理工艺考察Fig.1 Investigation of sample pretreatment process
实验结果表明,正丁醇及乙酸乙酯萃取40 min后,所要的目标峰没有出现,峰个数较少,不符合要求,故选择陈皮水煎液进样分析。
2.3 检测波长的选择
对同一份陈皮水煎液考察波长为283 nm、300 nm、330 nm下的色谱图,结果见图2。
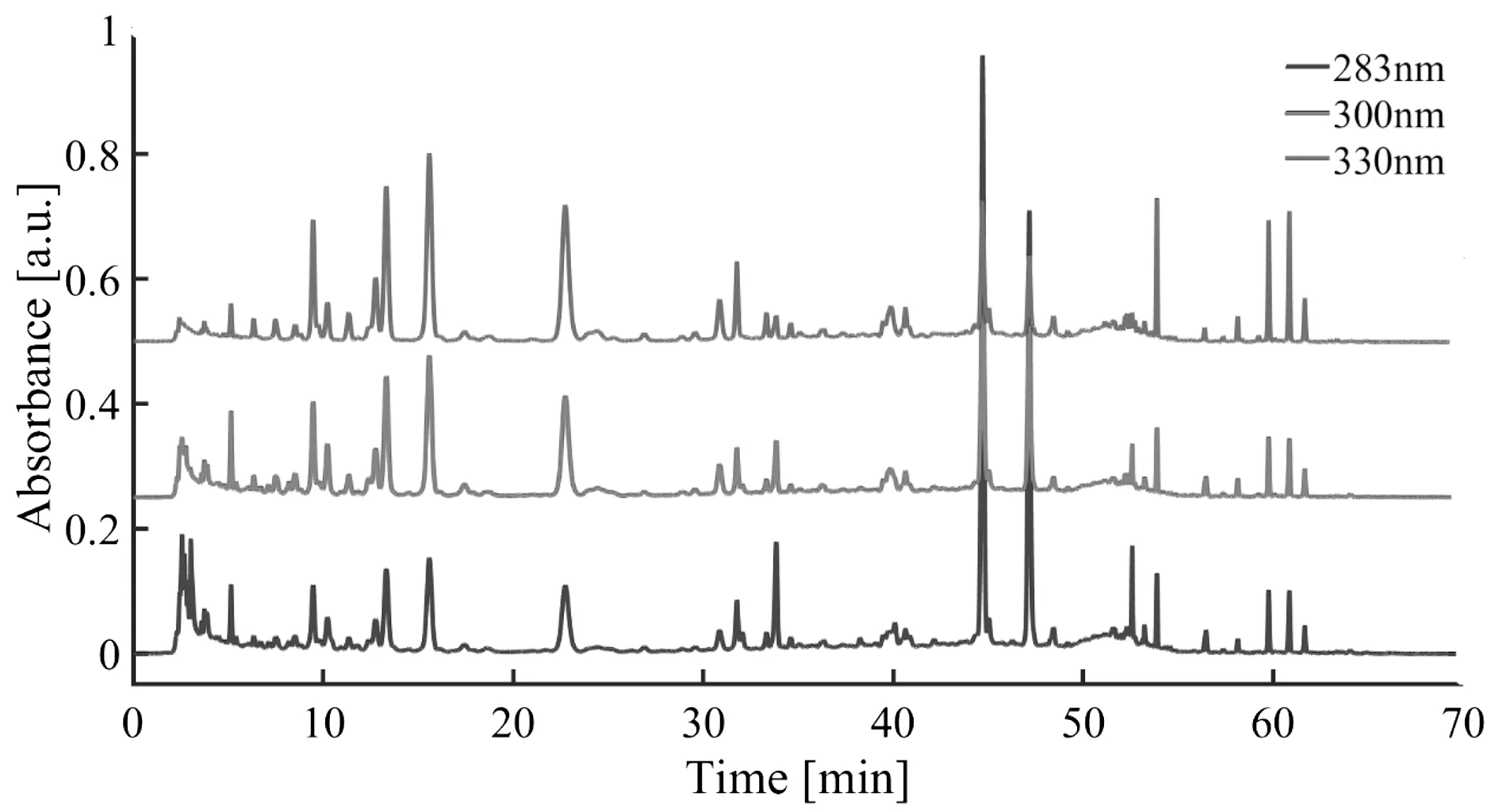
图2 检测波长的选择Fig.2 Selection of detection wavelength
实验结果表明,波长为300 nm下色谱峰峰形较好,分离效果佳,基线平稳,满足要求,故波长300 nm为进样分析的最佳波长。
2.4 洗脱程序的选择
以乙腈(B)-0.1%甲酸水(A)作为流动相,以条件1为初始洗脱比例,并在此基础上进行比例调整,所得色谱图见图3。

图3 洗脱条件的选择Fig.3 Selection of elution conditions
条件1:0~20 min 90%(A)、20~35 min 90%~75%(A)、35~50 min 75%~30%(A)、50~60 min 30%~90%(A)。
条件2:0~20 min 90%(A)、20~45 min 90%~75%(A)、45~65 min 75%~40%(A)、65~75min 40%~90%(A)。
条件3:0~20 min 90%(A)、20~50 min 90%~77% (A)、50~52 min 77%(A)、52~95 min 77%~40%(A)、95~100 min 40%~90% (A)。
条件4:0~20 min 90%(A)、20~50 min 90%~76%(A)、50~51 min 76% (A)、51~90 min 76%~42%(A)、90~95 min 42%~90%(A)。
条件5:0~20 min 90%(A)、20~49 min 90%~75%(A)、49~55 min 75%~70%(A)、55~90 min 70%~42%(A)、90~95 min 42%~90%(A)。
条件6:0~10 min 90%(A)、10~50 min 90%~78%(A)、50~60 min 78%~72%(A)、60~95 min 72%~42%(A)、95~100 min 42%~90%(A)。
以上色谱图相比较,条件6的目标峰更加清晰,峰型好,分离效果佳,无拖尾现象,基线平稳,故选该条件为最佳洗脱条件。
2.5 柱温和流速的选择
按已经确定的色谱柱及流动相系统对柱温(30℃、35℃和40℃)和流速(0.7、1.0和1.3 mL/min)进行考察,结果显示,0.7 mL/min流速下色谱峰出峰较慢,分析时间较长,1.3 mL/min 流速下部分色谱峰分离效果较差。比较不同柱温下图谱发现,30℃时,色谱峰分离度较好,柱温升高到35℃与40℃时,色谱峰分离度不佳,最终确定柱温为30℃,流速为1.0 mL/min。
2.6 色谱条件的确定
综上所述,最佳色谱条件为:色谱柱采用Venusil XBP C18(L)(5μm,4.6×250 mm);流动相:乙腈(B)-0.1%甲酸水(A);洗脱条件:0~10 min 90%(A)、10~50 min 90%~78%(A)、50~60 min 78%~72%(A)、60~95 min 72%~42%(A)、95~100 min 42%~90%(A);检测波长:300 nm;柱温:30℃;流速:1.0 mL/min。所得结果见图4。
2.7 方法学考察结果
2.7.1 精密度试验
取同一批陈皮,按“2.1”项下的方法制备供试品溶液,精密吸取供试品溶液20 μL,连续进样6次,记录HPLC图谱。结果可知,在6次进样中,相对保留时间RSD均小于3.0%,相对峰面积RSD均小于3.0%,表明仪器精密度良好。

注:1:维采宁-2;2:芸香柚皮苷;3:橙皮苷;4:橙皮素;5:甜橙黄酮;6:异甜橙黄酮;7:川陈皮素;8:3,5,6,7,8,3′,4′-七甲氧基黄酮;9:橘皮素;10:5-去甲川陈皮素图4 陈皮水煎液100min色谱图Fig.4 100min chromatogram of water decoction of Citri Reticulatae Pericarpium
2.7.2 稳定性试验取
取同一批陈皮,按“2.1”项下的方法制备供试品溶液,分别在室温下放置0、4、8、12、16、24 h进样,测定其HPLC指纹图谱。提取6张图谱的共有模式谱图,计算各图谱与共有模式图谱之间的相似度。结果显示,各共有峰相对保留时间RSD均小于2.0%,相对峰面积RSD均小于3.0%,表明供试品溶液在24 h内非常稳定。
2.7.3 重复性试验
取同一批陈皮,按“2.1”项下方法制备6份供试品溶液,分别测定其HPLC指纹图谱。提取6张图谱的共有模式谱图,计算各图谱与共有模式图谱之间的相似度。结果显示,各相对保留时间RSD均小于1.0%,相对峰面积RSD均小于2.0%,表明该方法重复性良好。
3 讨论
陈皮所含成分相对复杂,而对陈皮的鉴别与含量测定不仅可以检测橙皮苷,还可以利用中药指纹图谱对陈皮进行更加全面的检验,这样更能有效地控制陈皮质量[11]。但关于陈皮指纹图谱的文献和研究较少,检验方法也不够精炼和完善,需要展开更深层次的研究,故筛选试样处理方法,优化色谱分析条件为陈皮HPLC指纹图谱的建立奠定基础。陈皮的主要化学成分包括黄酮、生物碱、挥发油等,选择良好的色谱条件是建立指纹图谱的关键。考察不同萃取条件和多种洗脱程序的梯度洗脱能力,优化了检测波长、柱温和流速等分析条件,建立的HPLC方法具有良好的精密度、稳定性和重复性,符合中药指纹图谱的技术要求。
综上所述,最佳色谱条件为:色谱柱:采用Venusil XBP C18(L)(5 μm,4.6×250 mm);流动相:乙腈(B)-0.1%甲酸水(A);洗脱条件:0~10 min 90%(A)、10~50 min 90%~78%(A)、50~60 min 78%~72%(A)、60~95 min 72%~42%(A)、95~100 min 42%~90%(A);检测波长:300 nm;柱温:30℃;流速:1.0 mL/min。筛选出了最优的色谱条件,为有效控制陈皮内在质量及后续研究提供科学参考依据。

