排脓散汤剂和散剂中有效成分生物利用度的比较研究
李嘉诚,张孟孟,芮雪琳,杨 晔,2,徐 莉,江倩倩,尹登科,2,3
(1. 安徽中医药大学药学院,安徽 合肥 230012;2. 新安医学教育部重点实验室,安徽 合肥 230012;3. 现代中药研究与开发安徽省重点实验室,安徽 合肥 230012)
中药散剂是传统剂型之一,具有药材用量少、成本低、制备简单等特点。历代医家在使用中药散剂过程中积累了大量经验,明确指出“宜散不宜汤”的一些方药,如玉屏风散、五苓散、逍遥散。排脓散出自《金匮要略》,由枳实、白芍、桔梗3味中药组成,三者比为5∶5∶2,以散剂形式给药,主治疖、痈、疔、淋巴结炎和直肠溃疡等炎症疾病,临床上疗效确切。目前在实验研究中多采用排脓散汤剂(水提物)给药形式,临床多采用散剂的给药形式,两者的有效成分生物利用度的差异尚不清楚。散剂是原始的剂型,存在药材不宜辨认、服药口感差、药材粉末表面积大、药材挥发性成分易散失等问题,在临床上应用逐步减少。宜散不宜汤的科学内涵也没有得到完全的阐释,王建农等对同方汤剂和散剂差异的物质基础进行了研究,阐明了同方汤剂脂溶性成分丢失是宜散方的主要原因,指出散剂具有不可替代的临床功效。排脓散主要有效成分有芍药苷、柚皮苷、橙皮苷、新橙皮苷等。本研究选择这4种成分作为排脓散的指标性成分,建立分析方法对排脓散同方汤剂和散剂进行药物代谢动力学比较研究,为排脓散剂型选择提供参考。
1 材料
1.1 药物与试剂 橙皮苷对照品(批号 DST190716-038,色谱纯)、新橙皮苷对照品(批号 DST190929-039,色谱纯)、柚皮苷对照品(批号 DST191011-099,色谱纯)、芍药苷对照品(批号 DST190303-070,色谱纯):乐美天医药有限公司;内标栀子苷(批号 BWB50533):北京北方伟业计量研究院;枳实(批号 200601)、芍药(批号 200320)、桔梗(批号 200312):安徽广河中药有限公司,均经安徽中医药大学刘守金教授鉴定为正品。甲醇、乙腈:美国Thermo Scientific;乙酸乙酯:中国上海市国药集团化学试剂有限公司。
1.2 主要仪器 三重四级杆串联线性离子阱质谱仪(AB SCIEX QTrap 5500):美国AB SCIEX;超高效液相色谱(ultra performance liquid chromatography,UPLC)仪(Thermo Scientific Ultimate 3000 RS ):美国Thermo Scientific;十万分之一分析天平(EX125DZH):美国OHAUS;高速冷冻离心机(5300XR):德国Eppendorf。超纯水净化系统(Mili-Q):美国Millipore。
1.3 实验动物 雄性SPF级健康SD大鼠,体质量(200±20)g,由安徽医科大学动物实验中心[实验动物生产许可证号:SCXK(皖)2017-0001]提供。实验前适应性饲养1周,期间大鼠可以自由获得食物和水,饲养环境温度为24~26 ℃,湿度为60%~70%。大鼠给药前需禁食12 h,饮水自由。
2 方法与结果
2.1 排脓散汤剂与散剂的制备方法 ①排脓散汤剂制备:分别取枳实50 g、白芍50 g、桔梗20 g,加10倍量水,加热回流提取2次,每次40 min,过滤,分离滤渣滤液抽滤,合并水提液,浓缩,使生药质量浓度至3.2 g/mL。4 ℃条件下保存,备用。②排脓散散剂制备:分别取枳实、白芍、桔梗,用打粉机粉碎,过100目筛,称量枳实1.33 g、白芍1.33 g、桔梗0.53 g,混匀,给药前用生理饮水混悬,使生药质量浓度至3.2 g/mL。
2.2 排脓散体外含量测定
2.2.1 UPLC条件 色谱柱:Themo Scientific Syncronis C(100 mm×2.1 mm,1.7 μm);流动相:甲醇(A)和水(B);柱温:35 ℃;进样量:2 μL。梯度洗脱:0~3 min,80% B;3~4 min,65% B;4~9 min,65% B;9~13 min,50% B;13~14 min,25% B;14~17.5 min,25% B;17.5~17.6 min,80% B;17.6~22 min,80% B。
2.2.2 样品前处理方法 按“2.1”项制备排脓散汤剂样品,稀释至0.16 g/mL,过0.45 μm滤膜,备用。散剂样品用10 mL甲醇(70%)超声提取30 min,20 ℃下5 000 r/min离心,取上清液,稀释20倍,过0.45 μm滤膜,备用。配制芍药苷、橙皮苷、柚皮苷与新橙皮苷混合标准品的浓度,其中芍药苷浓度为0.006、0.015、0.03、0.06、0.15 mg/mL,橙皮苷浓度为0.008、0.02、0.04、0.08、0.2 mg/mL,柚皮苷浓度为0.04、0.1、0.2、0.5、1 mg/mL,新橙皮苷浓度为0.084、0.21、0.42、0.84、2.1 mg/mL。
2.2.3 排脓散同方汤剂和散剂有效成分含量 排脓散散剂中,芍药苷(0.52±0.06)mg/g,柚皮苷(1.31±0.07)mg/g,橙皮苷(0.22±0.04)mg/g,新橙皮苷(1.36±0.12)mg/g。排脓散汤剂中,芍药苷(0.46±0.08)mg/g,柚皮苷(1.21±0.08)mg/g,橙皮苷(0.16±0.06)mg/g,新橙皮苷(1.49±0.14)mg/g。排脓散散剂和汤剂各成分含量比较,差异均无统计学意义(独立样本t
检验,n
=3,P
>0.
05)。2.3 UPLC-MS/MS条件
2.3.1 色谱条件 色谱柱:Themo Scientific Syncronis C(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A)和水(B);柱温:35 ℃。梯度洗脱:0~1 min,75% B;1~2 min,75%~60% B;2~3 min,60% B;3~4 min,45% B;4~6 min,45%~75% B;6~8 min,75% B。运行时间12 min,流速0.3 mL/min,进样量2 μL。
2.3.2 质谱条件 待测成分质谱分析使用美国AB SCIEX公司Qtrap 5500三重四极杆串联线性离子阱液质联用仪,以ESI作为电离源,在负离子模式下MRM模式对待测成分进行分析。ESI为4 500 V,温度500 ℃。气帘气压241.3 kPa,雾化气压344.7 kPa,干燥气压344.7 kPa。待测成分质谱条件见表1。
将一定浓度的单一分析物加入UPLC-MS/MS系统,采用全扫描的模式确定组分的正负离子,以ESI作为电离源获得目标组分的前体离子,然后在产物离子扫描模式下优化碰撞能,得到目标物的二级质谱特征离子图,最后在MRM模式下进一步优化碰撞电压和去簇电压。为了降低基线、背景噪音,提高分离效果和响应值,质谱分析采用MRM模式进行定量。物质一级与二级质谱特征见图1、图2,优化的质谱参数见表1。
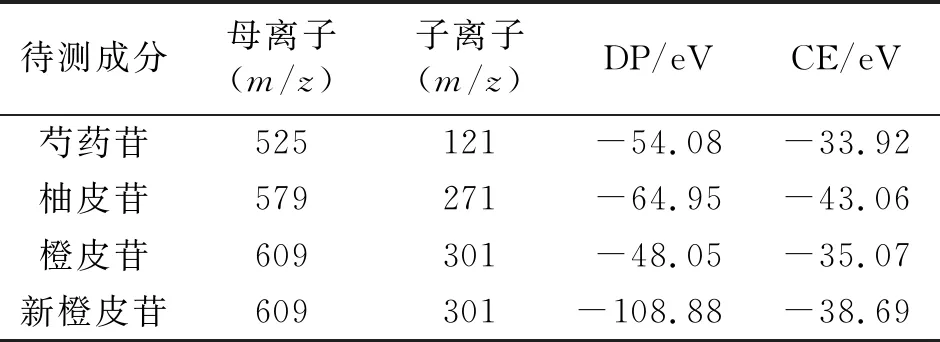
表1 内标物与各待测成分的质谱条件

图1 排脓散中芍药苷(A)、柚皮苷(B)、橙皮苷(C)和新橙皮苷(D)的一级质谱图

图2 排脓散中芍药苷(A)、柚皮苷(B)、橙皮苷(C)和新橙皮苷(D)的二级质谱图
2.4 对照品和储备液的配制 精密称取芍药苷、橙皮苷、新橙皮苷、柚皮苷各10 mg,分别加入1 mL纯甲醇,超声溶解,即得质量浓度为10 mg/mL各成分对照品储备溶液;并取适量各标准品溶液,混合稀释为各成分浓度为250 μg/mL,作为混合对照品储备液。精密称量栀子苷对照品10 mg,加入1 mL甲醇超声溶解,取适量栀子苷对照品溶液,以甲醇稀释成10 μg/mL的内标溶液。
2.5 血浆样品的采集 将18只雄性SPF级SD大鼠[体质量(200±20)g]随机分为空白组、排脓散散剂组、排脓散汤剂组,每组6只,禁食12 h,期间自由饮水。排脓散散剂组灌胃给予3.2 g/mL排脓散混悬液,排脓散汤剂组灌胃给予3.2 g/mL排脓散水提液,给药后分别于3、5、10、20、40、60、90 min,2、4、8、12、24、36、48 h用毛细管从大鼠眼眶取血250 μL,置于肝素钠采血管中,4 ℃下5 000 r/min离心10 min,将上层血清移入1.5 mL离心管内,-20 ℃条件下保存,等待进行样品前处理。
2.6 血浆样品前处理 大鼠血浆样品在室温下解冻后,取100 μL血浆,加入1 000 μL乙酸乙酯,加入5 μL内标溶液,混合溶液涡旋10 min。涡旋后样品放入高速冷冻离心机中,4 ℃下12 000 r/min离心15 min。将上清液移入1.5 mL离心管中,室温过夜,晾干。再加入100 μL甲醇制成100 μL混合溶液,涡旋5 min后,放入高速冷冻离心机中,4 ℃下12 000 r/min离心15 min,取上清液50 μL,待测。
2.7 方法学考察
2.7.1 专属性 分别精密吸取100 μL空白血浆,加入芍药苷、柚皮苷、橙皮苷、新橙皮苷标准品溶液100 μL;以及给药后采集的血样,均按照“2.6”项中血浆样品前处理方法处理后,按前述UPLC-MS/MS条件进样,记录所得色谱图。各成分峰与内标峰的峰型良好,而且血浆的内源性物质不影响待测成分与内标物的测定,基线平稳,且专属性良好。
2.7.2 线性范围 精密吸取大鼠空白血浆100 μL,共9份,依次加入10 μL混合对照品溶液,其中各成分含量均为0.002、0.01、0.02、0.1、0.2、0.5、1、2、5 μg/mL。结果排脓散各主要成分的线性方程如下:
芍药苷:A
=0.
003 83ρ
+0.
031 31(r
=0.
993 22);柚皮苷:A
=0.
115 61ρ
+0.
371 14(r
=0.
997 00);橙皮苷:A
=0.
100 59ρ
+0.
083 17(r
=0.
990 80);新橙皮苷:A
=0.
115 65ρ
+1.
588 69(r
=0.
992 29)。结果显示,各待测成分含量在0.2~500 ng/mL范围内与峰面积的线性关系良好。
2.7.3 精密度、提取回收率与基质效应 分别取6份100 μL空白血浆,按照各个成分的低浓度质控样品、中浓度质控样品、高浓度质控样品的浓度要求配制质控样品,并按照“2.6”项下方法处理血浆样品,依照测量结果计算RSD值。
采用100 μL空白血浆,制备3个不同浓度的质控样品,血浆样品按照“2.6”项方法进行样品前处理,分别配制3组样品。①将空白血浆中加入4种成分的3个不同浓度的质控样品,进行样品前处理;②对空白血浆进行样品前处理后,加入4种成分的3个不同浓度的质控样品;③复溶溶剂直接溶解的4种成分的3个不同浓度的质控样品。每个样品平行制备6份,经分析检测后计算各个成分的基质效应和提取回收率。
实验结果表明,该方法精密度较好,RSD<13%,说明该方法准确、可靠、重现性较好。由实验结果可知,该方法提取回收率与基质效应均符合生物样品分析方法的要求。见表2。

表2 待测成分的精密度、提取回收率
2.7.4 稳定性考察 将质控血浆样品在室温下储存24 h后,评价其室温稳定性;在4 ℃条件下评价其短期稳定性;在-20 ℃条件下反复冻融3次,评价其冻融稳定性。实验结果表明,0.2、10、500 ng/mL各待测成分的短期稳定性、室温稳定性、冻融稳定性均良好,满足生物样品分析条件。
2.7.5 数据处理分析 采用DAS 2.0软件分析血药浓度-时间数据,采用SPSS 23.0软件对药物代谢动力学参数进行秩和检验。
2.8 药物代谢动力学参数测定 4种成分的血药浓度-时间曲线见图3,药物代谢动力学参数见表3。4种待测成分的拟合曲线评级符合二室模型评价。结果表明,排脓散散剂中橙皮苷的曲线下面积(area under curve, AUC)显著高于排脓散汤剂。而排脓散散剂中芍药苷、柚皮苷、新橙皮苷的AUC与汤剂比较,差异无统计学意义(P
>0.
05)。
图3 排脓散散剂和汤剂中芍药苷(A)、柚皮苷(B)、橙皮苷(C)和新橙皮苷(D)在大鼠体内的血药浓度-时间曲线
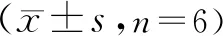
表3 排脓散汤剂和散剂有效成分的药物代谢动力学参数
3 讨论
排脓散的散剂与汤剂中芍药苷、柚皮苷、橙皮苷和新橙皮苷的含量差异无统计学意义。而药物代谢动力学实验结果表明,排脓散散剂中橙皮苷的AUC较汤剂更高,说明排脓散的散剂有助于橙皮苷的吸收。研究证实,橙皮苷因其低溶解性,难以透过肠上皮细胞,肠胃对其吸收主要依靠细胞旁路途径实现。散剂颗粒粘附于胃肠道,释放橙皮苷的剂量与接触时间均大于汤剂,因此可导致排脓散散剂在大鼠体内的生物利用度高于同方汤剂。
同时,排脓散汤剂和散剂中芍药苷、柚皮苷和新橙皮苷的AUC差异无统计学意义,其原因可能是这3种成分的水溶性相对较好。汤剂中药物含量不低于散剂。刘洋等实验结果显示,芍药苷主要在空肠部位吸收,柚皮苷和新橙皮苷主要在十二指肠部位吸收。因此,散剂与汤剂对比,柚皮苷与新橙皮苷的AUC差异无统计学意义。散剂的达峰浓度较高的主要原因可能是中药颗粒粘附于十二指肠肠壁释药,而汤剂中芍药苷的达峰浓度高于散剂,但是其平均滞留时间小于散剂,尽管差异无统计学意义,仍可说明散剂相对于汤剂具有一定的缓释特性。
散剂作为一种传统的速效剂型,对于水溶性很好的成分,可实现快速释药;而对于水溶性稍差的成分,可以提高其生物利用度。橙皮苷具有广泛的药理活性,如抗炎、保护肠上皮、调节肠道菌群等作用。本研究结果可为排脓散剂型的选择提供实验依据。

