适配体调控高SERS活性金纳米检测多菌灵
陈海霞,罗杨合,庞永丰,聂辉,黄双全,黎小椿
(贺州学院食品与生物工程学院,广西 贺州 542899)
多菌灵是常用的苯并咪唑类杀菌剂,其通过种子、根、叶吸收后在作物体内传导,起到治疗和保护作用,残留时效长。由于人们过量使用多菌灵,使得农产品及其加工品受到污染,对人畜安全健康带来负面影响,甚至导致环境污染。因此,建立稳定性好、灵敏度高的蔬菜中多菌灵快检方法对保障蔬菜质量安全尤为重要。
近年来,蔬菜农残多菌灵快速检测常用的方法有高效液相色谱法[1]、液相色谱串联质谱法[2]、近红外光谱法[3]、紫外吸收光谱法[4]、荧光法[5]、表面增强拉曼光谱法[6-7]。高效液相色谱法、液相色谱串联质谱法样品处理复杂,操作繁琐;近红外光谱法和紫外吸收光谱法易受干扰、检测限低。与红外、荧光等其它光谱手段相比,表面增强拉曼光谱法的优点在于可用红外光激发、受生物样品自身荧光干扰更小、不受水干扰以及不易猝灭,它的检测范围更宽、灵敏度更高、提供更多信息等优点,是一种非常好的蔬菜农残快速检测方法。
表面增强拉曼散射(surface-enhanced raman scattering,SERS)光谱是一种非破坏性、灵敏度高、选择性好的拉曼光谱分析技术。SERS效应是在激发区域内,由于样品分子吸附在一定程度粗糙表面上,使表面或近表面的电磁场的增强,导致拉曼散射信号极大增强(约106~1010)。SERS技术操作简便,选择好,不需要进行复杂的样品前处理,适用于现场快速检测。它还克服了拉曼光谱精确度低、信号弱、背景干扰强的缺点,可以获取到常规拉曼光谱难易得到的结构信息,可以有效分析化合物在界面的吸附取向、吸附态的变化、界面信息等优势,已被广泛应用于检测农药残留[8]、痕量重金属等[9]。Shende等[10]采用SERS法检测水果中的农药残留,检测限达10-6mol/L。Vongsvivut等[11]制备金-银金纳米溶胶作SERS基底检测地虫磷农药残留,检出限为10mg/mL。Tang等[12]以银纳米粒子作为基底,通过SERS技术测定三环唑和百草枯和氟硅混合农药,三环唑的检出限为0.01mg/L,百草枯的检出限为0.1mg/L,氟硅唑的检出限为2.85 mg/L。但是,SERS活性基底的制备和方法的选择性还有很多问题需要解决。因此,制备稳定性、重现性较好的SERS基底,建立快速、准确、灵敏、稳定的蔬菜农残SERS定量分析方法具有重要研究意义。
金纳米(gold nanoparticles,AuNPs)是一种能与其它生物大分子结合且不影响其生物活性的纳米材料。AuNPs可与氨基非共价键吸附,也能与巯基共价结合,因此它可以和多种生物传感器相互结合,形成稳定性好的纳米复合探针,可以识别多种靶目标,提高检测的灵敏性。倪璇等[13]通过利用柠檬酸三钠的还原性还原氯金酸制备AuNPs,建立了一种比色适配体传感器检测水溶液中的多菌灵的新方法,该比色法的检测限低至2.3nmol/L,线性检测范围为2.3 nmol/L~800 nmol/L。陈雨等[14]使用SERS技术研究DNA-AuNPs组装体对γ射线的辐射响应性质,以及金纳米粒子的局域增强效应对组装体γ射线响应的影响。蒋巧艳等[15]利用AuNPs、MoS2和钛合金箔为材料构建表面增强基底物用于敌草快(diguat dibromide,DQ)的检测,建立了一个新颖、灵敏的SERS检测DQ方法,结果显示该方法的检出限为10-13mol/L,比现有报道的DQ检测方法的检出限(10-12mol/L)低。但是,不同直径的纳米金有不同的性质,因此,制备合适的纳米金尤为重要。
适配体(aptamer,Apt)是通过指数富集系统(systematic evolution of ligands by exponential enrichment,SELEX)技术从体外随机单链DNA或RNA序列库中筛选出来的能与靶物质产生类似于抗原-抗体高特异性结合的寡核苷酸链。随着生物技术的发展,自1990年Ellington首次提出适配体概念后,基于其亲和力及与靶物质特异性结合能力,作为灵敏检测农药残留的新方法得到了快速发展。李凤球等[16]提到被筛选出来并应用于实际农残检测的适配体很少,迄今为止还不足20种。聂永惠[17]以纳米金溶胶为SERS活性基底,基于适配体与马拉硫磷特异结合的能力,建立了一种简单且针对马拉硫磷的特异检测的SERS的快速无损检测方法,该法在 5×10-7mol/L~1×10-5mol/L 范围内具有良好线性关系,相关系数值R2=0.992 0。胡薇薇[18]以结晶紫为探针,在啶虫脒存在时,核酸适配体能与其发生特异性结合并不再吸附到结晶紫-金纳米离子表面而使SERS信号降低的规律,构建表面增强拉曼纳米生物传感器对茶叶中啶虫脒进行定量检测,检出限为0.72 nmol/L。Zourob等[19]利用SELEX技术在10轮筛选后,成功筛选出高适应性和特异性的多菌灵DNA适配体。将该适配体经过硫醇修饰在金电极上自组装构建电化学适体传感器对多菌灵进行检测。由于适配体只有在一定条件下才能与其靶物质发生特异结合,且同一适配体不能与多种靶物质发生特异反应,因此需要根据实际测定的目标物选择适宜的适配体。
目前,基于适配体的比色传感检测多菌灵的方法已经建立,但是未见基于适配体与纳米结合,建立SERS法检测多菌灵的相关报道。因此,本文利用适配体的高亲和力及特异结合性能,建立稳定性高、选择性好、快速检测多菌灵的SERS分析方法。
1 材料与方法
1.1 试剂与仪器
试验用水均为超纯水(电阻:18.25 MΩ·cm)。所用玻璃器皿均用王水浸泡,超纯水清洗。
1.1.1 仪器
633 nmDXRsmart激光拉曼光谱仪:美国Thermo公司;MR-Hei-Tec加热型磁力搅拌器:德国Heidolph公司;Evolution 300紫外可见光分光光度计:广西金鑫进出口有限公司;F-4600荧光分光光度计:广西思远仪器设备有限公司;ULUP-II-40L优普系列超纯水器:四川优普超纯科技有限公司;FA2004N分析天平:上海菁海有限公司;H 1650台式高速离心机:湖南湘仪实验室仪器开发有限公司。
1.1.2 试剂
氯金酸(AR):国药集团化学试剂有限公司;柠檬酸三钠(AR)、碳酸氢钠(AR)、氯化锌(AR):成都市科龙化工试剂厂;氯化钠(AR):广州化学试剂厂;维多利亚蓝B(AR):汇普化工有限公司;多菌灵适配体;生工生物工程(上海)股份有限公司;甲醇中多菌灵(100μg/mL)、丙酮中毒死蜱(100μg/mL)、丙酮中莠去津(100 μg/mL)、乙醇中吡虫啉(1 000 μg/mL):北京坛墨质检科技有限公司;氯化钡(AR)、硫酸钾(AR)、丙酮(AR)、乙醇(95%):西陇科学股份有限公司;甲醇(AR):广东光华科技股份有限公司。
1.1.3 试验试剂的配制
1%氯金酸(HAuCl4)溶液:将1 g氯金酸在烧杯中用超纯水溶解,于100 mL棕色容量瓶定容,4℃冰箱贮藏。
1%柠檬酸三钠溶液:称量1 g柠檬酸三钠,放入小烧杯中,用超纯水溶解,于100 mL棕色容量瓶定容至刻度,常温贮藏即可。
1 mol/L NaCl溶液:称量5.58 g NaCl在烧杯中用超纯水溶解,于100 mL容量瓶定容,常温贮藏。
1×10-5mol/L维多利亚蓝B溶液(victoria blue B,VBB):称量0.506 g维多利亚蓝B在烧杯中溶解,100 mL棕色容量瓶定容,得到1×10-3mol/L VBB溶液,再逐级稀释成1×10-5mol/L,4℃冰箱贮藏。
多菌灵标准液(carbendazim,CBZ):量取1 mL 100 μg/mL(100 mg/L)的甲醇中多菌灵标准液,放入10 mL容量瓶中,定容至刻度,得到10 mg/L的多菌灵溶液,4℃冰箱冷藏备用。
多菌灵适配体溶液:将含有18 μmol/L适配体的离心管离心(10 000 r/min)1 min,加入 100 μL 超纯水继续离心1 min,逐级稀释成0.18 μmol/L适配体溶液,4℃冰箱冷藏备用。
毒死蜱溶液、莠去津溶液、吡虫啉溶液:直接用移液枪量取购买的原液即可。
氯化钡溶液、硫酸钾溶液、丙酮溶液、乙醇溶液、甲醇溶液、碳酸氢钠溶液、氯化锌溶液:准确称量并配制1 mol/L即可。
1.2 试验方法
1.2.1 AuNPs的制备
取120 mL超纯水在搅拌的条件下(660 r/min)加热至沸腾,然后依次加入7 mL 1%柠檬酸三钠溶液和1 mL 1% HAuCl4溶液,继续搅拌加热20 min,颜色变化为:无色→浅紫色→紫色→紫红色→酒红色。停止加热,继续搅拌至室温(25℃)。然后移入100mL棕色容量瓶,定容,得到AuNPs溶液浓度为47.8 μg/mL,放4℃冰箱备用。
1.2.2 CBZ检测方法
用移液枪量取6.00 mmol/L AuNPs溶胶于5 mL的小试管中,加入27.00 nmol/L的多菌灵适配体混合均匀,静置5 min后加入0~1040 nmol/L的多菌灵、5.00 mmol/L NaCl和0.25 mmol/L VBB,然后定容到2 mL,将反应液放入比色皿中,测定1 618 cm-1处的SERS峰强度I,I0是不加CBZ的空白试验组,计算ΔI=I0-I。每个试验组均进行3次平行测定。
2 结果与分析
2.1 体系检测原理
用柠檬酸三钠还原HAuCl4溶液制备出酒红色的AuNPs为基底,以VBB为探针分子,当体系不存在多菌灵时,AuNPs被适配体包裹,以VBB与AuNPs的基础面积减少,体系在1 618 cm-1处SERS信号强度下降。加入多菌灵后,多菌灵与适配体特异性结合形成稳定的复合物,裸露在溶液中的AuNPs与VBB接触面增大,体系在1 618 cm-1SERS信号强度上升,据此建立多菌灵的SERS检测体系(如图1)。
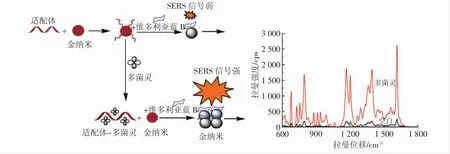
图1 检测原理图Fig.1 Detection schematic diagram
2.2 透射电镜表征高活性AuNPs
通过透射电镜(TEM)扫描酒红色的AuNPs溶胶(见图2),结果(见图3)表明所制备的AuNPs形状是球形的,其平均直径是20 nm。球形金纳米比表面积较高、稳定性好。

图2 AuNPs溶胶Fig.2 AuNPs sol

图3 AuNPs透射电镜图Fig.3 Transmission electron microscopy of AuNPs
2.3 多菌灵-适配体-AuNPs体系SERS光谱
多菌灵-适配体-AuNPs体系SERS光谱见图4。

图4 多菌灵-适配体-AuNPs体系SESR光谱Fig.4 SERS spectra of CBZ-Apt-AuNPs system
当体系没有多菌灵时,由于AuNPs被适配体包裹,在1 618 cm-1处出现较弱的SERS特征峰。当加入多菌灵后,多菌灵与适配体特异性结合成稳定的复合物,AuNPs被释放,与VBB接触面增大,在1 618 cm-1处有较强的SERS特征峰,随着多菌灵浓度的增加,1 618 cm-1处的SERS特征峰呈线性关系。
2.4 紫外—可见光吸收光谱
AuNPs紫外—可见光吸收光谱见图5。

图5 AuNPs紫外-可见光吸收光谱Fig.5 UV-Vis absorption spectrum of AuNP
由图5a曲线可以得出AuNPs溶胶紫外吸收峰范围在520 nm~530 nm之间,纳米为球形纳米,与电镜图相符。图5b为多菌灵-多菌灵适配体-AuNPs体系结合的结果。加入多菌灵后,多菌灵-适配体-AuNPs复合体增加,NaCl聚集作用减弱从而减少淡蓝色聚集体,体系呈红色,故在520 nm~530 nm范围的吸收峰增强,与SERS光谱一致。
2.5 共振瑞利散射(RRS)光谱
AuNPs RRS光谱见图6。
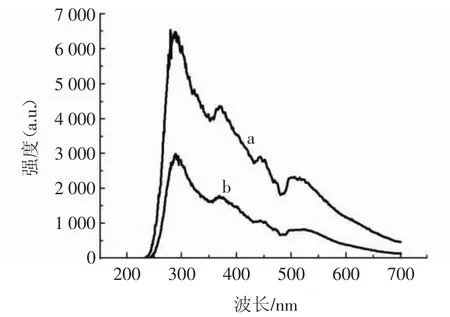
图6 AuNPs RRS光谱Fig.6 RRS spectrum of AuNPs
在图6a曲线可以看到AuNPs溶胶在290、369、445、520 nm处都有RRS峰。随着多菌灵的加入(见图6b),多菌灵-适配体-AuNPs复合体增加,导致AuNPs这4个RRS峰峰值降低,与SERS光谱结果一致。
2.6 体系影响因素的优化
不同浓度下各因素对体系的影响见图7。

图7 不同浓度下各因素对体系的影响Fig.7 Effects on the system of various factors at different concentrations
分别对影响体系的AuNPs、NaCl、VBB及适配体等因素进行优化,由试验结果可知,当AuNPs、NaCl、VBB及适配体的浓度分别为 6.00、5.00、0.25、27.00 nmol/L时,体系的SERS信号最强,故最终选取AuNPs、NaCl、VBB及适配体的最佳浓度分别为 6.00、5.00、0.25、27.00 nmol/L以进行下一步试验。
2.7 干扰物质的影响
专一的适配体与特定靶物质会发生特异性结合,从而实现目标靶物质的检测。在优化好的检测体系中加入156 nmol/L的多菌灵后,分别加入10种常见的干扰物质对体系进行干扰试验。常见干扰物质对体系的影响见表1。
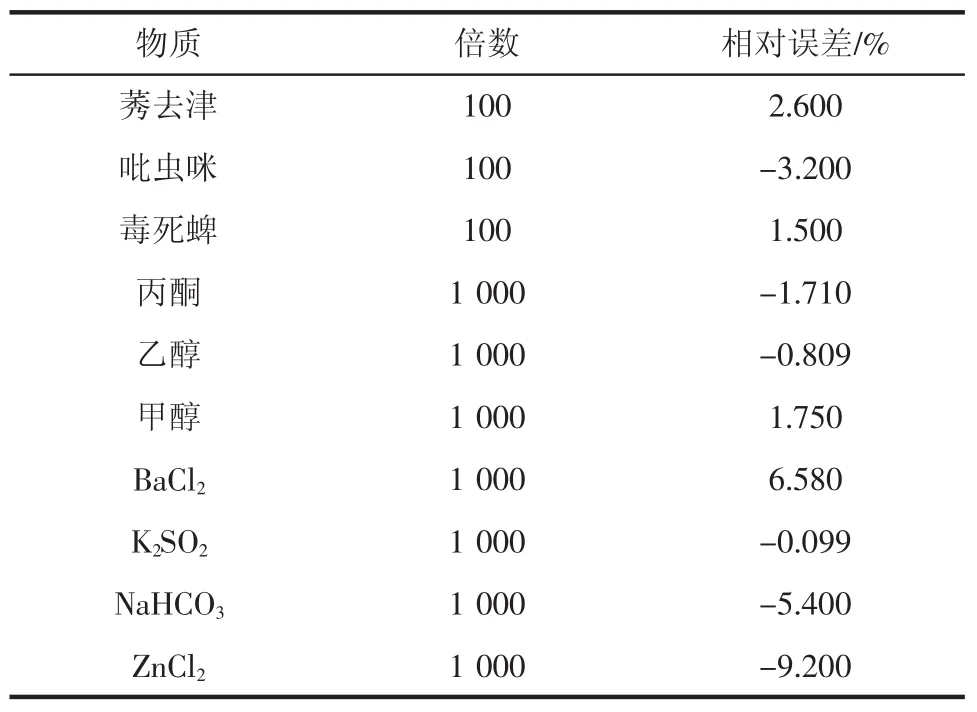
表1 常见干扰物质对体系的影响Table 1 Influence of common interfering substances on the system
由表1可知,1.75×105nmol/L的丙酮溶液、乙醇溶液、甲醇溶液、BaCl2溶液、K2SO2溶液、NaHCO3溶液及ZnCl2溶液不干扰测定,1.56×104nmol/L的莠去津溶液、吡虫咪溶液、毒死蜱溶液不干扰测定,说明该法具有较高的选择性。
2.8 工作曲线
为了研究这种用适配体包裹AuNPs从而进行定量检测多菌灵浓度的可行性,通过分析不同浓度下多菌灵的SERS信号强度变化趋势。将反应体系SERS信号强度对多菌灵浓度作图,得到拟合曲线。反应体系检测多菌灵的灵敏度分析见图8,反应体系检测多菌灵的工作拟合曲线见图9。
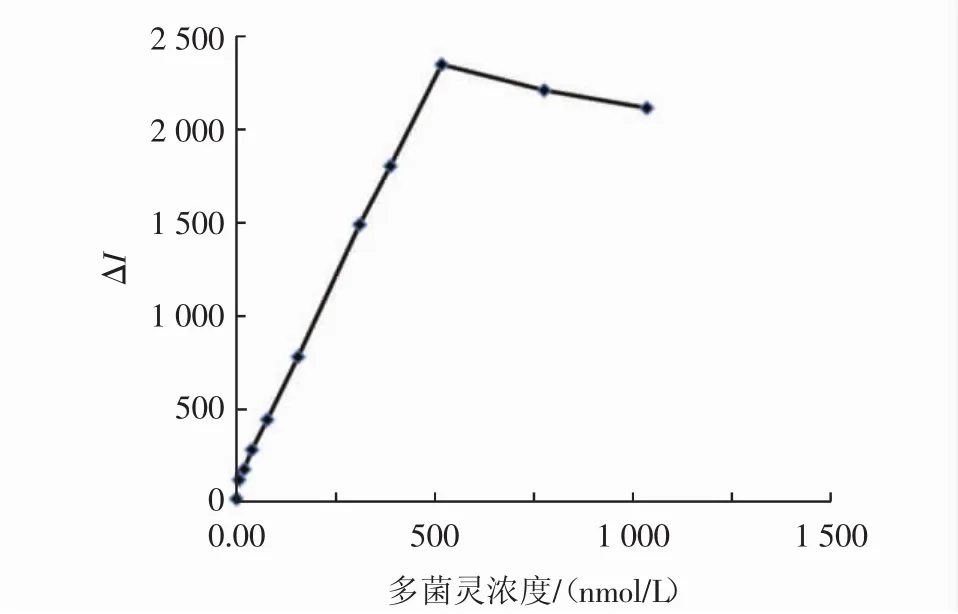
图8 反应体系检测多菌灵的灵敏度分析Fig.8 Sensitivity analysis of carbendazim in the reaction system

图9 反应体系检测多菌灵的工作拟合曲线Fig.9 Work fitting curve of carbendazim detection by reaction system
如图8所示,随着多菌灵浓度的增加,反应体系的SERS信号不断增强,在到达一定浓度(520nmol/L)后无上升趋势,甚至开始下降。如图9所示,在多菌灵较低浓度下(0~520 nmol/L),SERS信号强度的增值与多菌灵浓度的线性拟合曲线,其线性方程为y=4.4394x+67.523,相关系数R2=0.998 8,最低检出限为4.13 nmol/L,说明该法具有较好的灵敏性。
3 结论
通过利用柠檬酸三钠的还原性可快速制备酒红色球形金纳米 AuNPs,AuNPs在NaCl作用下发生聚集,以VBB为探针分子,体系在1 618 cm-1处表现出较强的SERS特征峰。当加入多菌灵适配体时,AuNPs被包裹,形成AuNPs适配体结合体,VBB与AuNPs接触面减少,1 618 cm-1处的SERS特征峰信号降低。当加入CBZ时,CBZ与适配体特异性结合形成稳定的复合物,从而使AuNPs被释放,体系SERS信号增强。随着CBZ浓度的增加,AuNPs被释放得越多,体系SERS峰信号越强。通过优化条件后,CBZ在6.5 nmol/L~520 nmol/L浓度范围内,其SERS信号强度变化值表现出良好的线性关系,y=4.4394x+67.523,线性范围R2=0.998 8。建立的方法灵敏度高、选择性好,有望运用于果蔬中农药残留的检测。

