大豆异黄酮的生物转化及功能活性研究进展
陈嘉序,陈如扬,连媛,姚欣硕,黄钰昕,高瑶,肖愈
(湖南农业大学食品科学技术学院,湖南 长沙 410128)
大豆异黄酮(soybean isoflavone)是一类重要的非固醇类功能活性物质,具有较好的抗癌作用、预防骨质疏松症及降低心血管疾病发病率等功能,现已被广泛运用于食品保健、饲料研发、医药制品等诸多领域。自1931年,Walz等首次从大豆中分离提取出大豆异黄酮——染料木素(genistein)以来[1],目前发现的大豆异黄酮已有12种,主要以结合型糖苷(glucoside)和游离型苷元(aglycone)2种形式存在,其中97%左右为以β-葡萄糖苷形式存在的糖苷及其衍生物。大豆异黄酮的生物活性与化学结构息息相关,游离型苷元在人体内吸收程度远高于结合型糖苷,并具有更高的类雌激素活性和抗氧化活性[2]。现阶段常通过酸解、酶解、物理辅助提取等方式提高大豆总异黄酮中糖苷向苷元转化的效率,但存在生产效率低,反应条件苛刻等诸多弊端,不适于大规模应用[3]。近年来,微生物发酵已广泛应用于糖苷型异黄酮向更利于吸收利用的各级异黄酮的生物转化中,如利用Actinomucor elegans、Rhizopus oligosporus和Bifidobacterium等食品发酵使用菌种以及Escherichia coli和Lactobacillus等肠道微生物群,研究对豆制品加工主要大豆异黄酮单体含量以及最终代谢产物生物活性的影响。此类微生物在发酵时能产生作用于糖苷型异黄酮7-位氧苷键的酶,游离型异黄酮含量显著增加[4-5],通过不同的代谢途径转化为诸多高活形式、无活性产物甚至潜在毒性物质[6]。本文拟就近年来有关实际生产使用的菌种及肠道菌群对大豆异黄酮单体的代谢转换作用以及其不同代谢产物生物活性功能的相关研究进行梳理,以期为深入研究大豆异黄酮的微生物转换及新型功能性食品的开发提供理论依据。
1 大豆异黄酮的代谢
大豆异黄酮通常以糖苷的形式存在于自然界中,由酚羟基和糖基缩合而成,其结构通式是以3-苯并吡喃酮为母核的化合物群(图1)。
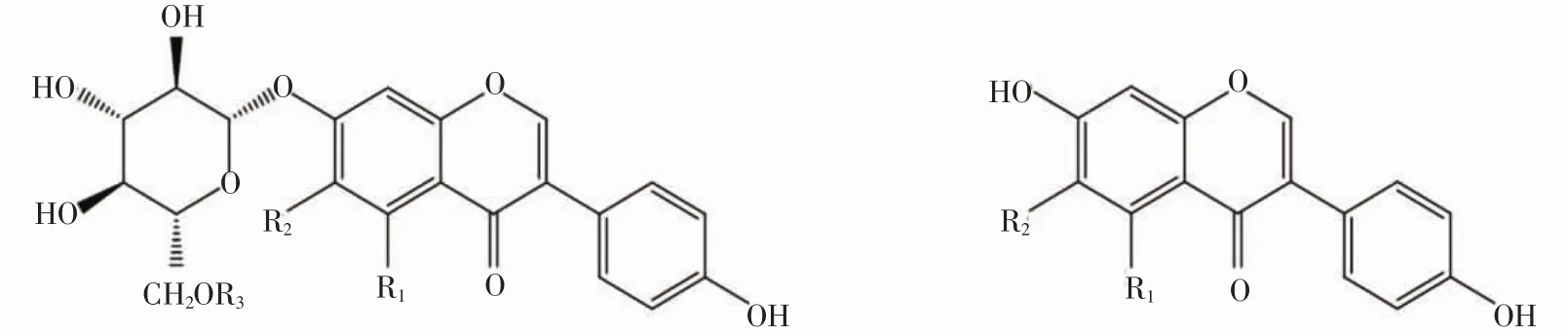
图1 结合型糖苷和游离型苷元的结构通式Fig.1 General formula of glycosides and aglycone
不论是在发酵食品基质还是肠道环境下发生的生物转化过程,大豆异黄酮转化的第一步都是糖苷型分解为苷元型。1995年,Matsuura等[7]在发酵豆制品中先检测到了β-葡萄糖苷酶-C的活性,同时分离纯化得到了酶蛋白,在体外发酵过程中验证了大豆异黄酮的转化首先是糖苷酶的作用。Hur等[8]从健康个体的粪便细菌中筛选涉及大豆异黄酮代谢的特定细菌,其测定的转化结果也证明了这一点。在微生物分解酶的作用下,结合型大豆异黄酮的糖苷键裂解释放出葡萄糖配基和苷元,糖苷键水解包括以下一系列过程:位于R3位置的官能团丙二酰基乙酰化转化为乙酰基,乙酰基接着转化为H,最后β葡萄糖苷型在β-葡糖糖苷酶的作用下转化为游离型苷元[9]。
在苷元型异黄酮形成的基础上,大豆苷元和染料木素的一种单羟基化代谢物在C环的C-2脂肪族位置被羟基化。然而单羟基化代谢物并不是氧化代谢的终产物,Kulling等[10]使用大鼠肝脏微粒体进行体外实验研究得到大豆苷元被转化为9种代谢物,包括4种单羟基化、4种二羟基化和1种三羟基化的代谢物,主要产物被鉴定为 6,7,4′-三羟基异黄酮、6,7,3′,4′-四羟基异黄酮、7,8,4′-三羟基异黄酮和 5,6,7,4′-四羟基异黄酮;染料木素被代谢为4种单羟基化产物和2种二羟基化产物,主要产物为5,6,7,4′-四羟基异黄酮和 5,7,8,4′-四羟基异黄酮。Heinonen 等[11]研究所得黄豆黄素的公认代谢产物为二氢黄豆黄素(dihydroglycitein)、6-甲氧基-雌马酚(6-methoxy-equol)、5′-methoxy-O-desmethylangolensin、6-羟基-大豆苷元(6-hydroxy-daidzein)、6-羟基-二氢黄豆苷元(6-OH-dihydrodaidzein)、6-羟基-雌马酚(6-hydroxy-equol)以及5′-羟基-去氧甲基安哥拉紫檀素(5′-hydroxy-O-desmethylangolensin)。但值得一提的是,在大豆苷元的代谢途径中也可以出现上述部分产物,而Heinonen等在研究中并未使用示踪法或纯化合物,在母体化合物和代谢物之间无法建立明确的联系[12]。
1.1 发酵制品中微生物对大豆异黄酮的代谢转化
自20世纪末期,人类开始研究对大豆异黄酮的代谢转化有不同成效的特定微生物菌株。微生物代谢转化体系现已成为食品大规模生产、药物发现等相关领域获取大豆异黄酮高活性产物的一种常用方法。迄今国内外已报道的能将大豆异黄酮代谢转化为各类代谢产物的细菌菌株多为Clostridium、Sneckeria、Bifidobacterium、Coriobacteriaceae和Lactobacillus等[13]。发酵过程中微生物在β-葡萄糖苷酶的水解作用下极大地改变了大豆异黄酮的组分和含量,未发酵前大豆异黄酮主要是结合型糖苷,发酵后糖苷型含量减少,游离型苷元增加,同时产生了一系列代谢产物。
例如,Bifidobacterium在提高豆浆的生物活性方面起着重要作用,尤其是对大豆异黄酮的生物转化已得到广泛报道[14-15]。Wei等[14]以乳杆菌和双歧杆菌为菌种发酵豆浆,研究发现50%以上的结合型都被转化为游离型异黄酮。Raimondi等[15]发现它们具有将大豆苷转化为大豆苷元的能力。大多数菌株从大豆苷中释放糖苷配基,其中有12种菌株的产率高于90%。在豆浆发酵生产过程中,Bifidobacterium产生许多糖基水解酶,它们水解寡糖和与糖结合的化合物,将糖苷型异黄酮进行生物转化为相应的生物活性代谢产物,释放苷元型异黄酮的能力具体取决于β-葡萄糖苷酶。然而,Bifidobacterium对于大豆苷元向代谢产物S-雌马酚(S-equol)的转化目前仍然存在争议,大豆苷元向S-雌马酚的转化通过二氢黄豆苷元和四氢黄豆苷元或脱氢雌马酚的还原途径发生,但尚未有报道明确表明Bifidobacterium可进行此过程完整的还原生物转化。
事实上,我国许多传统特色发酵豆制品如腐乳、豆豉等在工业生产中,微生物体系的建立是决定产品品质的重中之重。腐乳是以豆腐为原料,通过微生物复合发酵制成的一种植物奶酪型食品,国内学者对其中的大豆异黄酮动力学变化进行了诸多探讨。刘欣等[16]分别以 Actinomucor elegans、Mucor wutungkiao 和 Rhizopus oligosporus为菌种,研究不同菌种在腐乳发酵前后大豆异黄酮含量变化。研究表明前发酵过程中,大豆异黄酮含量均有所增加且Rhizopus oligosporus前发酵腐乳大豆异黄酮含量相较于Mucor wutungkiao和Actinomucor elegans分别高90%和133%。这是由于除了菌种分泌的β-葡萄糖苷酶等酶类,使豆腐坯中配糖体形式异黄酮转化为游离形式外,可能还存在一些成分与大豆异黄酮相互转化,使得异黄酮含量上升[17]。
此外,微生物在发酵黄浆水、豆渣等豆制品副产物的工业过程中,也发挥了举足轻重的作用。王丽夏[18]利用Cordyceps militaris SN-18发酵黄浆水,结果表明,大豆异黄酮的总量和游离型的苷元含量均显著上升,特别是在80%乙醇提取物中,大豆苷元、黄豆黄素和染料木素分别增至(7 571.87±329.12)、(1 372.58±93.97)、(4 726.94±126.99)μg/g,分别是未发酵前的 20.5、16.5 和18.7倍。还有研究人员以Lactobacillusplantarum和Diplococcuspentosus为菌种,按照接菌量5.59%发酵黄浆水,得游离型苷元含量为31.31 mg/L,相比未发酵黄浆水增加了29.77 mg/L[19]。Lee等[20]以 Aspergillus niger为试验菌种探究其对异黄酮的转化产物,结果发现在初期代谢产物多为单羟基异黄酮和二羟基异黄酮,发酵10 d代谢产物多为二羟基异黄酮和三羟基异黄酮,羟基化反应通常发生在异黄酮的B环中。经标准验证,在二羟基异黄酮中,除3′,4′-二羟基类似物外,大豆苷元(4′,7′-二羟基异黄酮)是最丰富的代谢物。
1.2 肠道微生物对大豆异黄酮的代谢转化
肠道菌群是寄居在人体胃肠道内的正常微生物,不仅可以排毒清肠,减少病原菌带来的侵害,还有利于维生素的合成。人体的健康状况与肠道菌群同其宿主环境所共同构成的动态生态平衡密切相关。大豆异黄酮在人体内的主要代谢场所就是肠道,肠道菌群含有宿主本身不具有的结合型大豆异黄酮水解酶基因,将糖苷型代谢为游离型苷元。目前已报道的肠道菌包括 Bacteroidetes、Firmicutes、Enterococcus、Lactobacillus、Bifidobacterium和Clostridium等[21]。根据大豆异黄酮的代谢途径分析,结合型糖苷能抵挡胃和小肠的消化作用,到达结肠时,肠道菌群产生的β-葡萄糖苷酶水解位于糖基末端非还原性的糖苷键,同时释放出β-D-葡萄糖和相应的配基[22],从而结合型糖苷数量降低,苷元型数量上升。经报道证实,β-葡萄糖苷酶的专一性较差,在水解底物的糖基结构时,即可水解C-O糖苷键、C-S键以及C-N键等[23],这种专一性为得到不同形式的大豆异黄酮提供了基础。游离型苷元一部分被小肠直接吸收,最终以粪便的形式排出体外。另一部分则继续被肠道菌群所分泌的黄豆苷元还原酶、二氢黄豆苷元酶、四氢黄豆苷元还原酶等酶系,通过去糖基、脱甲基、脱羟基和还原反应等分解得到活性更高的不同次级代谢产物[24]。
大肠菌群在得到苷元的基础上可以通过加氢还原(C-2位和C-4位)、开环转化或同时进行加氢还原(C-2位和C-4位)和去掉底物C-4位酮基的功能,将大豆苷元或染料木素还原为二氢黄豆苷元(dihydrodaidzein,DHD) 或二氢染料木素(dihydrogenistein,DHG)、开环转化为去氧甲基安哥拉紫檀素(ODesmethylangolensin,O-Dma)和 4-羟苯基-2-丙酸[2-(4-Hydroxyphenyl)propionic acid,2-HPPA]、还原去酮基后生成雌马酚(equol)等代谢产物[25]。Schoefer[26]及Lee等[27]先后报道了来源于人体肠道的Eubacterium,可以对游离型苷元进行开环转化,分别将大豆苷元和染料木素代谢转化为去氧甲基安哥拉紫檀素和4-羟苯基-2-丙酸。另有研究报道兼性好氧肠道微生物Enterococcus hirae AUH-HM195同样具有开环转化功能[28]。Heinonen等[29]为了探究大豆异黄酮的Ⅰ期代谢产物,召集了6名志愿者,在其每天正常的西方饮食中加入3根大豆棒,进行为期2周的补充前后尿液样品收集。尿液样品经一系列分离纯化,使用气相色谱-质谱法 (gas chromatography-mass spectrometer,GC-MS)分析确定了几种新的大豆异黄酮代谢物。鉴定出4种大豆苷元和染料木素的主要代谢产物,分别是大豆苷元的 3 种羟基化代谢物 3′,4′,7-三羟基异黄酮、4′,6,7-三羟基异黄酮和 4′,7,8-三羟基异黄酮,以及染料木素的代谢产物3′,4′,5,7-四羟基异黄酮。研究表明,形成4′,6,7-三羟基异黄酮的另一种途径是黄豆黄素的去甲基化。同时该研究也初步确定了其它先前报道的代谢产物雌马酚、去氧甲基安哥拉紫檀素、二氢黄豆苷原和顺-4-羟基-雌马酚、二氢染料木素和6′-OH-O-desmethylangolensin的含量较低且这些氧化代谢产物的产生存在个体差异。然而除了个体差异外,在动物研究和一些人类研究中已经观察到关于肠道菌群的性别差异。例如,Coldham和Sauer[30]报告了口服[14C]染料木素后大鼠粪便中的主要代谢产物,结果表明雌性大鼠代谢主要为二氢染料木素,雄性大鼠代谢主要为4-羟苯基-2-丙酸。通过对各类不同代谢产物的化学结构式进行分析,加上对诸多研究进行归纳总结,整理出目前普遍认可的大肠菌群对大豆异黄酮主要代谢途径及相应发酵微生物种类(图2)。
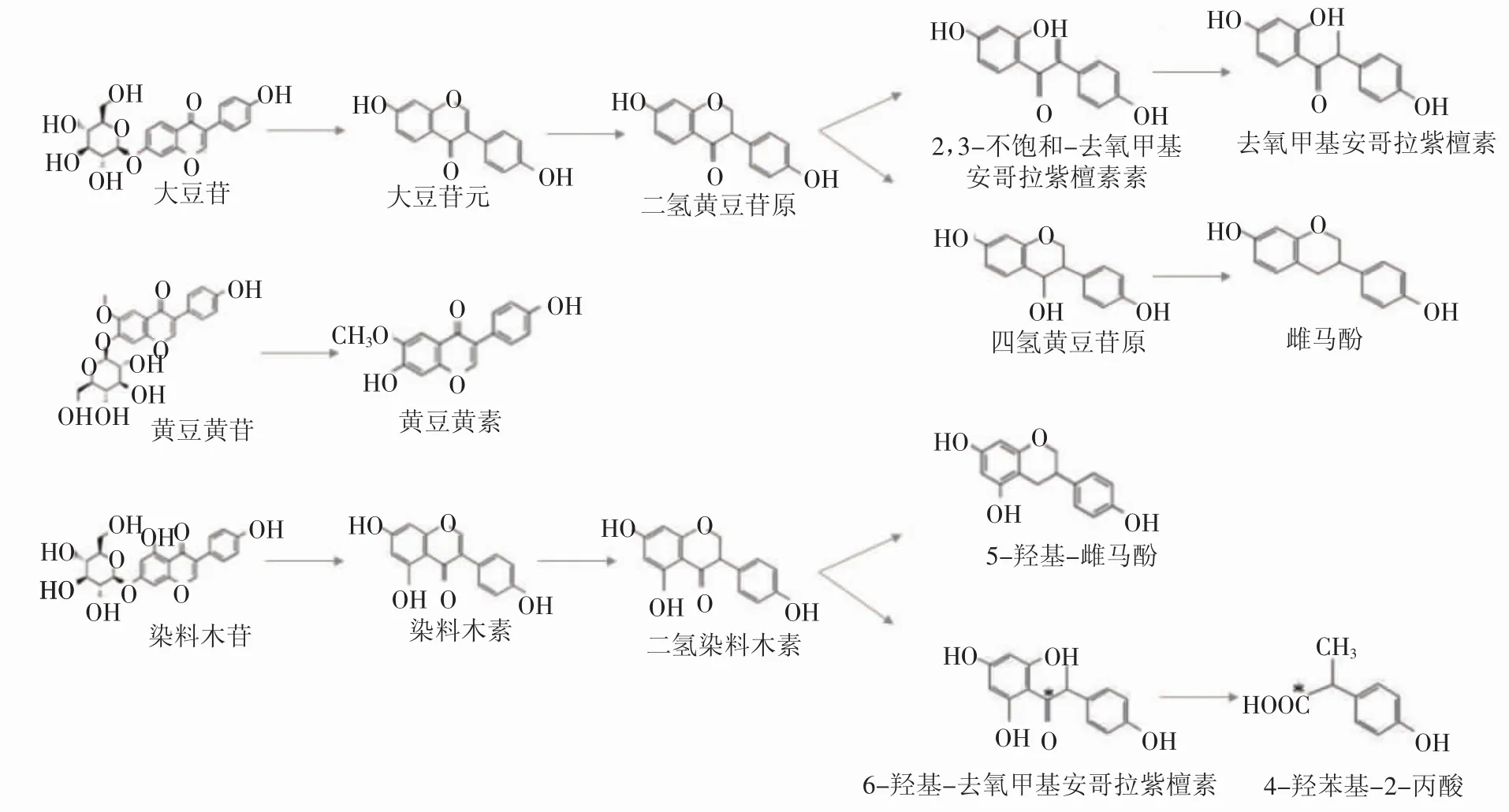
图2 大豆异黄酮肠道微生物代谢转换途径Fig.2 Microbial metabolic pathway of soybean isoflavones by gut microbiota
2 大豆异黄酮生物转化产物功能活性
2.1 抗氧化作用
氧化损伤对人体健康造成了极大的威胁,人体的氧化衰老主要是由氧化应激反应产生的自由基造成的。大豆异黄酮生物转化产物能够对人体起到多种调节作用,使细胞免受氧化应激损伤。大豆异黄酮属于氧苷类,是杂环酚类化合物,其抗氧化活性主要取决于它们向自由基捐赠氢原子的能力,即其分子结构主链上取代羟基的位置和数目。有研究表明,对抗氧化活性影响最大的羟基位是C-4′位羟基,其次是C-5位羟基,而C-7位羟基的影响可以忽略[31]。而大豆苷元在C-4′位、C-5位、C-7位共3个羟基,染料木素在C-4′位和C-7位共2个羟基,所以染料木素和大豆苷元均是有效的抗氧化剂,且相对于未发酵前的大豆异黄酮母体,转化产物具有更有效的抗氧化功能。
翟齐啸等[32]研究发现利用Lactobacillus和Mould发酵豆乳,可以改变其中结合型糖苷和游离型苷元的组成比,从而有效提高豆乳因对金属镉暴露导致氧化损伤的保护效果。唐思颉等[33]报道,用红茶菌发酵黄浆水,发酵6d后结合型糖苷质量浓度下降至49.76mg/mL,而游离型苷元质量浓度增加到150.95 mg/mL。同时还发现转化产物对于DPPH自由基的清除能力明显上升,从15.19%提高达93.19%。转化产物主要是通过以下2种途径来实现其抗氧化功能:第一种是在细胞代谢过程中阻止DNA中鸟嘌呤被活性物质破坏来阻断自由基反应链,清除体内产生的过多的自由基,保持机体的自由基平衡[34];第2种是通过增强相关抗氧化酶的活性,减少氧化应激代谢产物的生成。Gunae等[35]通过动物实验研究得出,大豆异黄酮转化产物可诱导抗氧化基因的表达,显著提高大鼠血清中超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的抗氧化活性,从而减少大鼠体内丙二醛(malondialdehyde,MDA)含量,激活酶活性防御系统,减少自由基和活性氧(reactive oxygen species,ROS)的形成,最终减少机体氧化损伤。
2.2 抗癌活性
1986年,美国研究员首次发现异黄酮类化合物大豆中具有抗癌活性的有效成分,之后便掀起了国内外对大豆异黄酮生物转化产物抗癌活性研究的热潮[6]。大量研究已证实,经常食用富含大豆异黄酮转化产物的人群可明显减少相关疾病的发病风险,尤其是降低结肠癌、乳腺癌和前列腺癌等疾病的发病率[36]。如崔美林[37]利用含有菌丝体的灵芝匀浆发酵大豆异黄酮粗提物,60℃下转化48 h后,测得大豆苷元和染料木素的转化率分别为96.63%和87.82%,且转化产物对结肠癌细胞HTL9、乳腺癌细胞MCF-7、肝癌细胞HepG2的增殖均有显著的抑制效果。其原因是经转化产物处理后,细胞HTL9和MCF-7被阻滞于G1期,无法分裂,而细胞HepG2被阻滞在S期来诱导细胞凋亡。此外,经转化产物处理后,结肠癌细胞HTL9中Bcl-2基因/Bax基因比值下降,同时Cyto-C蛋白表达含量上升,激活半胱氨酸蛋白酶-3,半胱氨酸蛋白酶-8使其含量增加,该试验进一步说明转化产物可以通过调控多个与凋亡相关基因的表达,从而诱导细胞HTL9凋亡。
然而并不是所有的大豆异黄酮生物转化产物都具有绝对的抗癌活性,有些反而会促进癌细胞增殖。如Juan等[38]利用5 μmol/L染料木素处理乳腺癌细胞MCF-7,研究表明染料木素可通过对细胞色素P450 1B1(CYP 1B1)基因的诱导,从而刺激细胞MCF-7产生ROS,并促进癌细胞MCF-7的增殖。因此,在摄入外源性大豆异黄酮转化产物时应确定合理的摄入剂量和摄入频率。
2.3 预防骨质疏松症
女性在更年期时,体内雌激素水平急剧下降,骨小梁和皮质骨密度降低,继而引发骨质疏松症。大豆异黄酮因具有与内源性激素雌二醇相似的化学结构,可以结合受体,具有拟雌激素作用,并通过降低骨吸收速率,提高骨形成率来实现对骨代谢的良好调节。其中发挥主要作用的还是大豆异黄酮被肠道菌群分解的代谢物[39]。Ohtomo等[40]研究了O-Dma对于切除子宫小鼠的骨密度及生长代谢的影响,发现O-Dma能够显著抑制破骨细胞生长。另有Jin等[41]研究发现大豆苷元通过发挥雌激素作用,激活丝裂原活化蛋白激酶/细胞外调节激酶(MEK/ERK)和磷酸肌醇3-激酶/蛋白激酶B或PKB(PI3K/Akt)信号通路,促进人类成骨细胞样MG-63细胞的增殖分化来刺激成骨。雌马酚也是大豆苷元的主要代谢产物,Lin等[42]研究了雌马酚对胶原性关节炎小鼠炎症反应和骨侵蚀的影响,结果表明雌马酚能抑制白细胞介素-6及其受体的表达,同时还能激活雌激素受体β的活性,降低破骨细胞和未成熟成骨细胞特异性及软骨破坏相关基因的表达,从而预防骨质疏松症。
2.4 其它活性
大豆异黄酮转化产物还具有降低心血管风险、预防动脉粥样硬化症、抑菌、提升机体免疫力等诸多作用,在市场上呈现出较为广阔的应用潜力。转化产物主要是通过弱雌激素作用,减少血清总胆固醇浓度来缓解心血管疾病,而雌马酚的效果最为显著[43]。舒芙蓉[44]为高胆固醇血症人群适量补充大豆异黄酮转化产物,实验表明大豆苷元可显著减低血清甘油三酯和尿酸浓度,对于心血管疾病有一定的干预作用。此外,很早就有记载说大豆可以治疗肠炎,Hong等[45]研究发现染料木素对 Staphylococcus aureus、Yersinia enterocolitica、Enterobacteriaceae、Mycobacterium avium、Listeria monocytogenes、Fonsecaeapedrosoi具有显著的抑菌效果。其机制可能是通过破坏细胞结构的完整性、抑制蛋白质的合成和糖异生途径以及使遗传物质的合成受到阻碍来实现。诸多研究表明,大豆异黄酮转化产物的功能活性还表现在调节机体免疫系统,增加免疫功能。高荣海等[46]用大豆异黄酮糖苷和苷元喂养小鼠,发现小鼠鸡红细胞作免疫原的溶血素光密度值较对照组均有显著提升,表明糖苷和苷元都有免疫调节功能,同时发现苷元型的转化产物吸收性更强,其调节机制主要从非特异性免疫、细胞免疫与体液免疫来完成免疫应答。
3 总结与展望
近年来,大豆异黄酮微生物转化产物对于人体健康调控方面起到的积极作用受到了国内外研究学者们的广泛关注,了解各类微生物对于大豆异黄酮的代谢机制及各类代谢产物有着巨大的现实意义。本文综合了近年来国内外相关研究成果,针对不同微生物体系(有关实际生产发酵食品使用的微生物菌种及肠道菌群)对大豆异黄酮主要单体的代谢、转换过程,以及代谢产物在抗氧化作用、抗癌活性和预防骨质疏松症等生物活性的影响机制进行了详细阐述。利用微生物发酵技术可制备具有更高、更广活性的不同次级代谢产物,但就目前的研究深度来说,各类微生物对大豆异黄酮进行复杂代谢转化过程时的作用条件(温度、pH值、酶系和菌种数目等)以及各类微生物在转化时的代谢通路和具体代谢作用机理等还有待进一步研究。只有了解以上条件和机理,才能解决市场上大豆异黄酮微生物体外转化工艺构建的问题,才能进一步推进对大豆异黄酮微生物转化产物功能活性的研究,为大豆异黄酮微生物转化产物在食品保健、饲料研发、医药制品等诸多领域更深层次的开发利用提供理论参考依据。

