芹菜素联合阿霉素对肝癌HepG2细胞增殖、凋亡及细胞周期的影响
邸金霖,单万亭,赵娇,鞠爱霞,李秋红
(黑龙江中医药大学,黑龙江 哈尔滨 150040 )
肝细胞癌(hepatocellular carcinoma,HCC)起源于肝细胞的恶性肿瘤,属于原发性肝癌的一种常见病理类型,是严重威胁人生命健康的因素之一。它早期治疗首选手术切除,但术后有复发的可能性,常需结合药物治疗,而晚期则无治愈性,且对目前所采用的化学治疗易产生耐受性[1-2],因而,寻找抗肝细胞癌疗效显著且不易产生耐受性的治疗手段成为目前亟待解决的热点问题。阿霉素(Poxovubivin,POX)属于广谱抗肿瘤类化疗药,对多种肿瘤有显著疗效,有效作用于肿瘤细胞的生长周期,但肿瘤多药耐药性(Multidrug resistance,MDR)影响了它作为一线抗肿瘤药物的应用。芹菜素是天然存在的黄酮类化合物,近年来被报道可从抑制肿瘤细胞增殖、侵袭、转移和纠正肿瘤细胞耐药性等多方面产生抗肿瘤作用[3-4]。体内研究表明,芹菜素对阿霉素所致心脏毒性具有拮抗作用[5],芹菜素可以改变阿霉素体内药动学过程[6]。综上,推测芹菜素可能会增加阿霉素的抗肿瘤作用。本研究旨在探索芹菜素对阿霉素抗肝癌作用的影响,为深入研究芹菜素对阿霉素抗肝癌的药动及分子机制研究提供细胞基础,进而为临床治疗提供新思路及联合应用提供理论基础。
1 材料与方法
1.1 药物与试剂
阿霉素(MB1087),芹菜素(MB2186)购于大连美轮生物科技有限公司,青霉素-链霉素混合液、胎牛血清、胰酶和1640培养基均购于美国Hyclone公司,MTT(sigma,M2128),细胞周期与细胞凋亡检测试剂盒(碧云天,C1052),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(absin, abs50001)。
1.2 仪器
Tecan InfiniteTM200 Pro多功能酶标仪(Tecan, 瑞士),流式细胞仪(Merck,德国)。
1.3 细胞株及细胞培养
在37 ℃饱和湿度的5% CO2培养箱中培养HepG2肝癌细胞(购于上海中桥新舟生物科技有限公司),将1%青霉素、1%链霉素和10%胎牛血清加入HepG2肝癌细胞培养基中进行传代培养,进行后续实验时选取处于对数生长期的细胞。
1.4 观察项目及方法
1.4.1 采用MTT检测HepG2肝癌细胞增殖情况
于96孔培养板中接种200 μL、密度104 mL-1的HepG2肝癌细胞,并置于规定条件的培养箱中培养待细胞长满瓶底,此时一部分孔加入不同浓度的的阿霉素(0、0.1、0.2、0.5、1、5 μg·mL-1),另一部分加入芹菜素(0、5、10、20、40、80 μmol·L-1)继续培养24、48、72 h,培养结束后,小心移除上清液,加入浓度为5 mg·mL-1MTT溶液20 μL,继续培养4 h,小心移除上清液,每孔加入150 μL的二甲基亚砜(DMSO),恒温摇床振荡10 min,使生成的结晶完全溶解,酶标仪检测490 nm波长的吸光度值。
1.4.2 Annexin V-FITC/PI 双染色法检测细胞凋亡水平
将2 mL、密度5×105mL-1的HepG2肝癌细胞悬液接种于96孔板置于适宜条件的培养箱中培养直到细胞增殖铺满瓶底面积的7/10~4/5,此时将96孔板分为空白组、阿霉素组、阿霉素联合芹菜素组,加入相应的药物,继续培养24 h,培养结束后,用含有2%BSA的0.25%胰酶消化处理贴壁细胞。1×PBS洗涤样品管细胞,并置于离心机中2 000 r/min离心 5~10 min收集悬浮及贴壁细胞,重复先前操作,吸除上清液洗涤细胞,重新加入300 μL的1×Binding Buffer于样品管中使细胞悬浮,同时加入Annexin V-FITC5 μL混匀,室温孵育15 min进行Annexin V-FITC标记,最后加5 μL PI于样品管中5 min进行染色后置流式细胞仪检测。
1.4.3 肝癌细胞HepG2周期检测
将2 mL的密度5×105mL-1的HepG2肝癌细胞悬液接种于96孔板置于适宜条件的培养箱中培养待细胞长满瓶底面积的7/10~4/5,此时将96孔板分为三组即空白组、阿霉素组、阿霉素联合芹菜素组,加入相应的药物,继续再进行培养24 h,培养结束后用0.25%胰酶消化处理的贴壁细胞,用1×PBS洗涤1 000 r/min离心沉淀样品管中的悬浮细胞,吸除上清液洗涤细胞,重复先前操作后于样品管中加入1 mL预冷70%乙醇,轻轻吹打混匀,4 ℃固定2 h,1 000 r/min离心3~5 min,沉淀细胞。向样品管中加入0.5 mLPI混匀,避光孵育30 min,置于488 nm波长流式细胞仪检测红色荧光,与此同时记录检测光散射情况。采用Mod Fit软件进行细胞DNA含量分析。
1.5 统计学分析
所有数据均利用SPSS 22.0统计学软件进行分析,数据以(均数±标准差)表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,P<0.05为有统计学意义。
2 结果
2.1 阿霉素抑制肝癌细胞增殖活性
阿霉素处理24和48 h后,阿霉素对肝癌细胞增殖的抑制率明显增加,且随着剂量的增加抑制作用逐渐增强,具有浓度和时间依赖性;阿霉素处理肝癌细胞72 h后,肝癌细胞增殖抑制率明显增加,大部分肝癌细胞增殖活性被抑制,且随着剂量的增加,增殖抑制率逐渐增加。结果提示对于肝癌细胞的增殖,阿霉素具有剂量和时间依赖性抑制作用,见表1。

表1 不同浓度阿霉素在不同时间对肝癌细胞HepG2的增殖抑制率
2.2 芹菜素抑制肝癌细胞增殖活性
如表2所示,芹菜素处理24、48和72 h后,芹菜素对肝癌细胞的增殖抑制率明显增加,且随着浓度和时间的增加抑制作用逐渐增强,结果表明芹菜素对肝癌细胞增殖的抑制作用具有浓度和时间依赖性。
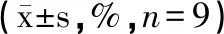
表2 不同浓度芹菜素在不同时间对肝癌细胞HepG2的增殖抑制率
2.3 Annexin V-FITC/PI双染色法检测细胞凋亡水平
图1结果所示,阿霉素、阿霉素联合芹菜素处理24 h,与空白组比较,阿霉素组,联合组肝癌细胞凋亡率明显升高,且差异具有统计学意义(P<0.05);与阿霉素组比较,联合组肝癌细胞凋亡率明显增加,且差异具有统计学意义(P<0.05);结果表明芹菜素与阿霉素联用能够明显增加肝癌细胞的凋亡率,芹菜素能够增强阿霉素对肝癌细胞的促凋亡作用。
2.4 流式细胞术检测肝癌细胞周期变化影响
图2的结果表明,与空白组比较,阿霉素组、阿霉素联合芹菜素组中肝癌细胞G0/G1期、S期百分比明显增加(P<0.05),G2/M期百分比明显降低(P<0.05),且差异具有统计学意义;与阿霉素组比较,阿霉素联合芹菜素组中肝癌细胞G0/G1期百分比明显增加(P<0.05),G2/M期百分比明显降低(P<0.05),且差异具有统计学意义。结果提示阿霉素可引起肝癌细胞停滞在G0/G1期,芹菜素能够增加肝癌细胞阻滞在G0/G1期。
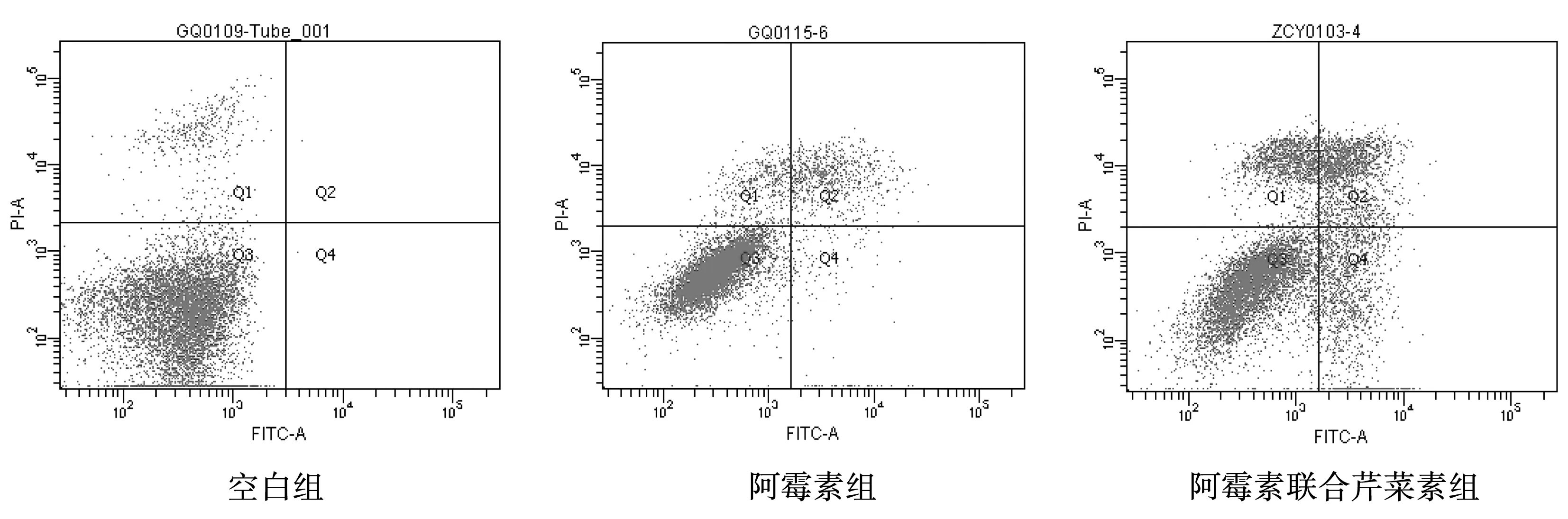
图1 各组药物对肝癌细胞HepG2细胞凋亡影响

图2 各组药物对肝癌细胞HepG2细胞周期变化
3 讨论
MDR是肿瘤化疗失败的最主要原因,其机制是MDR基因、MDR相关蛋白基因P-糖蛋白(P-glycoprotein,P-gp)基因的过度表达及对凋亡的耐受等导致肿瘤细胞内药物浓度低或药物靶分子改变,使其对结构和作用靶点不同的其他抗肿瘤药物产生交叉耐药性[7],因此,目前国内外主要研究热点在于寻找高效、低毒的MDR逆转剂。中药及中药单体治疗恶性肿瘤疾病具有多途径、多环节、多靶点等独特优势,是MDR逆转剂的寻找的主要方向[8-9]。芹菜素,又称芹黄素、洋芹素、芹菜配基,是天然存在的黄酮类化合物。诸多国内外研究显示,芹菜素具有低毒、无诱变性等特点的抗肿瘤活性,其作用的途径主要有以下几种:一是通过调控肿瘤相关基因进而影响肿瘤细胞通路导致细胞凋亡或抑制肿瘤侵袭,二是通过诱导肿瘤细胞周期阻滞中断肿瘤细胞增殖,三是通过抑制肿瘤血管形成阻断营养供给,四是通过放化疗增敏提高与之联合应用药物的疗效[10]。DOX是蒽环类广谱抗肿瘤抗生素,属于周期非特异性药物,对处于G0、G1、S、 G2、M期的细胞均有杀灭作用,但由于易产生耐药性,多与其他抗癌药联合使用[11]。研究发现阿霉素是P-gp和多药耐药相关蛋白(multidrug resistance protein,MRP)的底物[12],能产生肿瘤MDR,从而影响其使用疗效。同时芹菜素体外研究结果显示,其通过抑制ATP酶活性,使多药耐药相关蛋白1(MRP1/ABCC1)供应减少外排转运化疗药物的能量供应减少从而增加了细胞内化疗药物的浓度,逆转肿瘤细胞的MDR[4]。因此,推测芹菜素可能会增强阿霉素的抗肿瘤效果。
本实验从细胞层面研究芹菜素对阿霉素抗肝癌细胞作用的影响。通过细胞增殖活性实验,结果表明阿霉素和芹菜素对HepG2细胞的抑制作用均有时间和浓度依赖性。在细胞凋亡实验中,与阿霉素单独使用相比芹菜素联合阿霉素共同使用,肝癌细胞凋亡率明显增加。流式细胞术检测肝癌细胞周期变化实验结果表明,阿霉素可引起肝癌细胞停滞在G0/G1期,芹菜素能够增加肝癌细胞阻滞在G0/G1期。上述结果能够客观地反映芹菜素与阿霉素联用明显增加肝癌细胞凋亡率,具有协同增效作用。
综上所述,阿霉素引起肝癌细胞停滞在G0/G1期,芹菜素增加肝癌细胞阻滞在G0/G1期,进而促进阿霉素对肝癌细胞的促凋亡作用,两药联用增强了抗肿瘤效果,与推测具有一致性。低毒、无诱变性的芹菜素不仅能够增加阿霉素抗肿瘤作用,同时还对阿霉素所致心肌损伤具有保护作用[13]。该研究为芹菜素和阿霉素联用抗癌提供科学的实验数据。然而,芹菜素与阿霉素联用是否会产生其它作用,芹菜素是否能抑制P-gp逆转阿霉素多药耐药性,还有待更加深入的研究。

