小麦盐胁迫持续上调转录因子基因TaERF8-2D的克隆及其分析
崔德周,李永波,隋新霞,黄琛,杨在东,樊庆琦,楚秀生,3
(1.山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,山东 济南 250100;2.山东鲁研农业良种有限公司,山东 济南 250100;3.山东师范大学生命科学学院,山东 济南 250014)
盐胁迫是制约农业发展的全球性问题。据统计,全球约8.3亿公顷的耕地遭受着土壤盐渍化的侵蚀[1]。我国盐碱地总面积约为3 600万公顷,盐胁迫每年造成的粮食减产达总产的15%以上[2]。小麦是我国主要粮食作物之一,也是盐渍化土壤重要的栽培作物,其耐盐性的高低直接决定是否能够稳产、高产。因此克隆小麦耐盐基因,解析其对盐胁迫的响应机制,对小麦耐盐遗传改良具有重要意义。
转录因子是生物体内一类重要的调节蛋白,它们通过与启动子区域的顺式作用元件发生特异性结合,直接调控下游靶基因的表达[3]。AP2/EREBP(APETALA 2/ethylene-responsive element binding protein)类转录因子是植物中特有的一类转录因子,因含有AP2/EREBP结构域而得名。在拟南芥中,Sakuma[4]和张麒[5]等根据其序列相似性和AP2/EREBP结构域的数量,将其分为AP2(APETALA 2)、RAV(related to ABI3/VP1)和EREBP(ethylene-responsive element binding protein)三大类型。EREBP型转录因子根据其在DNA结合区第14位和第19位的氨基酸序列差异,又可分为DREB(dehydration-responsive element binding protein)亚族和ERF(ethylene-responsive factor)亚族,其中DREB亚族第14位和第19位分别是缬氨酸和谷氨酸,而ERF亚族则是丙氨酸和天冬氨酸[4]。随着基因组学和高通量测序技术的发展,拟南芥、水稻、黄瓜、苜蓿等多种植物中ERF亚族的系统鉴定与分析被陆续报道[6-9]。
ERF类转录因子在植物生长发育、信号转导及逆境响应中发挥重要作用[5,10,11]。拟南芥ERF109通过介导茉莉酸信号转导和生长素合成通路间的交互作用,调控侧根的发生[12]。过表达苹果ERF3基因可促进花青苷和原花青苷的积累[13]。大豆ERF3基因可被高盐、干旱等诱导表达,将其在烟草中过表达后,可显著提高烟草对高盐和干旱胁迫的耐受能力[14]。普通小麦中ERF类转录因子成员有47个[15],主要参与应答生物或非生物逆境胁迫,然而,目前仅有少数几个ERF基因被克隆,并进行相应的研究。研究表明,小麦ERF1基因的表达受高盐、干旱、低温、ABA、乙烯、水杨酸以及白粉病菌侵入的诱导[16];Zhu等克隆了受病原菌诱导的TaPIE1(pathogeninduced ERF1)基因,发现该基因的表达受纹枯病菌和低温胁迫共同诱导[17];TaERF3基因除应答高盐和干旱胁迫外,对病原菌侵入和外源激素处理也有响应[18,19];TaERF4基因在拟南芥中通过抑制液泡膜NHX活性,负调控耐盐性[20];TaERF8-2B在调控普通小麦株高、抽穗期和千粒重中发挥重要作用[21],而TaERF8-2A和TaERF8-2D基因虽已被克隆,但尚未对其功能进行解析,更未有在耐盐小麦品种中进行基因功能分析的报道。
本研究利用本团队获得的耐盐小麦转录组数据,从耐盐小麦品种德抗961中克隆了盐胁迫下持续上调的基因TaERF8-2D,并对其进行了生物信息学分析、亚细胞定位和盐胁迫下的基因表达分析,以期为深入研究该基因在小麦盐胁迫中的耐盐功能奠定基础。
1 材料与方法
1.1 试验材料
本研究所用耐盐小麦品种为德抗961,由山东省农业科学院作物研究所小麦种质创新与利用团队保存。
1.2 TaERF8-2D基因克隆及生物信息学分析
利用本团队获得的耐盐小麦品种德抗961的转录组EST数据,通过Ensembl小麦基因组数据库进行比对,使用Primer Premier 5.0软件设计获得特异引物(F:5′-ATGGTCTCCGCTCTGTCC-3′;R:5′-TCACGAGTCTTTATTATTTTTGTGC-3′),以德抗961幼苗叶片cDNA为模板,扩增TaERF8-2D基因的CDS序列。PCR扩增程序:95℃5 min;95℃30 s,50℃30 s,72℃45 s,35个循环;72℃10 min;16℃,保存。胶回收后的DNA,连接到pEASY-Blunt Cloning Kit(全式金,北京),并转化大肠杆菌Trans5α(全式金,北京)。挑选阳性克隆,送北京擎科新业生物技术有限公司(青岛)进行测序。
利用ExPASy-ProtParam(http://www.expasy.org/tools/protparam.html)和ProtScale(https://web.expasy.org/protscale/)分别分析TaERF8-2D蛋白的理化性质和亲疏水性。使用SignalP 5.0在线工具(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测。采用TMHMM 2.0在线软件 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测TaERF8-2D蛋白的跨膜结构。通过NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)在线预测分析蛋白的磷酸化位点。使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对编码蛋白的二级结构进行预测。
1.3 亚细胞定位分析
设计带有XbaⅠ和SalⅠ酶切位点的特异性引物 (F:5′-GCTCTAGAATGGTCTCCGCTCTGTCC-3′;R:5′-ACGCGTCGACCGAGTCTTTATTATTTTTGTGC-3′),扩增无终止密码子的TaERF8-2D全长CDS片段,经双酶切后,连接到表达载体pCAMBIA2300-35S-GFP,并转化大肠杆菌Trans5α,然后筛选阳性克隆。将重组质粒转化农杆菌GV3101,鉴定阳性克隆并保存。将重组质粒和对照空载体分别转化拟南芥原生质体,室温培养过夜,在激光共聚焦显微镜下,观察原生质体中绿色荧光的分布情况。
1.4 盐胁迫下的基因表达分析
将室温22℃、光照培养10 d的德抗961小麦幼苗置于250 mmol/L NaCl溶液中进行胁迫处理,分别在处理0、3、6、12、24 h和48 h时取第一片展开叶片,液氮速冻后,于-80℃保存备用。
按照植物组织RNA快速提取试剂盒(天根生化,北京)提取小麦叶片总RNA。采用反转录试剂盒(全式金,北京)合成cDNA第一链。利用TaERF8-2D基因的特异引物[21](F:5′-CGACAGATTGCAGCAACAACAACAGTG-3′;R:5′-CCCGTTGTGCCTGAGCTCGATATA-3′)和Tubulin内参引物(F:5′-TCGATGA TCTCCAACTCCACCAGT-3′;R:5′-TCGTCGAACTCAGCACCAACTTCT-3′)进行RT-PCR。利用1.5%琼脂糖凝胶电泳,检测PCR产物。
2 结果与分析
2.1 小麦TaERF8-2D基因的克隆
以耐盐小麦德抗961的cDNA为模板,经PCR扩增和琼脂糖凝胶电泳检测,在750 bp左右出现一个特异DNA条带(图1)。通过对其回收和测序,发现该片段长度为762 bp,编码253个氨基酸。
2.2 生物信息学分析
2.2.1 TaERF8-2D编码蛋白的二级结构分析利用SOPMA网站对该基因编码蛋白的二级结构进行分析,结果表明,该编码蛋白二级结构中无规则卷曲比例最高,占68.39%,α-螺旋占19.76%,延伸链占8.30%,β-转角占3.56%(图2)。
2.2.2 蛋白理化性质分析 通过ExPASy-Prot-Param分 析,TaERF8-2D蛋 白 的 分 子 式 为C1176H1845N353O365S6,分子量为26.96 kD,理论等电点(pI)为9.55,不稳定系数为57.39,推测该蛋白为不稳定蛋白。对该蛋白的亲水性、疏水性进行分析表明,其总平均吸水性为-0.521,属于亲水蛋白(图3)。
2.2.3 蛋白信号肽预测 利用SignalP 5.0和TMHMM 2.0在线预测表明,该蛋白既无信号肽,也不存在跨膜结构域(图4),由此推断该蛋白不是分泌蛋白。

图2 TaERF8-2D蛋白的二级结构

图3 TaERF8-2D蛋白的亲水性和疏水性预测

图4 TaERF8-2D信号肽(A)及跨膜结构域(B)分析
2.2.4 氨基酸磷酸化修饰位点分析 使用在线软件NetPhos 3.1对TaERF8-2D蛋白的磷酸化位点进行分析,结果表明,该蛋白共有30个氨基酸磷酸化位点,其中丝氨酸(Ser)磷酸化位点最多,有16个;其次为苏氨酸(Thr),磷酸化位点有13个;而酪氨酸(Tyr)磷酸化位点仅有1个(图5)。

图5 TaERF8-2D蛋白的氨基酸磷酸化位点分析
2.3 亚细胞定位
将含有重组载体pCAMBIA2300-35S::TaERF8-2D-GFP和对照空载体pCAMBIA2300-35SGFP的菌液,利用瞬时转染法导入拟南芥原生质体,25℃暗培养24 h后,通过激光共聚焦显微镜观察绿色荧光蛋白信号。结果显示,TaERF8-2D::GFP融合蛋白仅在细胞核有明显的绿色荧光,而对照空载体在细胞膜、细胞核和细胞质中都可以观察到绿色荧光信号,由此表明,编码的TaERF8-2D蛋白定位于细胞核(图6)。这与报道的ERF类转录因子主要定位于细胞核的结论相一致[22,23],主要参与细胞核内转录调控过程。
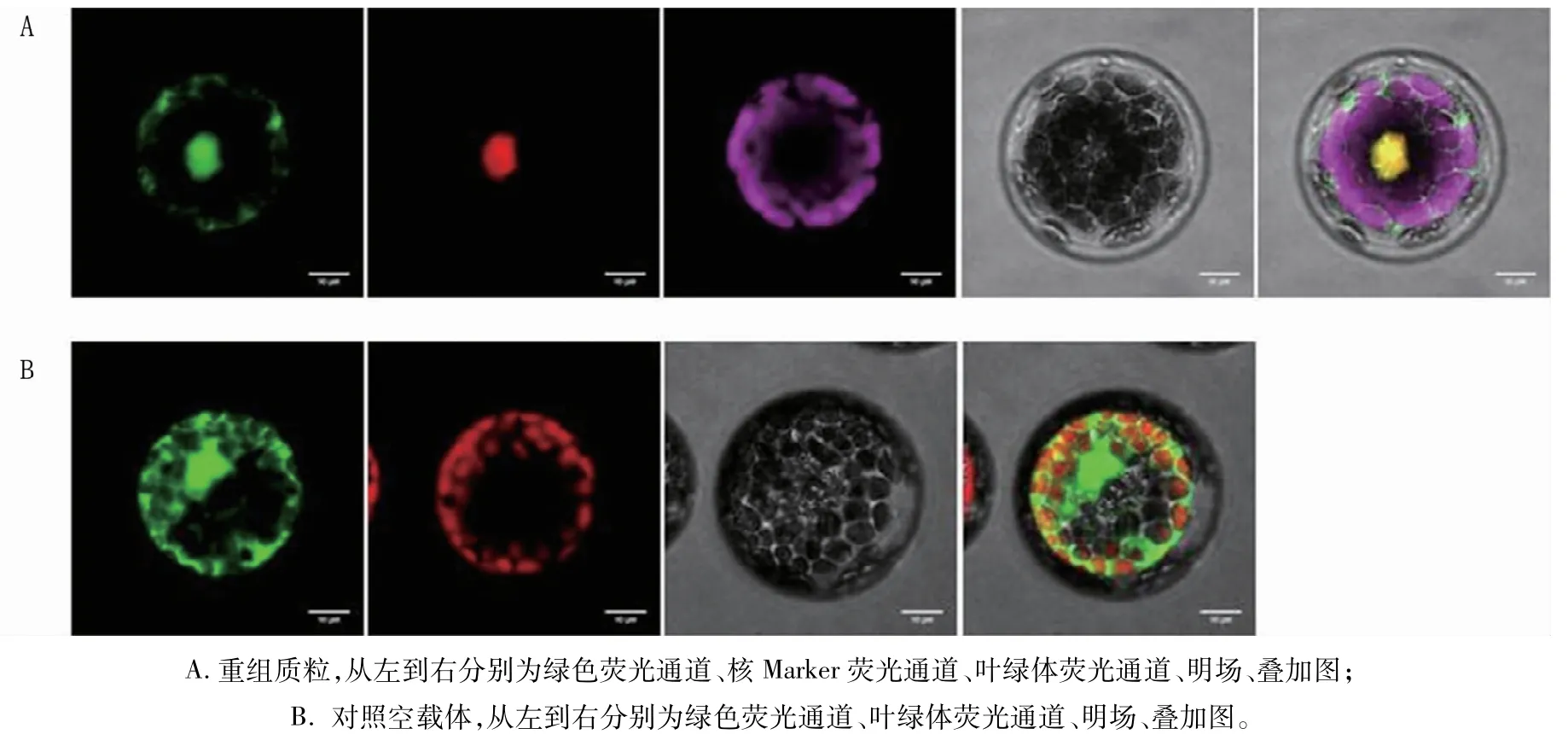
图6 TaERF8-2D蛋白的亚细胞定位
2.4 盐胁迫下TaERF8-2D基因的表达分析
利用RT-PCR检测TaERF8-2D基因对盐胁迫的响应特性。结果显示,在盐胁迫24 h和48 h时,该基因的表达显著增强(图7),进一步证明TaERF8-2D基因可能与小麦盐胁迫的响应密切相关。

图7 TaERF8-2D基因响应盐胁迫的RT-PCR分析
3 讨论与结论
ERF类转录因子是植物中特有的一类转录因子,广泛参与植物发育、代谢和抗逆过程[5,10-14],是改良植物遗传特性的优异基因资源。ERF类转录因子主要参与逆境胁迫响应和生长发育,在众多的ERF类转录因子成员中,仅有少数几个ERF基因从普通小麦中被克隆出来[16,18-21,24]。本研究利用本团队获得的耐盐小麦转录组及其基因表达数据,从耐盐小麦品种中筛选到对盐胁迫响应非常明显的基因TaERF8-2D。而有关TaERF8-2D基因编码的蛋白信息以及该基因对小麦盐胁迫的响应尚未见报道,因此明确该基因编码蛋白质的特性、亚细胞定位以及盐胁迫下的基因表达模式,对于进一步探究该基因的耐盐功能具有重要意义。
蛋白质的理化特性、亚细胞定位与其生物学功能密切相关。本研究结果表明,小麦TaERF8-2D基因编码的蛋白质属于亲水蛋白,没有信号肽且不存在跨膜结构域,不属于分泌蛋白,该蛋白定位于细胞核,这与大多数转录因子的定位信息相一致[22]。蛋白质磷酸化作为一种重要的翻译后修饰,是调控蛋白质活力和功能的重要机制,广泛参与细胞信号转导、抗逆胁迫等多种生物过程[25]。本研究表明,TaERF8-2D蛋白共有30个氨基酸磷酸化位点,推测TaERF8-2D基因可能经过蛋白磷酸化修饰后,行使其响应盐胁迫等逆境胁迫的生物学功能。
前人研究表明,ERF类转录因子在响应植物盐胁迫方面扮演重要角色。本研究RT-PCR结果表明,盐胁迫处理后,TaERF8-2D表达被显著诱导,这与OsERF103、GmERF3、TaERF1、TaERF3等ERF类转录因子表达趋势相似[14,16,19,26],暗示TaERF8-2D基因在小麦盐胁迫响应过程中可能发挥重要作用,但其具体调控机制仍有待于进一步研究。

