全糯性小麦济糯116的籽粒蛋白质组学分析
韩冉,毛凤鑫,程敦公,李豪圣,刘建军,曹新有,宋健民,辛明明,郭军,刘成,刘爱峰
(1.山东省农业科学院作物研究所/农业部黄淮北部小麦生物学与遗传育种重点实验室/小麦玉米国家工程实验室,山东 济南 250100;2.中国农业大学农学院,北京 100193)
小麦籽粒淀粉由直链淀粉和支链淀粉组成,淀粉的合成主要由可溶性淀粉合成酶和颗粒结合淀粉合成酶负责。其中颗粒结合淀粉合成酶与直链淀粉的合成密切相关,该酶又称Wx蛋白。六倍体普通小麦含有Wx-A1、Wx-B1和Wx-D1三种Wx蛋白亚基,分别由位于染色体7AS、4AL和7DS上的Wx-A1、Wx-B1和Wx-D1基因编码。同时含有3个Wx蛋白亚基基因的小麦为普通小麦;缺失1或2个Wx蛋白亚基基因的突变体称为部分糯小麦[1,2];同时缺失3个Wx蛋白亚基基因的突变体称为糯性小麦[3,4]。糯小麦具有独特的高支链淀粉和麦谷蛋白,加工特性独特,营养品质好,是一种新食品开发的优质原粮。
糯小麦是一种新小麦类型,籽粒贮存淀粉中支链淀粉含量≥99%。目前,对于糯小麦的研究主要集中于加工品质、淀粉结构特征、贮藏淀粉合成机制等方面[5-8]。虽然六倍体小麦中的3个Wx基因已被克隆[9],但这些基因尚不能完全解释小麦淀粉糯性变异的机制[10,11]。本研究利用TMT(tandem mass tags)定量蛋白质组学技术,结合小麦最新基因组(iwgsc_refseqv1.0 2018)注释信息[12]和UniProt蛋白数据库[13],快速高通量地鉴定2个糯性不同小麦种子中蛋白差异表达情况,并通过生物信息学分析方法,对差异表达蛋白进行功能和通路等富集分析,以期挖掘影响籽粒糯性的潜在新基因,为小麦品质改良提供理论参考。
1 材料与方法
1.1 试验材料
全糯性小麦品种济糯116(JN116)由山东省农业科学院作物研究所培育,其Wx蛋白的Wx-A1、Wx-B1和Wx-D1亚基均为缺失突变型,支链淀粉含量接近100%。以非糯性小麦品种济麦22(JM22)为对照。供试材料种植于山东省农业科学院济南试验基地,收获后选取饱满一致的籽粒保存于-80℃备用。
1.2 试验方法
1.2.1 种子蛋白提取 称取适量籽粒样品至预冷的研钵中,研磨至粉末,加入4倍体积酚抽提缓冲液(1%蛋白酶抑制剂和2 mmol/L EDTA,10 mmol/L二硫苏糖醇),超声裂解。加入等量的Tris平衡酚,5 500×g、4℃离心10 min,加入5倍的0.1 mol/L乙酸铵/甲醇沉淀12 h,分别用甲醇和丙酮进行洗涤。用8 mol/L尿素溶解后利用BCA试剂盒测定蛋白浓度。
1.2.2 胰酶酶解 在蛋白溶液中加入二硫苏糖醇,浓度调至5 mmol/L,在56℃下放置30 min。加入碘代乙酰胺使其浓度为11 mmol/L,室温黑暗环境培养15 min。然后将样品的尿素浓度稀释至2 mol/L以下。按照1∶50的质量比例(胰蛋白酶∶蛋白)加入胰蛋白酶,37℃消化过夜。然后以1∶100的质量比例(胰酶∶蛋白)加入胰蛋白酶并继续酶解4 h。
1.2.3 高效液相色谱(HPLC)分级及液相色谱-质谱联用分析 肽段用高pH反向HPLC分级,然后注入到NSI离子源中进行电离,再进入Orbitrap Fusion Lumos质谱进行分析。该试验由杭州景杰生物科技有限公司完成。
1.3 数据分析
1.3.1 差异蛋白筛选 将各个样本的相对定量值取log2(以使得数据符合正态分布),然后用双样本双尾t检验方法计算两个样本中蛋白的差异表达显著性(P值)。当P<0.05时,以差异表达倍数变化超过1.5作为显著上调的变化阈值,小于0.67作为显著下调的变化阈值。
1.3.2 差异蛋白的注释及功能分析 利用Uni-Prot-GOA数据库 (http://www.ebi.ac.uk/GOA/)进行GO蛋白质组注释。Wolfpsort(https://wolfpsort.hgc.jp/)用于预测差异表达蛋白的亚细胞定位。根据KEGG网站(http://www.genome.jp/kegg/)分类注释KEGG通路。采取聚类分析法研究差异蛋白在KEGG通路、蛋白结构域和GO等特定功能上的差异以及关联性[14]。
2 结果与分析
2.1 小麦籽粒蛋白鉴定
测序结果显示:济糯116共获得5 423个蛋白,济麦22共获得5 417个,根据蛋白质丰度水平差异倍数为1.5以上且P<0.05的条件对济糯116和济麦22籽粒质谱鉴定获得的蛋白进行筛选,共获得161个差异表达蛋白,其中上调蛋白59个、下调蛋白102个(图1)。

图1 济糯116和济麦22差异表达蛋白定量火山图
2.2 差异蛋白的亚细胞定位
对差异蛋白进行亚细胞定位发现,差异蛋白主要集中在叶绿体中,其次为细胞质和细胞外。细胞外下调蛋白数目(25)远大于上调蛋白数目(4);在叶绿体、细胞核、液泡和线粒体中,下调蛋白的数目也大于上调蛋白的数目(表1)。

表1 差异表达蛋白的亚细胞结构定位分布
2.3 差异表达蛋白的GO和KEGG分析
对2个小麦品种中鉴定出的161个差异蛋白进行GO富集分析,结果(表2)表明,在生物学过程中,差异蛋白基因主要富集在代谢过程(metabolic process,56)、细胞过程(cellular process,44)及单一细胞生物进程(single-organism process,43);单一细胞生物进程、生物调节(biological regulation)、对刺激的反应(response to stimulus)及定位(localization)中下调蛋白数目多于上调蛋白。在细胞组成中,差异蛋白基因主要富集在细胞(cell,29)、细胞器(organelle,20)中。在分子功能中,差异蛋白基因主要富集在催化活性(catalytic activity,56)和结合(binding,48)中。在细胞组成和分子功能中,胞外区(extracellular region)、分子功能调节(molecular function regulator)及营养储存库活性(nutrient reservoir activity)中下调蛋白的数目远大于上调蛋白,其中营养储存库活性的差异蛋白为醇溶蛋白、谷蛋白、燕麦蛋白等种子贮存蛋白(表3)。

表2 差异表达蛋白在GO二级分类中统计分布
在分子功能中,GO富集分析(图2)发现淀粉合成酶活性类[glycogen(starch)synthase activity]的蛋白差异倍数最大,其次为核糖体RNA N-糖基化酶活性类(rRNA N-glycosylase activity)和RNA糖基化酶活性类(RNA glycosylase activity)蛋白;酶调控活性类(enzymeregulatoractivity)和分子功能调控类(molecular function regulator)的蛋白数目较多,其次为酶抑制活性(enzyme inhibitor activity)、营养储存库活性(nutrient reservoir activity)等。
KEGG是连接已知分子间相互作用的信息网络,如代谢通路、复合物、生化反应等。通过KEGG富集,161个差异蛋白中有36个差异蛋白富集到13个代谢途径中。显著富集的有4条代谢途径(表4),包括核糖体(ribosome)、淀粉和蔗糖代谢(starch and sucrose metabolism)、氮代谢(nitrogen metabolism)和丙氨酸、天冬氨酸和谷氨酸代谢(alanine,aspartate and glutamate metabolism)。其中核糖体代谢途径中包含10个差异表达蛋白,这些蛋白均上调表达;淀粉和蔗糖代谢途径中有8个差异表达蛋白,其中6个上调,2个下调;氮代谢途径中包含3个下调蛋白;丙氨酸、天冬氨酸和谷氨酸代谢中包含4个下调蛋白。

表3 营养储存库活性类相关差异表达蛋白

图2 差异表达蛋白在GO功能分类中的分子功能富集分布气泡图
2.4 蛋白结构域富集分析
对于差异表达蛋白的结构域进行富集分析(图3)发现,上调蛋白质与淀粉合酶、催化结构域(starch synthase,catalytic domain)、核糖体蛋白L7Ae/L30e/S12e/Gadd45(ribosomal protein L7Ae/L30e/S12e/Gadd45)、50S核糖体蛋白L30e-样(50S ribosomal protein L30e-like)、糖基转移酶家族1(glycosyltransferase,family 1)有关。下调的差异蛋白与双功能抑制剂/植物脂质转移蛋白/种子存储螺旋结构域(bifunctional inhibitor/plant lipid transfer protein/seed storage helical domain)及双功能胰蛋白酶/α-淀粉酶抑制剂螺旋结构域(bi-functional trypsin/alpha-amylase inhibitor helical domain)等有关。
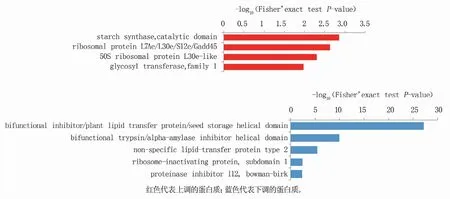
图3 济糯116与济麦22差异表达蛋白的蛋白质结构域富集分析
2.5 与淀粉合成相关的差异蛋白
通过KEGG分析发现淀粉和蔗糖代谢通路(starch and sucrose metabolism)中所涉及到的差异基因有8个,2个为下调蛋白(图4绿色部分),其登录号为A0A1D6BU17和Q9FUU6;6个为上调蛋白(红色部分),分别为A0A1D6BW01、A0A341XU21、Q2WGB1、A0A341V6U2、A0A341VM83、A0A1D5U5L3,其中A0A1D6BW01、A0A341XU21和Q2WGB1为淀粉合成酶(starch synthase);A0A341V6U2、A0A341VM83为α-1,4葡聚糖磷酸化酶L同工酶(alpha-1,4 glucanphosphorylase L isozyme);A0A1D5U5L3为1,4-α-葡聚糖分支酶(1,4-alpha-glucan-branching enzyme)(表4)。
3 讨论与结论
种子发育和成熟的过程也是贮藏物质逐渐累积的过程[15]。种子内的贮藏物质主要是蛋白质、脂肪、糖类及其他含氮物。本研究利用TMT技术对糯性小麦济糯116和非糯性小麦济麦22的成熟籽粒进行蛋白组分析,共获得161个差异表达蛋白,其中上调蛋白59个,下调蛋白102个。对差异蛋白进行亚细胞定位发现,位于叶绿体的差异蛋白数目最多。对差异蛋白进行功能分析表明,参与淀粉合成的蛋白差异倍数最大,这与两个供试品种在淀粉组成上存在较大差异有关。另外,核糖体代谢途径及淀粉和蔗糖代谢途径中的差异蛋白最多,表明除淀粉和蔗糖代谢外,核糖体代谢也可能参与小麦糯性机制。
贮藏蛋白多存在于胚乳,包括麦谷蛋白、醇溶蛋白、燕麦蛋白、球蛋白等。贮藏蛋白与营养品质及食品加工品质密切相关[16]。差异蛋白分析发现营养储存库活性类相关差异表达蛋白包含多种贮藏蛋白(表3),其中P10387(高分子量麦谷蛋白亚基DY10)和A0A1D5S346(γ-醇溶蛋白)的表达量上调,表明济糯116籽粒中γ-醇溶蛋白和DY10的蛋白含量高于济麦22。但α-醇溶蛋白(A0A0K2QJX7、J7HT09、A0A0E3Z6M6、I0IT52和A0A0E3Z7G8)、燕麦蛋白(A0A1D6DC72和A0A341XLT1)等蛋白的含量低于济麦22。
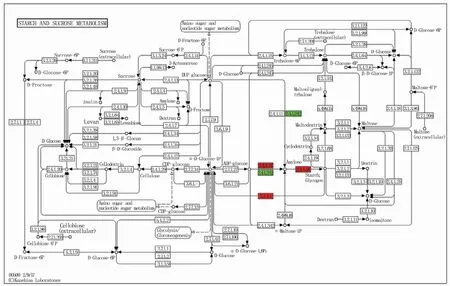
图4 淀粉合成通路中的差异蛋白
贮藏蛋白的生物合成依赖于氨基酸的合成和氮代谢[17]。谷氨酰胺与谷氨酸是氨基酸生物合成的基础物质,而谷氨酰胺合成酶(GS)在铵基转换为谷氨酰胺和谷氨酸的过程中发挥重要作用[18]。本研究发现差异蛋白中参与氨基酸代谢和氮代谢的蛋白均下调表达,且谷氨酰胺合成酶(Q6RUJ0)的表达量也下调。这表明在种子成熟后,济糯116的贮藏蛋白合成量低于济麦22。
在造粉体内,淀粉的合成是由ADPG焦磷酸化酶(EC 2.7.7.27)、淀粉合成酶(EC 2.4.1.21)、颗粒结合型淀粉合成酶(EC 2.4.1.242)、淀粉分支酶(EC 2.4.1.18)和淀粉去分支酶(EC 2.4.1.41)等多种酶协同作用,通过复杂的途径完成的[19]。其中淀粉分支酶是引入α-1,6分支键的唯一酶,在支链淀粉合成中起着重要作用,并与其他淀粉合成酶一起完成对淀粉多聚体的精细修剪[20]。颗粒结合型淀粉合成酶(EC 2.4.1.242)与淀粉粒特异性结合,使合成的直链淀粉保持未分支状态。本研究对糯性小麦济糯116和非糯性小麦济麦22蛋白组学比较发现淀粉分支酶(EC 2.4.1.18)的量上调,上调比率为1.810(A0A1D5U5L3);而颗粒结合型淀粉合成酶的量下调,下调比率分别为0.229(A0A1D6BU17)和0.308(Q9FUU6)。济糯116的Wx蛋白的Wx-A1、Wx-B1、Wx-D1亚基均缺失,这是导致颗粒结合型淀粉合成酶的量下调及支链淀粉含量上升的主要原因。除此以外,淀粉分支酶量的增加也是导致支链淀粉含量增加的一个原因。

