维吾尔药材菠菜子的DNA条形码鉴定及质量控制研究
沙拉麦提·艾力 汪波 陈亚飞

【摘 要】 目的:基于DNA條形码分子鉴定法建立维吾尔药材菠菜子的鉴定方法,并构建菠菜子HPLC指纹图谱和其指标性成分β-蜕皮甾酮的HPLC含量测定方法,为菠菜子的质量控制提供参考。方法:以核糖体DNA第二内部转录间隔区(ITS2)为主体条形码序列对菠菜子进行DNA条形码鉴定;采用Agilent ZORBAX SB-Aq C18 色谱柱(4.6mm×250mm,5μm),以甲醇(A)-0.2%磷酸溶液(B)为流动相梯度洗脱(0~10min,10% A;10~20min,10%→30% A;20~40min,30%→40% A;40~65min,40%→80% A),检测波长240nm,建立菠菜子的HPLC指纹图谱方法;采用Agilent ZORBAX SB-Aq C18 色谱柱(4.6mm×250mm,5μm),以甲醇(A)-0.2%磷酸溶液(B)为流动相梯度洗脱(0~15min,45%→40%A;15~25min,40%→80%A;25~30min,80%→45%A;30~45min,45%A),检测波长248 nm,建立指标性成分β-蜕皮甾酮的HPLC含量测定方法。结果:DNA条形码鉴定系统进化树显示,ITS2序列可将菠菜子与其近缘物种很好区分,且分支支持率达100%;HPLC指纹图谱标定7个共有峰,10批菠菜子药材与对照图谱的相似度均大于0.95;指标性成分β-蜕皮甾酮在6.115~122.304μg/mL范围内线性关系良好(r=0.9997),重复性试验 RSD<2.0%,加样回收率为 97.43%~103.59%,10批样品中β-蜕皮甾酮的含量为 0.099%~0.241%。结论:DNA条形码可准确鉴定菠菜子的基原,HPLC指纹图谱专属性强,结合指标性成分β-蜕皮甾酮的含量测定可以控制菠菜子药材的质量。
【关键词】 菠菜子;DNA条形码;β-蜕皮甾酮;含量测定:指纹图谱
Abstract:Objective Using DNA barcodes to identify Uygur medicine fruits of Spinacia oleracea L, establishing its HPLC fingerprint and measuring its content of β-ecdysterone, which provides a reference for the quality control of the Uygur medicine. Methods The second inside transcription silent region (ITS2) of S. oleracea as the main barcodes sequence was amplified with polymerase chain reaction (PCR). Agilent ZORBAX SB-Aq C18 chromatographic column (4.6mm× 250mm, 5μm) was used and the mobile phase consisted of methanol (A)-0.2% phosphoric acid solution (B) with gradient elution (0~10min,10% A; 10~20min, 10%→30% A; 20~40min,30%→40% A; 40~65min, 40%→80% A)at a flow rate of 1.0mL/min.The column temperature was 30℃ and the injection volume was 10μL, the detection wavelength was set at 240 nm. Besides, the analytical method of β-ecdysterone was validated usingthesimilar method besides the following gradient elution (0~15min, 45%→40% A; 15~25min, 40%→80% A; 25~30min, 80%→45% A; 30~45min, 45% A) and the wavelength of 240nm.Results The system evolutionary tree shows that ITS2 sequence can make it easy to distinguish the fruits of S. oleracea from the relate species, and the branch support rate is up to 100%. The HPLC method was developed for fingerprint and 7 common peaks were confirmed in 10 batch samples, the similarity is up to 0.95. In quality determination,the good separation and linearity (r=0.9997)was obtained for the β-ecdysterone in the range of 6.115~122.304μg/mL.The average recovery rates were 97.43%~103.59%(RSD<2.0%).Conclusion DNA barcode can identify fruits of S. accurately, and the fingerprint combination of the content of β-ecdysterone determination can be used to control and evaluate the quality of the fruits of S. oleracea.
Keywords:Fruits of Spinacia oleracea L; DNA Barcode; β-ecdysterone;Content Determination; Fingerprint
菠菜子为藜科菠菜属植物菠菜Spinacia oleracea L的干燥成熟果实,原产伊朗,在我国各地普遍栽培,其标准收载于《中华人民共和国卫生部药品标准维吾尔药分册》1998年版。在新疆,菠菜子作为传统的维吾尔医用药材,有调节异常胆液质,退热利尿,通便止痛之功效,常用于异常胆液质过盛,发烧不退,体弱,便秘,小便不利等病症[1-4]。《中华本草》记载,菠菜子含小龙骨素(polypodine),β-蜕皮甾酮(20-hydroxyecdysone),α-菠菜甾醇(α-spinasterol),豆甾烯醇(stigmastenol)和豆甾烷醇(stigmastanol)等成分[5]。
菠菜子的文献研究资料相对较少,其药材基原鉴定和质量控制的相关研究未见报道,目前菠菜子的鉴别主要依靠人用经验以及显微鉴别等基础鉴别手段鉴定,这些方法虽然操作简单,但具有较大的主观性,鉴定人员也需要有丰富的经验,因此,急需一个能够整体评价菠菜子药材质量并对其进行有效控制的科学分析方法。随着分子生物学的发展,DNA条形码已成为近年来国际上生物多样性研究的热点,能有效弥补传统鉴定方法的不足,区分亲缘关系较近的物种[6]。指纹图谱可以整体、宏观的表征被测样品主要化学成分的特征,经过多年的发展和应用,目前是公认的最适合中药及天然药物物质群质量控制的手段之一[7]。为了更好的控制菠菜子药材的质量,本研究对收集到的10批菠菜子药材进行了初步的DNA条形码分子鉴定研究,并结合HPLC指纹图谱研究和指标性成分β-蜕皮甾酮的HPLC含量测定研究,以期建立菠菜子的快速鉴定和质量控制方法,为更好的控制维吾尔族药材菠菜子的质量提供参考。
1 仪器、试药及样品
1.1 仪器 Bio-Rad T100型PCR仪(Bio-Rad公司),DYY-6C型凝胶电泳仪(北京六一生物科技有限公司),JX-FSTPRP-24型全自动样品快速研磨仪(天津市泰斯特仪器有限公司),Agilent 1260高效液相色谱仪(美国Agilent公司,DAD检测器),Agilent ZORBAX SB-Aq C18 色谱柱(4.6mm×250mm,5μm;美国Agilent公司),SYZ F 10L型超纯水制造系统(成都渗源科技有限公司);CP214电子天平(奥豪斯仪器上海有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料 快捷型植物基因组提取试剂盒(DP321,天根生化科技有限公司);鉴别引物委托由生工生物工程(上海)股份有限公司合成。甲醇(美国TEDIA,批号:20171017,色谱纯),磷酸(国药集团化学试剂有限公司,批号:20181019,分析纯),超纯水(实验室自制)。β-蜕皮甾酮对照品(批号:wkq19011007,四川省维克奇生物科技有限公司)。
1.3 样品 菠菜子样品于2016~2018年在新疆全区共收集,经中南民族大学药学院刘新桥副教授鉴定,为藜科菠菜属植物菠菜S. oleracea的干燥果实。
2.1 模板 DNA提取、PCR扩增反应及PCR产物检测参照“中药材DNA条形码分子鉴定法”(《中国药典》2015年版四部通则9107)。本研究利用新型广谱植物基因组DNA快速提取试剂盒提取DNA,采用NanoDrop 2000(Thermo Scientific,USA)测定OD260/OD280比值及DNA浓度。PCR扩增及测序的正向引物为5′-ATGCGATACTTGGTGTGAAT-3′,反向引物为5′-GACGCTTCTCCAGA CTACAAT-3′。30 μLPCR反应体系包括10×PCR缓冲液3μL,二氯化镁(25mM) 2.4μL,dNTP(10mm)0.6μL,鉴别引物(30μmol/L)各0.5μL,高保真Taq DAN聚合酶(5U/μL)0.2μL,模板1μL,无菌超纯水21.8μL。将离心管置PCR仪,PCR反应参数:95℃预变性4min,循环反应30次(95℃ 30s,55~58℃ 30s,72℃ 30s),72℃延伸5min。PCR产物纯化后使用ABI3730XL测序仪双向测序,测序峰图利用CodonCode Aligner V3.7.1(CodonCode Co., USA)校对拼接,将所有序列用软件MEGA 6.05分析比对,并用邻接(NJ)法构建系统进化树,采用bootstrap(1000次重复)检验各分支支持率。
2.2 菠菜子及其近缘物种系统邻接(NJ)树鉴别 菠菜ITS2序列数据来自收集样品和NCBI数据库;近缘物种ITS2序列来自NCBI数据库。菠菜子ITS2实验序列比对后长度均为214bp,所获得的序列中没有变异位点。基于ITS2序列构建藜科菠菜属菠菜子及同科滨藜属植物Atriplex suberecta(Genbank No.GQ465766.1, HM005862.1)、A.rosea(Genbank No.:HM005858.1)、A.hortensis(Genbank No.:HM005854.1)、A.dioica(Genbank No.:MG235264.1)、A.australasica(Genbank No.:EU331095.1)、A.praecox(Genbank No.:KX16675.1)、A.halimus(Genbank No.:KU555433.1)、A.cinerea(Genbank No.:HM005864.1)、A.rusbyi(Genbank No.:HM005865.1)、A.peruviana(Genbank No.:HM005867.1)、A.canescens(Genbank No.:FJ601827.1)、A.torreyi(Genbank No.:FJ601839.1),甜菜属植物Beta nana(Genbank No.:KP748063.1)、B.macrocarpa(Genbank No.:KP748157.1, KP748168.1)、B.vulgaris(Genbank No.:KP748111.1),盐节木属植物Halocnemun strobilaceum(Genbank No.:AY489241.1, KX282176.1),盐千屈菜属植物Halopeplis amplexicaulis(Genbank No.:AY489237.1)、H.perfoliata(Genbank No.:MH547482.1),棉藜属植物Kirilowia eriantha(Genbank No.:AY489209.1),雾冰藜属植物Bassia muricata(Genbank No.:AY489198.1)、B.prostrata(Genbank No.:AY489216.1,HM630029.1)、B.eriophora(Genbank No.:KX282036.1,KX282034.1)、B.indica(Genbank No.:HM630026.1)、B.scoparia(Genbank No.:AY489218.1, FJ599757.1),兜藜屬植物Panderia pilosa(Genbank No.:AY489227.1, DQ499335.1),绒藜属植物Londesia eriantha(Genbank No.:AY489220.1)的NJ树。结果表明滨藜属、波菜属、甜菜属、盐节木属、盐千屈菜属、棉藜属分别聚为一支。菠菜子ITS2序列单独聚为一支分支支持率达100%,表现出较好的单系性,能与同科近缘物种较好区分。ITS2序列可作为DNA条形码用于菠菜子及其近缘物种的准确鉴定。如图1所示。
3 指纹图谱
3.1 色谱条件 色谱柱:Agilent ZORBAX SB-Aq C18 4.6mm×250mm 5μm;流动相:甲醇(A)—0.2%磷酸溶液(B),梯度洗脱(0~10min,10% A;10~20min,10%→30% A;20~40min,30%→40% A;40~65min,40%→80% A),流速:1.0mL/min;柱温:30℃;检测波长:240nm;进样量:10μL。
3.2 供试品溶液的制备 取本品粉末(过三号筛)约0.5g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25mL,密塞,称定重量,加热回流30min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
3.3 方法学考察
3.3.1 精密度试验 取“3.2”项下供试品溶液(批号:S1)按“3.1”项下色谱条件连续进样6针,记录色谱图。以5号色谱峰为参照,经计算得到各共有峰的相对保留时间的RSD均小于0.9%,相对峰面积的RSD均小于2.1%,表明仪器的精密度良好。
3.3.2 重复性试验 取同一批次菠菜子样品(批号:S1)6份,按“3.2”项下方法平行制备供试品溶液6份,按“3.1”项下色谱条件连续进样,记录色谱图。以5号色谱峰为参照,经计算得到各共有峰的相对保留时间的RSD均小于1.0%,相对峰面积的RSD均小于3.5%,表明方法的重复性良好。
3.3.3 稳定性 取菠菜子样品(批号:S1)按“3.2”项下方法制备供试品溶液,按“3.1”项下色谱条件,分别在0、2、4、8、12、24h进样,记录色谱图。以5号色谱峰为参照,经计算得到各共有峰的相对保留时间的RSD均小于1.2%,相对峰面积的RSD均小于3.0%,表明供试品溶液在24h内稳定性良好。
3.4 不同产地菠菜子指纹图谱的建立 取10批菠菜子样品,按“3.2”项下方法制备供试品溶液,再按“3.1”项下色谱条件依次进样检测,记录色谱图。采用国家药典委员会“中药色谱指纹图谱相似度评价系统 2012.130723 版本”软件进行分析,以S1为参照图谱,对照图谱生成方法选择中位数法,选择时间宽度0.5,生成对照指纹图谱R,确定了7个共有峰,10批不同来源菠菜子指纹图谱如图2所示。各批样品与对照图谱的相似度分别为 0.969、0.982、0.958、0.997、0.983、0.983、0.994、0.996、0.996、0.976,相似度计算结果均大于0.950,表明相似度良好。
根据10批菠菜子的指纹图谱匹配结果,共匹配成功7个共有指纹峰,经过与β-蜕皮甾酮对照品比对定位,标定出1个色谱峰,为β-蜕皮甾酮(5号峰),如图3所示。
4 菠菜子中β-蜕皮甾酮含量测定HPLC方法学研究
4.1 溶液的制备
4.1.1 对照品溶液 取β-蜕皮甾酮对照品适量,精密称定,加50% 甲醇制成每1mL含β-蜕皮甾酮40μg的溶液,即得对照品溶液。
4.1.2 供试品溶液 取本品(批号:S1)粉末(过三号筛)约0.5g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25mL,称定重量,加热回流30分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过(0.45μm滤膜过滤),取续滤液,即得供试品溶液。
4.2 色谱条件 以十八烷基硅烷键合硅胶为填充剂;色谱柱:Agilent ZORBAX SB-Aq C18 4.6mm × 250mm 5μm;流动相:甲醇(A)—0.2%磷酸溶液(B),梯度洗脱(0~15min,45%→40%A;15~25min,40%→80% A;25~30min,80%→45% A;30~45min,45% A),流速:1.0mL/min;柱温:30℃;检测波长:248nm;进样量:10μL。理论板数按标准品计算应不低于5000。
4.3 系统适用性 取“4.1.1”项下的对照品溶液,按“4.2”项下色谱条件进样检测,重复测定6次,要求6次所得色谱图中峰面积的相对标准偏差(RSD)符合规定要求(RSD不得大于2.0%)。试验结果显示:重复进样6 针的系统适用性溶液中,理论塔板数按β-蜕皮甾酮峰计算平均值为6902;β-蜕皮甾酮峰面积的RSD为0.09%,结果符合系统适用性要求。
4.4 专属性試验
4.4.1 分离度考察 分别取“4.1.1”项下的对照品溶液,“4.1.2”项下的供试品溶液,按“4.2”项下色谱条件进样,供试品中β-蜕皮甾酮峰与对照品色谱峰保留时间一致,且与相邻峰的分离度大于1.5,色谱图如图4所示。
4.4.2 供试品 溶液配制方法的考察本研究参照《中国药典》2015年一部及相关文献资料中β-蜕皮甾酮HPLC检测方法中的供试品提取方法,分别以甲醇、乙醇、50%甲醇、50%乙醇为提取溶剂,设计了超声和回流两种提取方法,考察不同的提取溶剂及不同提取方法对含量测定的影响。
取本品(批号:S6)粉末(过三号筛)约0.5g,精密称定,置具塞锥形瓶中,按表2设计的提取溶剂和提取方法,分别配置供试品溶液。另取β-蜕皮甾酮对照品适量,按“4.1.1”项下的方法配置对照品溶液,按“4.2”项下色谱条件进样检测,记录色谱图,计算各提取溶剂和提取方法中β-蜕皮甾酮的含量。实验结果(见表2)显示,以50%甲醇和50%乙醇作为提取溶剂效果最好,且回流的效果明显要好于超声的效果,为避免检测时溶剂峰的干扰,最后选择以50%甲醇回流提取30min作为本品的供试品溶液配制方法。
4.5 检测限和定量 限取“4.1.1”项下的对照品溶液,倍比稀释,按“4.2”项下色谱条件进样,记录峰面积,当信噪比为3∶1时得检测限;当信噪比为10∶1得定量限。检测结果显示,β-蜕皮甾酮的检测限为1.4ng,定量限为4.1ng。
4.6 线性及范围 取β-蜕皮甾酮对照品适量,精密称定,加50%甲醇制成每1mL含β-蜕皮甾酮1mg的溶液,作为线性实验对照品贮备液,备用。分别取线性实验对照品贮备液0.15、0.25、0.50、1.0、1.5、2.5、3.0mL,分别置25mL容量瓶中,用50%甲醇稀释至刻度,摇匀,即得不同浓度的系列线性对照品溶液。取各不同浓度的线性对照品溶液,按“4.2”项下色谱条件进样检测。以各浓度对照品溶液峰面积为纵坐标,浓度为横坐标,做标准曲线,得到回归方程Y=14.078X+8.979(r=0.9997),在6.115~122.304μg/mL范围内线性关系良好,试验结果符合规定要求。
4.7 精密度試验 取“4.1.1”项下的对照品溶液,按“4.2”项下色谱条件检测,连续进样 6 次,记录色谱图,测得β-蜕皮甾酮峰面积的RSD为0.10%,表明仪器精密度良好。
4.8 溶液稳定性试验 精密吸取同一供试品溶液(批号:S1),按“4.2”项下色谱条件分别在 0、2、4、8、12、24h 进样,记录色谱图。β-蜕皮甾酮的峰面积相对标准偏差RSD为1.04%,符合规定要求,表明供试品溶液在24h内稳定。
4.9 重复性试验 取同一批次菠菜子样品(批号:S1)6份,按“4.1.2”项下方法平行制备供试品溶液6份,按“4.1”项下色谱条件连续进样,记录色谱图,测得β-蜕皮甾酮平均含量为0.97%,RSD为0.22%,表明方法重复性良好。
4.10 加样回收率试验 取6份已知含量的同一批次(批号:S1)菠菜子样品,精密称定,置具塞锥形瓶中,精密加入适量的β-蜕皮甾酮对照品溶液,按“4.1.2”项下的方法制备供试品溶液,按“4.2”项下色谱条件进样检,记录色谱图,计算回收率。结果β-蜕皮甾酮平均回收率为98.92%,RSD为1.49%,表明本方法的回收率良好,见表3。
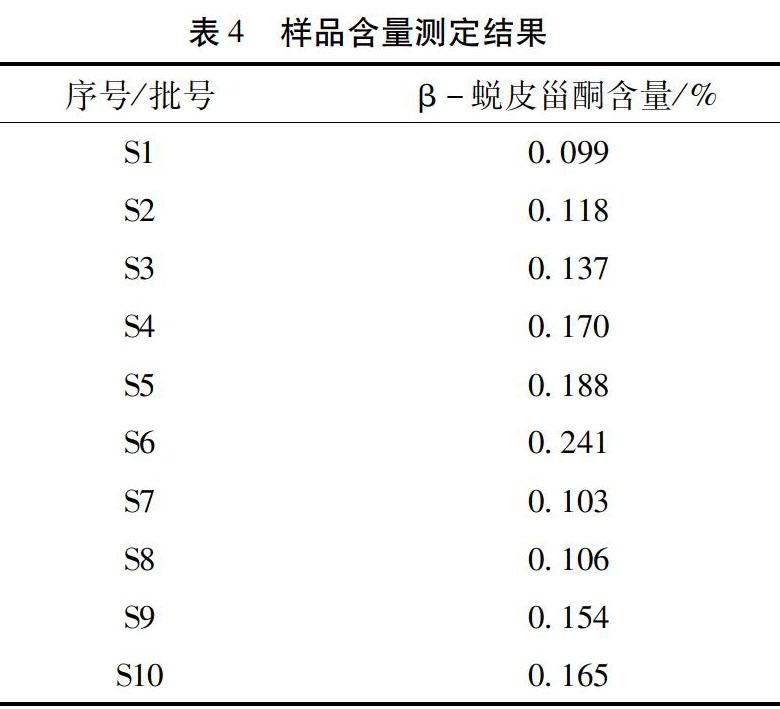
4.11 样品含量测定 取10批菠菜子样品,按“4.1.1”项的方法制备对照品溶液、按“4.1.2”项下的方法分别制备供试品溶液,按“4.2”项下色谱条件进样检测,记录色谱图,计算10批样品中的β-蜕皮甾酮的含量,检测结果见表4。
5 讨论
相比中药材,维吾尔药材来源更为复杂,在长期的用药过程中药材质量标准还有待进一步提高,药材监管难度颇大[8]。DNA条形码鉴定方法不依赖于专业人员的主观经验以及植物的形态特征,不受时间、气候等外界因素的影响,针对物种的遗传信息进行鉴定,因其操作简便、快捷,结果客观、准确可靠在中药材鉴定中广泛应用[9]。本实验研究发现,菠菜子ITS2序列单独聚为一支分支,具有良好的单系性,能与同科近缘物种较好区分,使用 ITS2序列即能实现维吾尔药材菠菜子及其同科近缘物种的鉴定,建立的DNA条形码技术可以追溯药材的基原,快速准确的鉴定维吾尔药材菠菜子,在今后药材来源、标准制定、药材流通和市场管理等实际应用中具有重要的价值。
菠菜子在维医理论中具有清利异常胆液质、退热利尿、通便止痛之功效[1],现代药理研究[11]发现菠菜子的水溶液能有效抑制二甲苯诱导的小鼠耳肿胀,缓解大鼠的棉球肉芽肿。β-蜕皮甾酮(蜕皮激素)作为是菠菜子药材的主要化学成分,现代药理研究发现其促进小鼠前成骨细胞体外增殖诱导成骨分化,并能通过介导β链蛋白信号转导通路改善骨关节炎小鼠的关节软骨损伤[12-14],与菠菜子的传统功效和现代抗炎作用相吻合。本研究首次建立10批不同来源菠菜子药材的 HPLC 指纹图谱,共标定出7个共有峰,并以主要化学成分β-蜕皮甾酮(5号峰)为参照峰,10批菠菜子药材的相似度均在0.9以上,所得图谱可以表征菠菜子药材的特征属性,可用于菠菜子药材的鉴定,亦为对菠菜子更准确全面的质量控制提供理论依据。
在指标性成分β-蜕皮甾酮含量测定的方法学研究中,本实验还进行了耐用性试验:①在其他色谱条件不变的情况下,考察流速为0.9mL/min、1.0mL/min、1.1mL/min时对-蜕皮甾酮分离效果的影响,试验结果表明当流速为1.0mL/min时,β-蜕皮甾酮色谱峰的出峰时间适中,对称性及分离度较最好。②在其他色谱条件不变的情况下,考察柱温为 28℃、30℃、32℃时对β-蜕皮甾酮分离效果的影响,试验结果显示当柱温为 28~32℃时,各主要色谱峰的峰型、分离度差异不大,结合实验的实际情况,最终选择常用的30℃作为色谱柱柱温。结果表明该方法稳定、专属性强、灵敏度高,适合用于菠菜子中β-蜕皮甾酮的含量测定。
参考文献
[1]中华本草编委会.中华本草:维吾尔药卷[M].上海:上海科学技术出版社,2005:332.
[2]顾永寿,顾永福,译.维吾尔医常用药材[M].新疆:新疆卫生出版社,1992:60.
[3]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,2005:332.
[4]张继, 周谧, 李冰岚,等.蒺藜与菠菜子的形态组织学比较研究[J]. 药物分析杂志, 2007, 27 (1) :48.
[5]中华本草编委会.中华本草:第二卷[M].上海:上海科学技术出版社,1999:1477-1479.
[6]陈士林, 姚辉, 韩建萍, 等.中药材DNA 条形码分子鉴别指导原则[J].中国中药杂志, 2013, 38(2):141.
[7]姚令文,刘燕,郑笑为,等.指纹图谱、特征图谱技术在中药材和中成药中的应用[J].中国新药杂志,2018,27(8) :934-939.
[8]茹克娅·胡加阿不都拉,阿依加玛丽.试探当前维吾尔药材质量问题[J].中国民族医药杂志,2011,17(3):34-35.
[9]陈士林.中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015:3-4,92-93,122-123.
[10]刘鸿雁,李波,郝宝成,等.菠菜子水提取物的抗炎活性及急性毒性实验研究[J].亚太传统医药,2020,16(4):29-31.
[11]严才平,陈路,邓长弓,等.β-蜕皮甾酮促进小鼠前成骨细胞体外增殖及诱导成骨分化[J].中国组织工程研究,2020,24(29):4605-4612.
[12]汤样华,徐灿达,岳振双,等.β-蜕皮甾酮抑制IL-1β诱导的关节软骨细胞退变的实验研究[J].中国中医药科技,2020,27(3):366-369.
[13]汤样华,辛大伟,岳振双,等. β-蜕皮甾酮介导β链蛋白信号转导通路对膝骨关节炎小鼠关节软骨损伤的影响[J].中国临床药理学杂志,2020,36(1):47-49.

