一株布顿大麦内生真菌的分类鉴定及生物学和生理特性研究
张恩会,于晓涵,2,达永庆,赵艳萍,万国安,徐泽馨,陈水红
(1.塔里木大学生命科学学院 塔里木盆地生物资源保护利用兵团重点实验室,阿拉尔 843300;2.西南大学生物技术中心,重庆400700)
禾草内生真菌指在宿主禾草体内完成全部或部分生活史不表现外部症状的真菌[1]。20世纪80年代初,人们对内生真菌与宿主的共生关系研究才真正受到重视[2]。禾草—内生真菌共生体的双重特性已经成为近30年来研究的热点领域之一。关于禾本科内生真菌提高宿主植物生长和抗性的研究较多。如南志标等[1]研究表明布顿大麦内生真菌的入侵能增强植株的生长和分蘖能力。有研究表明,内生真菌有利于提高宿主的耐盐性[3,4]、耐重金属性[5]、抗虫[6]、抗病[7]、耐旱[8]等特性,进一步提高禾草竞争性[9]、维持生态系统[10,11]等功能。关于禾草内生真菌生物学和生理特征的研究表明,菌株对碳源和氮源的利用能力存在较大差异[12],在不同培养基渗透势下的生物量[13]、生长速率和产孢特性也存在差异[14]。布顿大麦(HordeumbogdaniiWilensky)分布于中国青海、新疆、甘肃等地。一般散生在滩地、河谷等类型的草地上,形成茂盛的株丛[15],营养价值高,适口性好,能促进幼畜发育,提高母畜受胎率,是家畜增膘、提高成活率的良好饲草[15,16]。前期研究发现该草耐盐碱性较强,在新疆可获得高产,对于改良盐碱地有重大意义[17]。课题组前期研究得出内生真菌在盐碱胁迫下具有促进布顿大麦生长的有益作用,且明显改善宿主耐盐碱的生理指标[18,19],而对其内生真菌的具体生物学和生理学特性还是未知。因此,本试验对分离自新疆阿克苏地区温宿县的布顿大麦内生真菌WS1的生物学、生理学特征进行了研究,旨在更好的鉴定新疆布顿大麦内生真菌不同生理条件下的差异性,为布顿大麦共生体创新种质资源,选育优良抗逆牧草新品种奠定基础。
1 材料与方法
1.1 试验材料
1.1.1样品来源 2018年6月采于新疆阿克苏地区温宿县,取完整植株和种子,检测是否带有内生真菌。检测方法分别用以下两种:茎髓检测法,取植株叶鞘部位用解剖刀斜向剖开,刮取少许髓质,加入0.8%乳酸苯胺蓝染液染色,静置片刻,光镜下检测内生真菌菌丝,统计内生真菌带菌情况;种子检测法,在室温条件下(15℃~22℃)将种子置于5%氢氧化钠溶液过夜,第2d用蒸馏水冲洗种子数次以去除种子表面的氢氧化钠,然后将种子置于有苯胺蓝溶液的培养皿中静置2h,镜检前将种子外稃去除。将种子放置到载玻片上,用盖玻片轻按使种子糊粉层和种皮分离,在40倍目镜下观察内生真菌菌丝,如果种皮或糊粉层中出现大量的深蓝色菌丝,就认为该种禾草感染内生真菌,每种禾草种子检测量为20粒。
1.1.2培养基 分离、纯化内生真菌采用马铃薯葡萄糖琼脂(PDA)培养基;生理学测定培养基为基本培养基、 碳源培养基、氮源培养基、PDA培养基;生物学测定培养基为布顿大麦粉琼脂培养基(HMA)、燕麦粉琼脂培养基(OMA)、水琼脂培养基(WA)、海水营养琼脂培养基(SNA)。
1.2 实验方法
1.2.1内生真菌的分离和纯化 根据李春杰(2008)[20]的方法分离和纯化布顿大麦内生真菌。具体操作为将带菌布顿大麦的茎秆用自来水冲洗后切成小段,依次用75%乙醇杀菌30~40s,2%的次氯酸钠漂洗3~5min,无菌水漂洗4次后置于PDA平板上于24℃黑暗培养,约1~2周后茎秆切口长出内生真菌菌落。挑取菌落菌丝进行培养,待内生真菌产孢后,挑取单个孢子进行纯培养。
1.2.2内生真菌DNA提取方法 使用真菌DNA提取试剂盒(D3195-01,OMEGA公司)提取本研究所分离纯化的内生真菌DNA。
1.2.3内生真菌管家基因tefA和tubB的PCR扩增和测序 提取内生真菌全基因组后,参照Moon等的文献[21],分别用tefA(5'-GGGTAAGGAC GAAAAGACTCA,3'-CGGCAGCGATAATCAGGA TAG),tubB(5'-GAGAAAATGCGTGAGATTGT,3'-GTTTCGTCCGAGTTCTCGAC)2对引物对内生真菌基因组进行聚合酶链式反应(PCR)扩增。PCR反应体系为25μL体系:12.5μL 2×Taq MasterMix mix(包含1.0U Taq DNA聚合酶,1.5mM MgCl2,200mM各dNTP),1μL上游引物(10μM),1μL下游引物(10μM),8.5μL ddH2O以及2μL DNA模板(40ng/μL)。PCR反应条件:94℃预变性3min,(94℃变性30s,tefA55℃、tubB54℃退火30s,72℃延伸1min),以上括号中的步骤共30个循环,最后72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳检测后,委托北京睿博兴科生物公司测序(ABI 3730xl DNA analyser)。
1.2.4试验设计和方法
1.2.4.1不同pH值培养基 用盐酸和氢氧化钠调节PDA培养基的pH值为5、7、9和11,于25℃黑暗培养。
1.2.4.2碳源和氮源培养基 碳源处理为在基本培养基里加入KNO32g,再分别加入不同的碳化合物各20 g。氮源处理为基本培养基里加入葡萄糖20g,再分别加入不同的氮化合物2g。
1.2.4.3内生真菌生长与产孢量测定方法 每周用十字交叉法测量一次菌落直径,连续测量4周。第6周随机选取8个重复用体视生物显微镜(尼康Ci-l)测定菌丝、分生孢子梗、分生孢子的大小,并统计产孢量。
1.2.5WS1菌株分类鉴定
1.2.5.1形态学鉴定 观测PDA培养基上的菌落生长速度、大小、菌落纹饰、质地、边缘、分生孢子大小、孢子梗长短和产孢量等,进行初步分类。
1.2.5.2分子鉴定 提取纯化菌株WS1的DNA,用基因tefA和tubB引物扩增,将扩增产物进行电泳,回收片段连接于PMD18-T载体并转入大肠杆菌DH5α。每个样本选择3~5个阳性克隆进行测序。将测序结果在NCBI用Blast n比对,下载相似性高的内生真菌代表性序列,用MEGA 10.1.7处理序列和邻接法(NJ)建立系统发育树,输入最佳模型参数,采用1000次的随机重复取样。
2 结果与分析
2.1 布顿大麦内生真菌WS1在不同碳源中的生长情况
不同碳源中的菌落正面均呈白色,菌落近圆形,背面呈褐色。其中,除基本培养基、淀粉和乳糖碳源中菌丝较稀疏外,其余供试碳源中菌丝都很致密。在菊糖、麦芽糖、乳糖、葡萄糖等碳源的菌落呈现不规则凸起,而基本培养基和淀粉碳源中菌落较为平坦。除了葡萄糖、甘露醇、蔗糖和果糖碳源中无菌丝徒长现象外,其余供试碳源中均有徒长现象。从表1结果得出菌落直径的排序为:淀粉>甘露醇>蔗糖>山梨醇>乳糖>麦芽糖>果糖>葡萄糖>菊糖>基本碳源。该真菌在供试9种碳源上的菌落直径均大于基本培养基,除葡萄糖和菊糖外,其余都显著高于基本培养基(P<0.05)。各种碳源培养基中孢子长宽范围分别为0.024~0.045mm,0.021~0.045mm;孢子梗长宽范围分别为0.054~0.1855mm,0.017~0.031mm。乳糖碳源中孢子长宽最长(P<0.05),其产孢量也是最多,在淀粉碳源培养基中几乎不产孢。

表1 9种碳源培养基中WS1第六周的孢子、孢子梗直径、菌落直径、产孢特性
2.2 布顿大麦内生真菌WS1在不同氮源中的生长情况
在不同氮源中该菌菌落颜色为白色,菌落圆形,菌丝浓密,背面呈乳白色,中央棕黄。在蛋白胨、胰蛋白胨和酵母提取物氮源中菌落外周出现圈晕。L-脯氨酸和L-亮氨酸氮源中无菌丝徒长现象。由表2可以看出添加氮源后菌落直径均显著高于对照基本氮源的菌落直径,说明该菌能够利用5种供试氮源,其中酵母提取物和脯氨酸菌落直径最大。氮源培养基中孢子长宽范围为:0.029~0.035mm,0.024~0.050mm;孢子梗长宽范围为:0.129~0.255mm,0.027~0.032mm,其产孢量显示此内生真菌在胰蛋白胨和酵母提取物为氮源时产孢量较多。
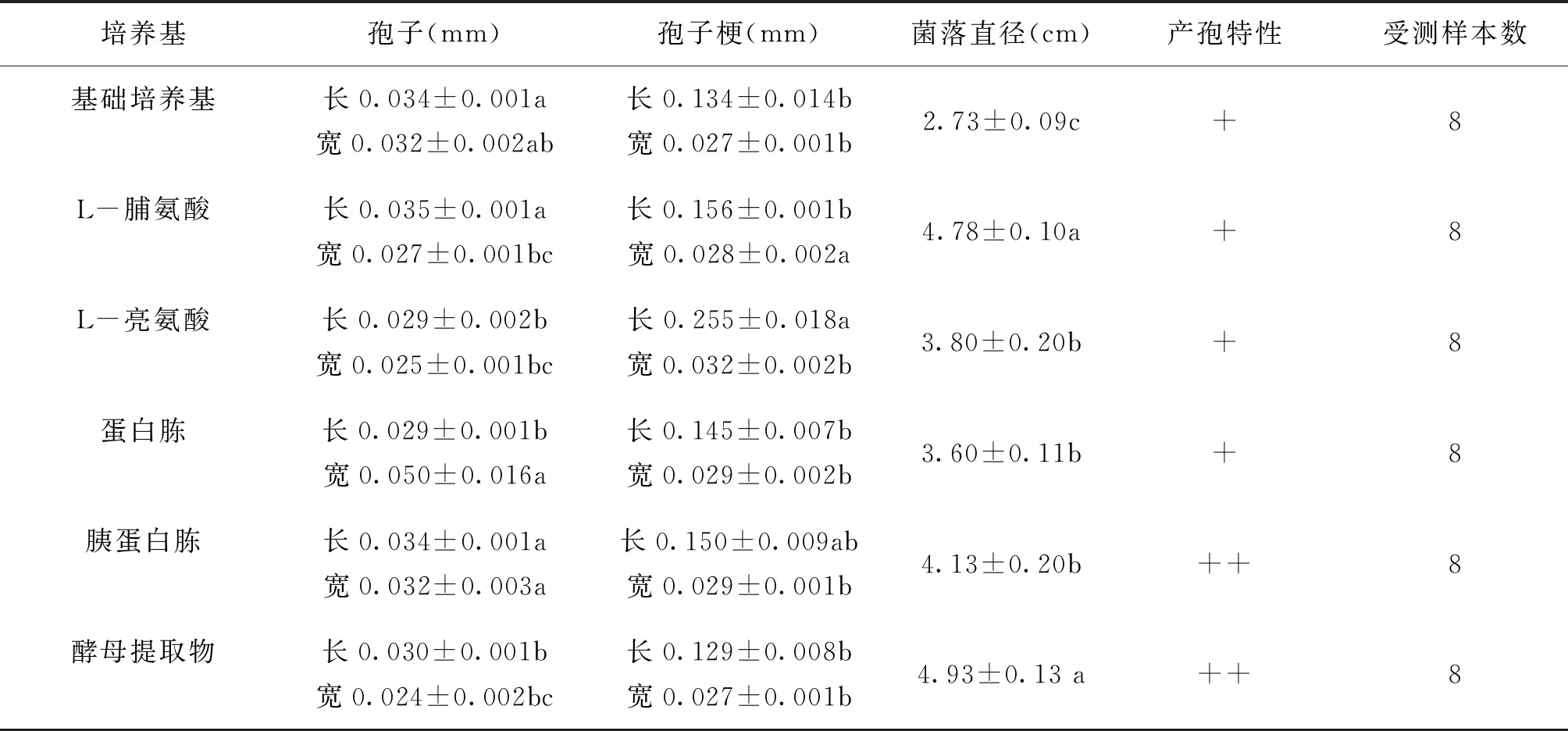
表2 5种氮源培养基中WS1的孢子、孢子梗直径、菌落直径、产孢特性
2.3 布顿大麦内生真菌WS1在不同pH中的生长情况
菌落生长情况见表3所示,在pH 5~11 的范围均落均能生长和产孢,在pH7和pH9的PDA培养基中此真菌菌落直径最大(P<0.05),因此pH 7~9范围为其最适pH。孢子长宽范围分别为:0.044~0.050mm,0.026~0.030mm;孢子梗长宽范围分别为:0.171~0.256mm,0.022~0.024mm。pH11其产孢量最多(表3)。

表3 不同pH梯度培养基中WS1第六周的孢子、孢子梗直径、菌落直径、产孢特性
2.4 布顿大麦内生真菌WS1在不同生物学培养基中的生长情况
WS1菌株在5种培养基内均能够生长,菌丝白色,近圆形,但只有布顿大麦草粉培养基内的菌落菌丝均匀致密,其他4种均有菌丝徒长现象。由表4可知,该菌在5个生物学培养基的菌落直径依次为:燕麦粉培养基>海水培养基>PDA培养基>布顿大麦草粉培养基>水琼脂培养基。孢子长宽范围为0.047~0.052mm,0.023~0.028mm;孢子梗长宽范围为:0.156~0.205mm,0.021~0.025mm。其产孢量显示其在宿主布顿大麦草粉培养基中产孢最多。

表4 不同生物学培养基中WS1第六周的孢子、孢子梗直径、菌落直径、产孢特性
2.5 WS1分类鉴定结果
用苯胺蓝对布顿大麦植株叶鞘染色,显微镜下可见蓝色菌丝(图1a)即为带菌植株,用带菌植株茎秆分离内生真菌,获得纯化菌株WS1(图1b)。WS1生长缓慢,25℃黑暗条件下培养6周菌落直约4cm左右,菌落呈圆形,中间突出四周平展,绒毡状,颜色呈白色,菌丝白色,有隔。分生孢子白色至浅黄色,近短圆柱形或球状,表面不具疣,无隔膜,孢子生于分生孢子梗的顶端,大小为0.022~0.028mm×0.019~0.023mm。分生孢子梗呈白色,直立,大小0.105~0.207mm×0.0145~0.0185mm(图1c)。可见,分离的内生真菌具备生长速度较慢、菌落正面白色、分生孢子着生在分生孢子梗顶端等特性,符合Epichloё 属内生真菌菌落的基本特征,初步确定分离所得内生真菌为Epichloё属内生真菌。

图1 WS1菌株的菌丝、菌落及孢子图
对菌株WS1用转录延长因子tef引物扩增获得一条805bp的基因序列,经序列比对分析,结果显示菌株WS1的tef序列与Neotyphodiumsp.和Epichloёbromicola的tef序列同源性分别为99.87%和98.32%。基于tef序列同源性构建的系统发育进化树显示,菌株WS1以84%的支持率与Neotyphodiumsp.和Epichloёbromicola聚在一大支上(图2)。此外,采用微管蛋白tub为引物进行DNA序列扩增,获得一条922 bp基因序列,序列比对分析结果表明,菌株WS1的DNA序列与登录号分别为KX219728、KP877325的E.bromicola、Epichloё sp.DNA序列同源性分别为99.88%和99.78%,基于tub序列同源性构建的系统发育进化树如图3所示,菌株WS1与E.bromicola、Epichloё sp.聚在一个分支上。结合形态学鉴定结果,将菌株WS1鉴定为Epichloёbromicola。
3 结论与讨论
据前期研究发现布顿大麦植株的耐盐碱性与其所带的内生真菌相关[3,4],因此本实验针对分离自新疆阿克苏地区温宿县的这株布顿大麦内生真菌WS1进了生物学与生理学特征研究。结果表明,布顿大麦内生真菌WS1对不同的碳源利用能力不同,9种供试碳源中此真菌能很好的利用淀粉、甘露醇、蔗糖,其次为山梨醇、乳糖、麦芽糖、果糖,供试碳源中内生真菌生长速度均高于基本培养基,这与目前报道的醉马草禾草内生真菌利用碳源能力:蔗糖>葡萄糖>乳糖>山梨醇>菊糖>麦芽糖>甘露醇>淀粉>果糖有差异[20],与陈泰祥等[22]研究甘肃临泽的野大麦内生真菌吸收能力最强的碳源是麦芽糖也不同。这说明禾草内生真菌,由于其宿主不同、地域气候差异,其生物学特性存在差异。
WS1可利用供试的5种氮源,被试氮源中,该内生真菌能更好利用脯氨酸和酵母提取物,与以下研究结果相似:醉马草内生真菌和中华羊茅内生真菌最适氮源分别是酵母膏[20]和酵母浸液[14],高羊茅内生真菌最适氮源是L-脯氨酸[20]。本实验得出胰蛋白胨做氮源时产孢量较好,这与陈泰祥等[22]对甘肃临泽野大麦内生真菌WBE1的研究结果吻合。此真菌在无氮源的基础培养基上也可缓慢生长,6周后菌落直径达到2.73cm,说明该菌株有较发达的氮代谢途径,此结果与陈泰祥等的结论一致。
WS1在pH 5~11均可生长说明其对酸碱性的适应能力良好,但在pH11的PDA培养基上生长速度慢,菌丝出现褐化现象,其最适生长的pH范围为7~9,结果与金文进等[14]研究中华羊茅内生真菌其适宜的pH是7~9的结果一致,与野大麦内生真菌WBE1的最适pH范围为5.09~6.10不相符合,推测该菌生长在中性偏碱性环境与宿主布顿大麦适应盐碱环境有关,真菌长期与宿主共生,受植物长期生活的盐碱自然生态环境影响,它也适应了盐碱环境,因而其最适pH偏碱性。
在燕麦粉培养基(OMA)、海水培养基(SNA)、PDA培养基、布顿大麦草粉培养基(HMA)、水琼脂培养基(WA)5种生物培养基中,该菌都可以生长。其中在OMA和SNA上的菌落最大,OMA培养基中有丰富的纤维素为菌株的生长提供碳源,这与陈泰祥等[22]的研究结果相似,在SNA中生长最快,也再一次验证了此菌适应中性偏碱性环境。
本研究对分离自新疆阿克苏温宿县的布顿大麦内生真菌WS1进行了生物学和生理学特性研究,并对此菌进行了形态学和分子鉴定。得到该菌对不同碳氮源的利用存在差异,淀粉碳源中菌落长的最快,乳糖碳源中孢子长宽最长,产孢量最多;在酵母提取物和脯氨酸氮源上长势最好;生长的最适pH为7-9;在OMA和SNA上生长最快,HMA上产孢最多;分类鉴定结果表明WS1属于Epichloёbromicola。实验结果为布顿大麦共生体创新了种质资源、选育优良抗逆牧草新品种奠定基础。

