鞘细菌对铬离子的吸附特性分析
邓加聪,蔡清晓,林新颖,郑虹
(福建技术师范学院a.食品与生物工程学院;b.近海流域环境测控治理福建省高校重点实验室,福建福清 350300)
随着工业技术的迅速发展,染料、冶炼、医药等工业排放大量的工业废水,水中铬污染日益严峻,使含铬废水的处理倍受关注.六价铬是对人类污染较高的污染物之一,六价铬对人体具有很大的危害,主要表现为致癌、刺激、造成遗传基因缺陷等[1-3].
吸附法、化学共沉淀法、离子交换法等[4-6]是含铬废水的主要治理方法.其中新兴的生物吸附法[7]受到人们愈来愈多的关注,而农林废弃物和一些微生物均可作为生物吸附法的材料.杨爽等[8]以花生壳为原料制备花生壳活性炭,改性后的活性炭对铬离子吸附可达97%.对铬离子吸附的微生物主要有细菌、藻类和真菌等[9-10].魏长浩等[11]研究发现某些藻类对铬离子的吸附率可达95%左右.梁敏敏等[12]研究发现,酵母菌对铬离子的等温吸附符合Freundlich模型,且具有良好的吸附性能.
文章从活性污泥中分离的一株鞘细菌为实验材料,该菌株对多种重金属具有较强的吸附能力[13-14].该课题研究了鞘细菌对模拟废水中铬离子的吸附;研究了菌株吸附铬离子的热动力学,探讨鞘细菌吸附六价铬离子的吸附模型.以期得到鞘细菌对铬离子吸附的最佳条件和机理,为今后鞘细菌治理含铬污水提供一定的理论指导.
1 实验材料与方法
1.1 主要仪器材料
材料:鞘细菌(Sheath bacteria).
试剂:1000 μg/mL铬离子标准液、氯化铜、氯化锌、重铬酸钾、氢氧化钠、甘油等分析纯试剂,购自上海阿拉丁生化科技股份有限公司.
培养基:试管斜面(g/L):胰蛋白胨 5 g、丙三醇 10 g、酵母粉 1 g、琼脂粉 20 g、 pH 7.0;种子培养基(g/L):尿素 0.5 g、硫酸镁0.05 g、葡萄糖1 g、磷酸氢二钾 0.1 g、自然pH值.
仪器:NICOLET380傅里叶变换红外光谱仪
美国尼高力公司;Q250扫描电镜 美国FEI公司;WFX-130B火焰原子吸收分光光度计 北京北分瑞利分析仪器(集团)有限责任公司;TG16台式高速离心机 上海卢湘仪离心机仪器有限公司;GL-20.5M高速冷冻离心机 上海卢湘仪离心机仪器有限公司;LDZX-50L立式压力灭菌器 上海申安医疗器械厂;NRY2012C恒温培养振荡箱 福州精科仪器仪表有限公司.
1.2 实验方法
1.2.1 菌株的活化及吸附材料的制备
将菌株接种于试管斜面,30 ℃下培养36 h;挑2环菌体接种到新鲜的种子培养基,180 r/min 30 ℃培养48 h;培养液5 000 r/min离心10 min,收集菌体,无菌盐水制备成2 g/L的菌悬液,即为吸附材料.
1.2.2 共存金属离子对菌株吸附铬离子的影响
50 mL三角瓶中装有20 mL含有30 mg/L铬离子浓度、30 mg/L铬离子浓度+30 mg/L锌离子浓度、30 mg/L铬离子浓度+30 mg/L铜离子浓度的模拟废水,加入制备好的吸附材料1 mL,30 ℃下振荡吸附一定时间,测定溶液中铬离子的浓度,计算吸附量.
1.2.3 菌株吸附六价铬离子的单因素实验
50 mL三角瓶中装有20 mL含有不同铬离子浓度的含铬模拟废水,用0.1 mol/L盐酸或氢氧化钠将溶液pH值调至不同梯度,加入制备好的吸附材料1 mL,不同吸附时间,不同吸附温度下振荡吸附,测定溶液中铬离子的浓度,计算吸附量及去除率.
1.2.4 菌株对六价铬离子吸附的正交设计实验
采用L9(34)正交设计对吸附实验进一步优化.其因素和水平见表1.

表1 正交设计实验的因素与水平
1.2.5 鞘细菌对六价铬离子吸附的热力学研究
菌株吸附铬离子的热力学研究采用Langmuir等温吸附方程和Freundlich等温吸附方程来进行拟合[15].
含有不同铬离子浓度(铬离子的浓度为:0、3、5、10、15、20、30、50、70 mg/L) 的 20 mL溶液中,加入吸附材料1 mL,分别在4种不同实验温度下,180 r/min振荡吸附30 min,测定溶液中铬离子的浓度.
1.2.6 鞘细菌对六价铬离子吸附的动力学研究
鞘细菌吸附铬离子的动力学采用准一级动力学模型和准二级动力学模型进行拟合[16].
含有30 mg/L铬离子初始浓度的20 mL溶液中,加入吸附材料1 mL,分别在4种不同实验温度下,180 r/min振荡吸附不同时间,测定溶液中铬离子的浓度.
1.3 分析方法
铬离子的质量浓度采用火焰原子吸收分光光度计法进行测定[17-18].
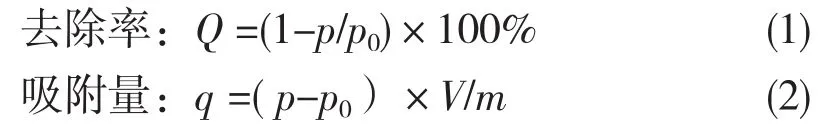
式中:p0、p分别为吸附前、后铬质量浓度,mg/L;m为吸附材料的质量,g;V为吸附溶液的体积,mL.
菌株对六价铬离子吸附前后的菌体表面形貌变化采用SEM进行观测;吸附前后菌体官能团的变化采用FTIR进行分析;实验数据采用origin 8.0和excel2003软件进行处理分析.
2 结果与讨论
2.1 铬离子竞争吸附实验
为研究废水中存在其他金属离子时,菌株对铬离子的吸附效果,进行了共存离子对菌株吸附铬离子的影响.结果见图1.

图1 共存离子对菌株吸附铬离子的影响
由图1可见,当溶液中只有铬离子,吸附时间为150 min时,菌株对铬离子的吸附达到最佳 ,此时吸附量可达1.94 mg/L;当溶液中有锌离子或者铜离子存在时,菌株对铬离子的最佳吸附时间为 180 min,此时菌株对铬离子的吸附量分别为1.89 mg/L和1.50 mg/L,表明溶液中有铜离子或锌离子存在时,不仅减缓了菌株对铬离子的吸附速率,同时抑制了菌株对铬离子的吸附.
2.2 单因素吸附实验
2.2.1 铬离子初始质量浓度对菌株吸附铬离子的影响
为了研究重金属浓度对吸附效果的影响,铬离子的浓度梯度为 5、10、15、20、25、30、35、40、45、50 mg/L.结果见图2.

图2 铬离子初始质量浓度对铬离子吸附的影响
由图2可知,菌株对铬离子的吸附量和去除率随着铬离子初始浓度的增加呈先升后降的趋势;当吸附体系中铬离子浓度为30 mg/L时,菌体的吸附量和去除率均达到最大值,分别为1.88 mg/g和62.06%.因此,铬离子初始质量浓度为30 mg/L最佳.
2.2.2 吸附时间对菌株吸附铬离子的影响
为了研究吸附时间对吸附效果的影响,吸附时间梯度为30、60、90、120、150、180、210、240 min.结果见图3.

图3 吸附时间对铬离子吸附的影响
由图3可知,吸附时间在30~150 min时,菌株的吸附效果逐渐增强,当吸附时间为150 min时,吸附效果达到最好,其去除率和吸附量分别为63.68%和1.94 mg/g,之后随着吸附时间的拉长,吸附效果反而逐渐变弱.因此,最佳的吸附时间为150 min.
2.2.3 吸附pH值对菌株吸附铬离子的影响
为了研究溶液pH值对吸附效果的影响,水中pH值的梯度为3、4、5、6、7、8、9、10.结果见图4.
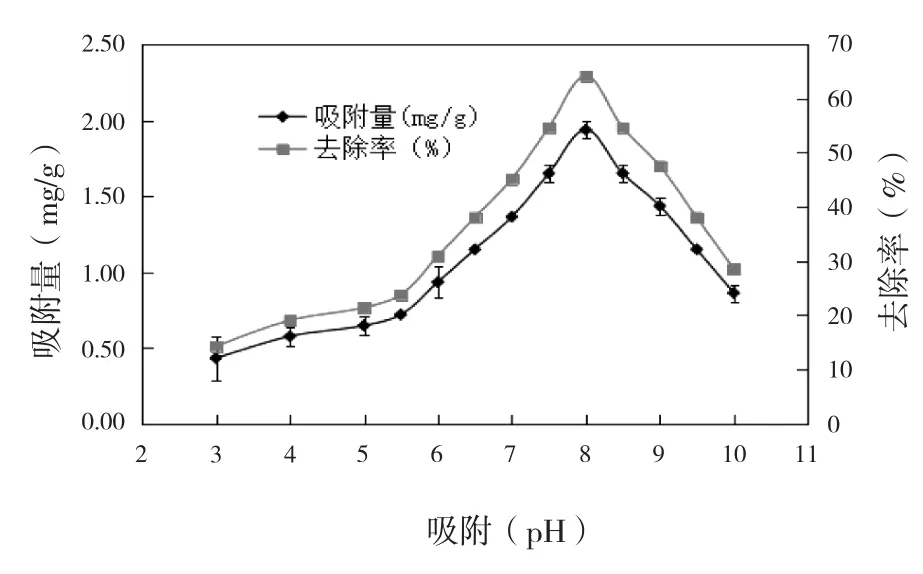
图4 吸附pH值对铬离子吸附的影响
由图4可知,吸附pH值在3~8以内,菌株的吸附性能随着pH值的升高逐渐增强,当吸附pH=8时,吸附效果达到最佳状态,此时,其吸附量和去除率分别为1.94 mg/g和64.13%.因此,最佳的吸附pH值为8.这与Benmalek等[19]报道的结果类似.菌株在合适的生长pH值环境下,对铬离子的吸附效果更好.
2.2.4 吸附温度对菌株吸附铬离子的影响
为了研究吸附温度对吸附效果的影响,吸附温度的梯度为20、25、30、35、40 ℃.结果见图5.
由图5可知,菌株的吸附量和去除率先是随着温度的升高而增大,当吸附温度为35 ℃,二者均达到最大,分别为1.94 mg/g和64.13%;之后,随着温度的增加,鞘细菌对铬离子的吸附效果反而减弱.因此,最佳的吸附温度为35 ℃.

图5 吸附温度对铬离子吸附的影响
2.3 正交设计实验
由于各因素之间会相互影响,对鞘细菌吸附铬离子进行了4因素3水平的正交试验.实验结果见表2.

表2 正交设计试验的直观分析
由表2可见,鞘细菌的最佳吸附组合为A2B3C1D2,即铬离子浓度为30 mg/L、吸附pH为7的废水体系中,35 ℃下吸附180 min,菌株的吸附量为2.51 mg/g;由表中极差可见,各因素对菌株吸附铬离子的的影响顺序为:A>B>C>D,即铬离子初始浓度>吸附时间>吸附pH值>吸附温度.
不同吸附材料对铬离子的吸附效果各不相同.Louati 等[20]研究发现,当吸附系统的pH值为6时,吸附时间为12 h时,铜绿假单胞菌对六价铬离子的最大去除率可达59%.宋微娜等[21]研究发现,当pH值为酸性,铬离子初始浓度为30 mg/L,吸附时间为20 min时,石墨烯海绵对铬离子的吸附量可达16 mg/g.
2.4 鞘细菌吸附六价铬离子的热动力学研究
2.4.1 鞘细菌吸附六价铬离子的热力学研究
对鞘细菌吸附不同浓度的六价铬离子的实验数据进行拟合处理,由于所拟合的Langmuir吸附等温曲线中实验数据各点分布并无相关的线性关系,拟合度不高,因此不予考虑.Freundlich吸附等温曲线和拟合参数见图6、表3.
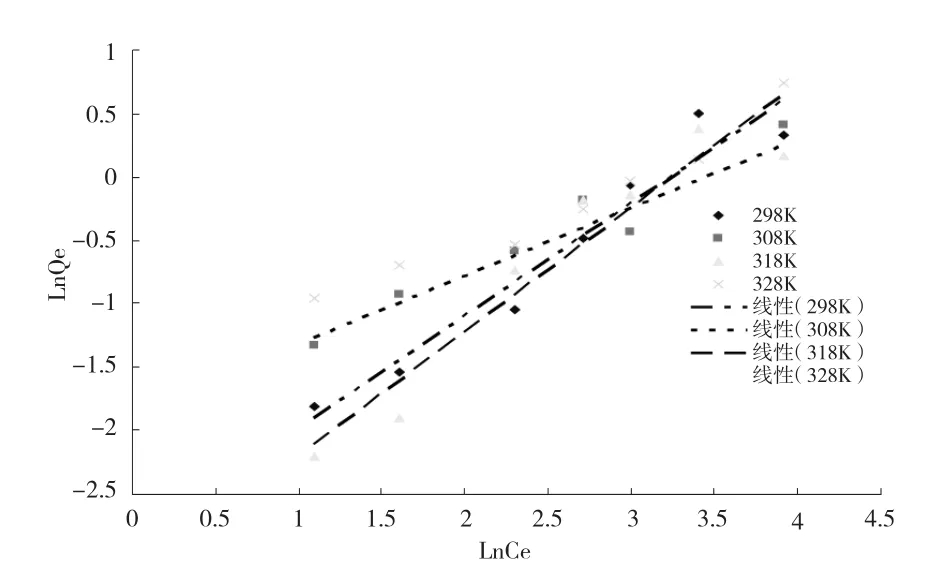
图6 鞘细菌吸附铬离子的Freundlich等温曲线

表3 鞘细菌吸附铬离子的Freundlich等温拟合参数
由图6可知,4种温度下,鞘细菌的吸附性能随着铬离子浓度的增加逐渐增强,Freundlich等温吸附曲线的拟合呈一定的线性关系,表明具有较高的拟合度.
由表3可知,4种温度所得到拟合方程的R2值均接近于1,表明其拟合方程的线性关系较好,再次说明了Freundlich等温吸附模型适用于对鞘细菌吸附六价铬离子的描述.n值越大越容易发生吸附;n>1表明较容易发生吸附;相反,n<1表明较不容易吸附.其中,在温度为35 ℃时n值最大,说明35 ℃最容易发生吸附反应.
2.4.2 鞘细菌吸附六价铬离子的动力学研究
为了探讨不同吸附时间对鞘细菌吸附六价铬离子的影响,对鞘细菌吸附不同浓度的六价铬离子的实验数据进行拟合处理,由于准一级动力学模型没有线性关系,表明一级动力学不适用于鞘细菌吸附六价铬离子的拟合,因此不予考虑.其二级动力学模型和拟合参数见图7、表4.
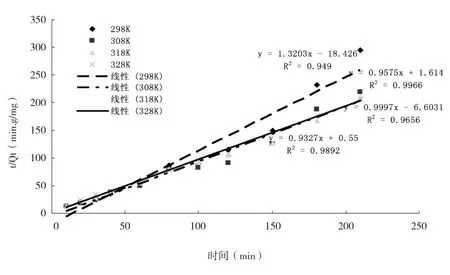
图7 鞘细菌吸附铬离子的准二级动力学
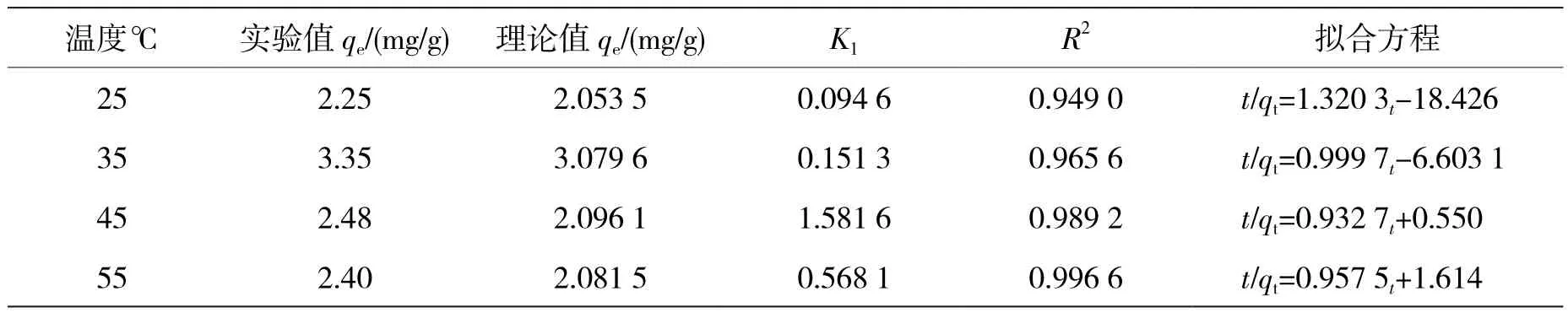
表4 鞘细菌吸附铬离子的准二级动力学拟合参数
由图7可知,在4种不同温度下的准二级动力学模型的R2值均接近1,表明其线性关系较好,说明二级动力学适用于鞘细菌对六价铬离子的吸附过程.由表4可知用准二级动力学拟合方程计算出鞘细菌吸附六价铬离子的吸附速率常数K1分别为0.094 6、0.151 3、1.581 6、0.568 1,实验吸附量qe为2.25、3.35、2.48、2.4 mg/g,与理论吸附量qe为2.053 5、3.079 6、2.096 1、2.081 5 mg/g十分相近.表明鞘细菌对六价铬离子的吸附主要受化学吸附作用的控制.
2.5 鞘细菌对铬离子吸附机理的研究
2.5.1 扫描电镜的结果及分析
菌株吸附铬离子前(a)和后(b)的SEM图片见图8.从图8(a)可见,菌体细胞表面平整,无凹凸,个体独立分布;图8(b)可见,菌体发生变化,表面粗糙,附着有沉淀物.

图8 鞘细菌吸附前(a)后(b)的SEM照片
2.5.2 红外光谱的结果与分析
菌株吸附铬离子前(a)和后(b)FTIR谱图见图9.菌株吸附前后官能团吸收峰位置的变化见表5.

图9 吸附前(a)后(b)的红外光谱图

表5 吸附前(a)后(b)红外光谱的变化及相应的官能团
菌体表面的蛋白质和多糖的酰胺基、羟基和羰基是菌体对重金属吸附的主要吸附位点[22].由图9、表5可知,菌株吸附后,菌体表面官能团的某些谱带发生了偏移,有新的特征峰出现,也有旧的特征峰消失.这些结果表明,吸附后,六价铬离子对鞘细菌的细胞壁上的官能团具有一定的影响.吸附铬离子后的红外光谱中,谱带2 987.86、1 756.20、1 684.59 cm-1处,分别偏移到2 976.46、1 724.94、1 656.20 cm-1;在2 416.23、1 573.63 cm-1处的吸收峰消失了,2 416.23、1 573.63 cm-1分别是C≡C和-NH、C-N的伸缩振动峰.综上所述,参与铬离子吸附主要基团有酰胺基、羧基、氨基等活性基团.
3 结论
1)吸附溶液中有铜离子或锌离子存在时,不仅减缓了菌株对铬离子的吸附速率,同时抑制了菌株对铬离子的吸附.鞘细菌的最佳吸附组合是A2B3C1D2,即铬离子浓度为30 mg/L、吸附pH为7的废水体系中,35 ℃下吸附180 min,菌株的吸附量为2.51 mg/g;
2)鞘细菌对六价铬离子的吸附量随着溶液中六价铬离子的浓度增加而逐渐增大;根据其吸附的指数可以判断,鞘细菌吸附六价铬离子的难易程度为35℃>55℃>25℃>45℃.鞘细菌对六价铬离子的吸附动力学适用于准二级动力学进行拟合,得到其相关系数R2为0.949 0~0.996 6.用拟合的准二级动力学方程计算出理论吸附量与实验吸附量相接近;
3)鞘细菌对铬离子吸附前后的SEM、FTIR等数据表明,吸附前后,菌体发生变化,菌体表面粗糙,有絮状物沉淀.参与铬离子吸附的主要基团有酰胺基、羧基及氨基等活性基团.为日后用鞘细菌处理含六价铬离子的工业污水提供了一定的理论依据基础.

