钙通道突变致早期复极综合征的电生理机制研究
陈秀 陈甘潇 张中和 胡丹 夏豪
(武汉大学人民医院心血管内科 武汉大学心血管病研究所 湖北省心脏重点实验室,湖北 武汉 430060)
早期复极模式(early repolarization pattern,ERP)是指除外V1~V3导联,12导联心电图上≥2个相邻导联出现J波(QRS波群终末切迹或顿挫)顶点(Jp)振幅≥0.1mV,QRS波群时限(在无切迹或顿挫的导联上)<120 ms,伴或不伴ST段抬高。过去几十年一直被认为是一种良性心电图改变[1-2]。直到2000年,Gussak等[3]通过建立犬心室的楔形组织模型提出,这种“良性表现”有发展为多形性室性心动过速(室速)甚至心室颤动(室颤)的倾向。8年后,Haïssaguerre等通过多个临床研究证实了这一假说[4-6]。随后大量流行病学调查研究也发现,ERP(尤其是位于下/侧壁)会增加恶性心律失常事件和心源性猝死的风险[7-8]。心电图下壁和/或侧壁导联记录到ERP,并伴有心搏骤停幸存史或室速/室颤史的患者即可被诊断为早期复极综合征(early repolarization syndrome,ERS)。ERS具有明显的家族遗传倾向,目前已发现的与ERS有关的离子通道异常基因有:KCNJ8、CACNA1C、CACNB2b、CACNA2D1、ABCC9、SCN5A、SCN10A和KCND3[9-15]。但目前仅对一小部分已识别的突变进行了功能表达的研究,确定了这些突变与ERS的因果关系及较为合理的致病机制。本研究利用二代测序技术、全细胞膜片钳、共聚焦荧光显微镜等实验技术,探究CACNA1C-P817S突变与ERS的因果关系及其可能的致病机制。
1 材料和方法
1.1 病例收集与遗传学分析
本研究遵循赫尔辛基宣言和本单位伦理学规章制度,患者签署知情同意书。收集就诊于武汉大学人民医院心血管内科的ERS患者,入选标准:心电图下壁和/或侧壁导联记录到ERP,并伴有心搏骤停幸存史或室速/室颤史者;ERP:除外V1~V3导联,12导联心电图上≥2个相邻导联出现J波(QRS波群终末切迹或顿挫)顶点(Jp)振幅≥0.1 mV,QRS波群时限(在无切迹或顿挫的导联上)<120 ms,伴或不伴ST段抬高[1-2]。排除标准:所有患者需排除ST段抬高心肌梗死、心室动脉瘤、心包疾病、电解质紊乱(高钾和低钙等)、体温过低、致心律失常型右心室心肌病等其他原因导致的ST段异常抬高。临床评估包括:病史、详细的体格检查、血液检查、心电图、超声心动图和冠状动脉造影。收集其外周血样本,从外周血白细胞中提取DNA,采用二代测序技术,对常见致心肌早期复极的候选基因(KCNJ8、CACNA1C、CACNB2b、CACNA2D1、ABCC9、SCN5A、SCN10A和KCND3)进行测序。这些候选基因的确定是基于既往报道的致ERS的突变基因。PCR扩增候选基因的外显子及外显子与内含子的接头序列,将纯化的PCR产物于ABI 3730遗传分析仪(Applied Biosystem,美国)上进行循环测序,测序结果由Mutation Surveyor V4.0.8软件(Softgenetics,美国)进行分析,并重复以上程序再次确认。被认为具有致病性的新突变为:(1)终止/移码突变;(2)错义突变位于物种间氨基酸保守区域;(3)符合GT-AT法则的剪切位点突变;(4)对照人群中最小等位基因频率(MAF)<0.005;和/或(5)通过PolyPhen-2和MetaLR软件预测可能有害或致病的突变。
1.2 HEK细胞的转染
将野生型(WT)和携带突变的CACNA1C全长cDNA序列克隆于带有增强型黄色荧光蛋白(EYFP)的pcDNA3.1载体,构建相应质粒。同时将WT-CACNB2b和CACNA2D1全长cDNA序列克隆于pcDNA3.1载体,构建WT-CACNB2b和WT-CACNA2D1质粒。将3种质粒按1∶1∶1的比例,按照Lipofectamine 2000说明书用Lipofectamine 2000转染试剂(Life Technologies,美国)共转染入人胚肾293(HEK293)细胞(中科院上海细胞库,中国)。
1.3 细胞电生理检测
选取转染后48~72 h,在倒置荧光显微镜(IX70,Olympus,日本)下观察,为单个独立、表面光滑、形态良好且贴壁牢固的带有黄色荧光的细胞,置于配置好的细胞外液中(MgCl21 mmol/L、CaCl22 mmol/L、HEPES 10 mmol/L、葡萄糖10 mmol/L、TEA 150 mmol/L,CsOH调节pH至7.35)。全细胞膜片钳系统使用AXON-700B膜片钳放大器(Axon Instruments,美国)来记录ICa,全过程在室温(20~23 ℃)下进行。连接膜片钳放大器与计算机,由pCLAMP 10.4软件(Axon Instruments,美国)控制,Digidata 1440A数模转换器(Axon Instruments,美国)采集信号。玻璃微电极充灌电极内液后(CsCl 110 mmol/L、CaCl20.1 mmol/L、EGTA 10 mmol/L、HEPES 10 mmol/L、Mg-ATP 2 mmol/L、TEA 10 mmol/L,CsOH调节pH至7.35),对选取的细胞进行负压封接和破膜,形成全细胞记录模式,记录ICa。补充细胞膜电容,串联电阻自动进行补偿70%~80%。保持电位为-90 mV,命令电位依次为-60~+60 mV,测试脉冲400 ms,步阶10 mV,在以脉冲电压为横轴,电流密度(电流值/细胞膜电容)为纵轴,绘制电流-电压(I-V)曲线。保持电位为-90 mV,命令电位依次为-60~+60 mV,测试脉冲400 ms,步阶10 mV,以脉冲电压为横轴,G/Gmax为纵轴[G=Itp/(Vm-VR)],绘制电压依赖的稳态激活(steady-state activation,SSA)曲线,采用Boltzmann方程对SSA曲线进行拟合:G/Gmax=1+exp[(Vm-V1/2)/k]。保持电位为-90 mV,命令电位依次为-100~+20 mV,测试脉冲400 ms,步阶10 mV,以脉冲电压为横轴,I/Imax为纵轴,绘制电压依赖的稳态失活(steady-state inactivation,SSI)曲线,采用Boltzmann方程对SSI曲线进行拟合:I/Imax=1+exp[(Vm-V1/2)/k]。G为全细胞通道激活电导,Gmax为全细胞通道最大激活电导,Itp为不同电压下全细胞峰值电流,VR为通道的反转电位,Imax为电流最大值,Vm为去极化脉冲电压,V1/2为半激活/半失活电压,k为斜率因子。
1.4 共聚焦荧光显微镜检测
选取转染后48 h的带有pEYFP黄色荧光的HEK293细胞,放在共聚焦荧光显微镜(TCS SP8,Leica Microsystems,德国)下采集荧光图像。在XYZ三维层面上检测分析EYFP标记的细胞,限定细胞膜2 μm区域为外周染色,分别测量外周和细胞整体平均荧光强度,并计算外周与整体平均荧光强度的比值,测量结果直接用测量得到的平均荧光强度进行比较,未标准化为细胞面积后的值进行比较。图片使用Image-Pro Plus图像分析软件分析平均荧光强度。
1.5 统计学方法

2 结果
2.1 临床资料分析
先证者是1例20岁男性青年,两次运动过程中发生晕厥史。常规心电图提示(如图1):窦性心动过缓(HR=46次/min),QRS=98 ms,QTc=367 ms,Ⅱ、Ⅲ、aVF、V2~V6导联J波抬高均≥0.1 mV,其中Ⅱ、Ⅲ和aVF导联抬高≥0.2 mV,V2~V5导联可见ST段呈上斜型抬高,排除了引起ST段异常抬高的其他可能原因,包括急性心肌梗死和心室动脉瘤等。体格检查未发现异常;超声检查提示右房和右室轻度扩大,左室和右室射血分数均正常;既往无心搏骤停史,否认ERS和心源性猝死家族史。
2.2 遗传学分析
该ERS先证者致病基因为编码L型钙离子通道(LTCC)的α1亚单位CACNA1C,为错义突变,且位于氨基酸保守区域。突变位于17号外显子上核苷酸2449区,胞嘧啶C突变成胸腺嘧啶T(c.2449 C>T),使脯氨酸(P)被丝氨酸(S)所替代(P817S),Cav1.2的DⅡ/Ⅲ结构域。MAF为0.002,PolyPhen-2(评分为0.997)、MetaLR软件(评分为0.839)预测可能为有害突变。
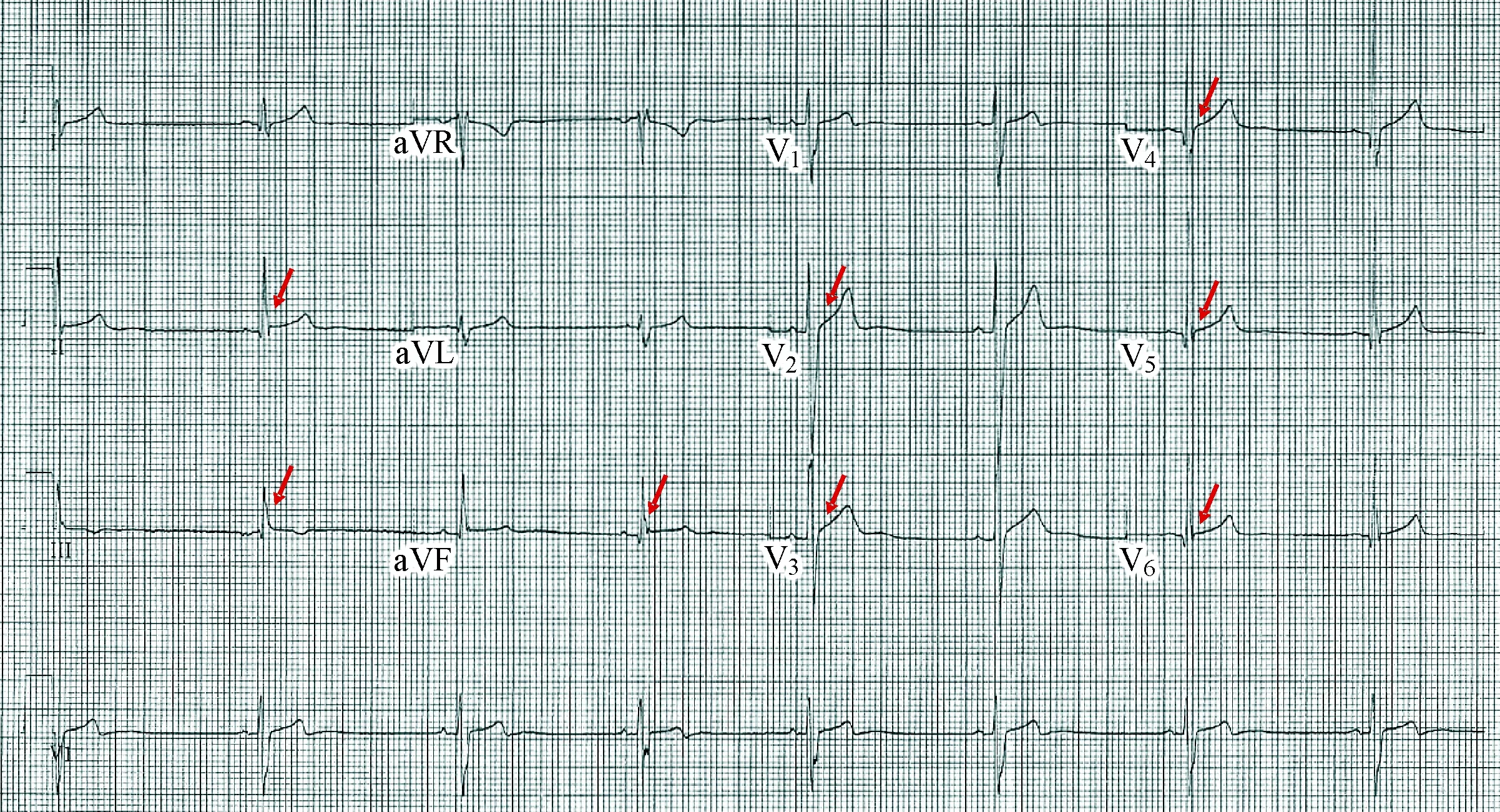
图1 ERS先证者常规心电图(25 mm/s,10 mm/mV)
2.3 细胞电生理检测
2.3.1CACNA1C-P817S突变对I-V曲线的影响
如图2,P817S组ICa密度较WT组显著降低,在0 mV时峰电流密度降低了约68.8%,从(-19.2±1.5)pA/pF降至(-6.0±1.7)pA/pF。
2.3.2CACNA1C-P817S突变对ICaSSA曲线的影响
如图3A-C,两组SSA曲线无明显差异,半激活电压V1/2分别为WT组(11.3±1.5)mV和P817S组(12.5±1.5)mV,SSA曲线斜率k也无明显改变(WT vs P817S:6.3±1.0 vs 6.5±1.3,P>0.05)。
2.3.3CACNA1C-P817S突变对ICaSSI曲线的影响
如图3D-F,P817S突变使半失活电压V1/2明显减小,V1/2由(-30.4±0.75) mV变为(-41.6±0.84) mV,但失活曲线斜率k保持不变(WT vs P817S:7.4 ± 1.1 vs 6.5 ± 1.3,P>0.05)。提示CACNA1C-P817S突变加速了LTCC的稳态失活。
2.4 转运功能研究
与WT组相比,P817S组Cav1.2蛋白外周荧光强度的绝对值明显降低[WT vs P817S:(19.6±2.0)MD vs (12.2±1.9)MD,P<0.01],如图3C。P817S组Cav1.2蛋白外周/整体荧光强度的百分比也较WT组降低(WT vs P817S:(30.2±2.3)% vs (20.9±2.2)%,P<0.01,n=4),如图3D,提示P817S突变组细胞Cav1.2蛋白转运功能降低。
3 讨论
离子通道疾病是年龄<30岁人群中心源性猝死的主要原因,而基因和分子是这类疾病的决定性因素[16-17]。ERS作为离子通道疾病的一种,如前所述,其心电图表现即ERP一直被认为是一种良性表现,一直到2008年,Haïssaguerre等[4]的开创性研究发现ERS与恶性心律失常及心源性猝死相关。2013年,ERS在《2013 HRS/EHRA/APHRS遗传性心律失常综合征诊治专家共识》中首次作为一种独立的遗传心律失常被提出[18]。目前发现与ERS相关的离子通道有3种(IK-ATP、ICa-L和INa),相关的基因突变有KCNJ8、CACNA1C、CACNB2b、CACNA2D1、ABCC9、SCN5A、SCN10A和KCND3。但目前仅对一小部分已识别的突变进行了功能表达的研究,确定了这些突变与ERS的因果关系以及较为合理的致病机制。因此,对基因突变的功能性和生物学验证是基因检测结果解读的环节。本研究通过对CACNA1C-P817S突变进行了相应的功能性和生物学研究,探究CACNA1C-P817S突变与ERS的因果关系及其可能的致病机制。

注:A和B为两组细胞ICa原始电流曲线记录图;C为两组细胞的I-V曲线,每个点的值为为在0 mV时记录的两组ICa峰电流密度的比较。***表示P<0.001(WT vs P817S)。图2 CACNA1C-P817S突变对ICa的影响

注:A表示WT和P817S突变的SSA曲线;B为两组SSA曲线半激活电压V1/2的比较;C为两组SSA曲线斜率因子k的比较;D表示WT和P817S突变的SSI曲线;E为两组SSI曲线半失活电压V1/2的比较;F为两组SSI曲线斜率因子k的比较。***表示P<0.001,NS表示无统计学差异(WT vs P817S)。图3 CACNA1C-P817S突变对SSA曲线和SSI曲线的影响

注:图A和B分别表示两组转染细胞荧光染色图像,黄色荧光显色部分代表Cav1.2蛋白;图C表示两组细胞Cav1.2蛋白外周荧光强度的绝对值比较;图D表示两组细胞Cav1.2蛋白外周/整体荧光强度百分比的比较。**表示P<0.01(WT vs P817S)。图4 共聚焦荧光显微镜下HEK293细胞Cav1.2蛋白转运功能的比较
ERS的电生理机制一直存在争议,但近来Koncz等[19]的ERS实验模型为复极化假说提供了证据:Ito是引起1期快速复极的主要跨膜电流,相对于心内膜,心外膜有更多的Ito通道;正常情况下,心外膜动作电位1相外向电流强于心内膜,因此心外膜在动作电位1相时表现为更为明显的切迹,而心内膜动作电位尖峰通常较细小,形成跨室壁的电压梯度,ERS患者跨室壁电压梯度会增大,进而出现J点抬高、明显J波或QRS波群终末的顿挫;心动过缓时,迷走神经张力增加,可使IK-ATP激活,导致心室Ito增强,诱发心动过缓相关性J波;而睾酮在增强IKs的同时抑制ICa,使外向电流明显增强,J波振幅增高[20-22]。因此ERS多见于男性青壮年,同时也有研究表明心动过缓和长间歇可使J波和ST段抬高更加明显[23-24]。此外,LTCC基因突变可使ERS患者QT间期相对缩短[10]。本研究ERS先证者为一男性青年,临床特征与既往研究相符;既往无心搏骤停史,也否认ERS和心源性猝死家族史,但常规心电图可见多个导联J波抬高≥0.1 mV,甚至所有下壁和侧壁导联V4均≥0.2 mV,同时多个导联可见ST段抬高,考虑可能为心动过缓相关性J波;先证者晕厥发生在运动过程中,而ERP又出现在心动过缓时,考虑可能是运动后恢复期迷走神经介导,类似于心动过缓性J波。Rosso等[6]发现,心电图存在J波的人群出现室颤的概率为11/10万,因此ERS的高度危险性引起了关注,早期筛查高危ERS人群尤为重要。ERS高危因素有:(1)家族人群中存在ERS,且具有不明原因的晕厥及猝死者;(2)可能出现过因室速或室颤导致的晕厥或心脏事件;(3)当QRS波群终末部分出现顿挫,且J波明显抬高伴随T波倒置;(4)左室下壁、下侧壁或所有导联均出现J波或ST段抬高≥0.2 mV;(5)运动后恢复期迷走神经介导的ST段抬高也预示着恶性改变等[1,25]。先证者下壁导联J波抬高均≥0.2 mV,同时又可能是运动后恢复期迷走神经介导,故先证者属于高危ERS,可能有更高发生恶性心律失常的风险,需随访来进一步研究。先证者QTc为367 ms,相对较短,推测为LTCC基因突变的可能性较大。通过二代测序技术,证实确为编码LTCC α1亚单位CACNA1C发生了错义突变,c.2449 C>T/p.P817S,MAF为0.002,PolyPhen-2和MetaLR软件预测为有害突变。
LTCC有CaV1.1、CaV1.2、CaV1.3和CaV1.4四种亚型,心肌细胞主要表达CaV1.2亚型,由α1、β2、α2δ和/或γ亚基四种亚基组成。α1亚基的编码基因是位于12号染色体上的CACNA1C,为离子转运孔道,也是LTCC功能和药理学特性的决定性蛋白,但LTCC功能表达需β2和α2δ亚基的辅助,以提高细胞膜表达密度,顺应细胞内信使调控[10,26]。CACNA1C突变可导致长Q-T间期综合征、Brugada综合征、ERS以及短Q-T间期综合征。但在既往研究报道中,功能性缺失较少见。Cav1.2羧基末端的突变可能对Cav1.2功能表达和蛋白表达水平有明显作用,心脏疾病相关CACNA1C基因突变在Cav1.2多见于羧基末端,且该区域的突变多产生功能丧失性效应,而发生在跨膜区域的突变较为少见[10,27]。ICa大小不仅和离子通道活性有关,还与细胞膜上的通道数量有关,这取决于Cav1.2蛋白的转运功能。Antzelevitch等[28]发现CACNA1C-A39V突变导致的ICa功能性缺失是由于该突变降低了Cav1.2蛋白的转运功能。如前所述,睾酮在增强IKs的同时抑制ICa,使外向电流明显增强,J波振幅增高。先证者为一男性青年,致病突变又为LTCC基因突变,理论上,睾酮和CACNA1C突变的双重作用,会使临床症状更明显和更严重,但目前症状表明并没有,可能是因为存在个人易感性的可能,当然,这也在一定程度上提示了该先证者有症状恶化的可能,需密切注意。既往研究发现,CACNA1C突变可使ICa功能缺失,从而表现为ERS[10]。本研究通过全细胞膜片钳技术对CACNA1C-P817S进行功能学研究,结果显示P817S突变可降低ICa密度,加速LTCC的失活,但并未改变激活。为进一步研究ICa密度的降低是否是Cav1.2蛋白转运功能降低所致,本研究通过共聚焦荧光显微镜技术,通过对Cav1.2蛋白转运功能进行分析,发现P817S突变可使Cav1.2蛋白转运功能降低,于是可对细胞电生理结果中P817S突变组中ICa密度的降低作出较为合理的解释:P817S突变通过降低Cav1.2蛋白的转运功能,使细胞膜上有效Cav1.2蛋白数量减少,从而降低了ICa的密度。
综上,本研究通过对ERS先证者进行基因筛查,发现一个新的基因突变CACNA1C-P817S,通过功能分析证实为功能缺失性突变,该突变通过降低Cav1.2蛋白的转运功能,使细胞膜上有效Cav1.2蛋白数量减少,从而降低了ICa的密度。本研究结果提示,CACNA1C-P817S突变为ERS的一个致病基因,明确ERS的分子遗传学和功能学基础可为其诊断和治疗提供一定的依据。
4 限制与不足
本研究的局限性是缺乏来自先证者的诱导性多能干细胞衍生的心肌细胞以及进一步的体内研究,而这对于解释复杂遗传变异的累积效应是优选。另一局限性是,本研究缺乏蛋白定量相关的研究,这可能在部分程度上对试验结果造成偏倚。