混菌发酵对葡萄酒成分的影响机制
刘瑶,卢浩成,胡丽,胡娟,成池芳,王军*
(1. 中国农业大学食品科学与营养工程学院/农业农村部葡萄酒加工重点试验室,北京 100083;2. 新疆中信国安葡萄酒业有限公司/新疆酿酒葡萄与葡萄酒工程技术研究中心,新疆玛纳斯 832200)
葡萄酒浓郁复杂的香气和丰富的口感给人们带来了感官的享受和心灵的愉悦。作为一种发酵饮品,微生物赋予了葡萄酒最主要的发酵香气。风味的复杂平衡和典型性对葡萄酒品质至关重要。大量研究表明,相比于单纯酿酒酵母发酵,混合发酵产生的挥发性物质种类和含量更多,风味更协调多样,更能体现酿酒葡萄种植地的风土特点。事实上,在许多传统葡萄酒产区,利用原生酵母自然发酵仍是葡萄酒酿造,尤其是红葡萄酒酿造的常规方法。随着对非酿酒酵母在改善葡萄酒香气、口感、颜色等品质方面认识的加深,越来越多的商业化非酿酒酵母被应用到葡萄酒发酵中。
目前,在微生物生理和代谢组层面的葡萄酒混合发酵研究主要探究不同酵母菌的生理代谢活动过程和相互作用,一些物质直接参与葡萄酒品质相关的化学反应,如代谢酶、挥发性物质、醇类、有机酸等,一些物质通过调节微生物活动来发挥作用。混合发酵研究的目的是解释并利用影响葡萄酒感官特性的生物化学原理,为混合发酵实际应用提供理论基础。
1 混合发酵对葡萄酒化学成分的积极影响
混合发酵对葡萄酒品质的影响不一。许多非酿酒酵母具有优良的发酵特性,如高产香气化合物、高产增香酶类、释放更多的甘露糖蛋白、低产乙酸、降解苹果酸等来改善葡萄酒的风味、口感和颜色[1]。而有些非酿酒酵母发酵产生挥发性脂肪酸、含硫化合物、羰基化合物等导致葡萄酒的不良风味。因此,要根据葡萄品种、酿造工艺和陈酿条件选择适合的混合发酵菌种,达到改善葡萄酒品质的目的。
1.1 挥发性化合物
混合发酵对葡萄酒挥发性化合物产生影响的化学基础包括香气合成相关酶活性(糖苷酶、醇酰基转移酶、酯酶、脂肪酶、蛋白酶等)、欧利希通路机制、糖蛋白的分泌以及由非酿酒酵母和酿酒酵母相互作用产生的挥发性物质。
1.1.1 品种香
混合发酵体系的高糖苷酶活性有利于增加葡萄酒的品种香和香气复杂度。葡萄果实中存在的糖苷结合态香气物质如单萜烯、降异戊二烯和芳香族化合物在糖苷酶作用下被释放,具有了挥发性。β-葡萄糖苷酶广泛存在于非酿酒酵母中,假丝酵母属(Candida)、毕赤酵母属(Pichia)、美极梅奇酵母属(Metschnikowia)、丝孢酵母属(Trichosporon)、红酵母属(Rhodotorula)、汉逊酵母属(Hanseniaspora)和威克汉逊酵母属(Wickerhamomyces)都检测到糖苷酶活性[2]。葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、胶红酵母(Rhodotorula mucilaginosa)和膜璞毕赤酵母(Pichia membranifaciens)的β-葡萄糖苷酶活性在数量众多的非酿酒酵母中处于较高的水平,葡萄汁有孢汉逊酵母在发酵环境中具有最高的β-葡萄糖苷酶活性[3]。王佳等[4]对14种941株野生酵母菌进行鉴定和产β-葡萄糖苷酶能力分析,发现β-葡萄糖苷酶活性在酵母菌种间和种内均可表现出显著差异,其中陆生伊萨酵母(Issatchenkia terricola)和季也蒙毕赤酵母(Pichia guilliermondii)产β-葡萄糖苷酶的能力最强;部分非酿酒酵母具有α-阿拉伯糖苷酶、α-鼠李糖苷酶和木糖苷酶活性[5]。这些糖苷酶催化末端糖苷的解离,有利于葡萄糖苷键断裂[6]。酶的存在位置和聚合方式的差异会导致β-葡萄糖苷酶活性的差异[7]。
含硫化合物在葡萄酒中一般表现出不良风味,然而某些痕量级挥发性硫醇表现出愉悦的香气[8]。酵母菌的代谢使得挥发性硫醇从与半胱氨酸结合的前体物中释放出来[9]。混合发酵的菌种相互作用也可以提高葡萄酒挥发性硫醇的含量。酿酒酵母和戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)在混合发酵过程中的协同作用使得3-巯基己醇含量提高,表现出水果香气[10]。‘长相思’葡萄酒中3-巯基己基乙酸盐含量在克鲁维毕赤酵母(Pichia kluyveri)和酿酒酵母混合发酵条件下显著提高[5]。
1.1.2 发酵香
由酒精发酵产生的挥发性风味物质形成的发酵香是葡萄酒重要的香气组成。形成发酵香的风味物质主要是乙醇、高级醇、杂醇和酯类。杂醇油和高级醇在酵母细胞中由氨基酸在欧利希通路(缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸)分解代谢得到[11]。例如,苯丙氨酸代谢得到苯乙醇和乙酸苯酯,这两种物质都带有玫瑰香气。异丁醇和异戊醇由缬氨酸和亮氨酸代谢产生,异亮氨酸代谢产生2-甲基丁醇。Amparo等在研究不同酵母菌发酵香气特征时发现,非酿酒酵母中的季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)、加勒比星形酵母(Starmera caribaea)、亚膜威克汉姆酵母(Wickerhamomyces subpelliculosus)、有孢汉生酵母(Hanseniaspora vineae)、哈萨克斯坦合孢酵母(Kazachstania gamospora)和微椭圆形有孢酵母(Torulaspora microellipsoides)产生上述三种杂醇的量是酿酒酵母的3~27倍,说明在非酿酒酵母细胞中欧利希通路支链氨基酸表达量更高[12]。另外有研究显示,即使发酵环境相似,不同种酵母菌产生的高级醇种类和产量存在差异,说明非酿酒酵母调节欧利希通路的机制比酿酒酵母更加多样[13]。
酯类物质合成和相互转化以酶反应为基础,混合发酵和非酿酒酵母胞外酶处理对提高发酵过程中酯类物质种类和含量都有良好的效果。其中,中链脂肪酸乙酯浓度变化很大程度上与中链脂肪酸浓度有关,而乙酸酯的合成与酶活性高度相关[14]。与酯类合成相关的酶主要是醇酰基转移酶和酯酶。酯酶不仅可以催化酯化反应,还能水解酯类,改变不同酯类比例。同时,一些非酿酒酵母具有高产脂肪酶能力,脂肪酶催化葡萄中和酵母自溶产生的甘油三酯和脂质,提高底物浓度,对酯类物质产生有利[15]。目前的研究大多集中在对不同来源、不同种类的非酿酒酵母增香特性的分析。
对葡萄酒香气有贡献的酯类是高级醇的乙酸酯和中链脂肪酸乙酯。通常认为酿酒酵母发酵高产乙酸酯,如乙酸乙酯、乙酸异戊酯和乙酸苯乙酯。在Amparo的同一研究中发现,加勒比星形酵母和季也蒙汉逊酵母产生上述乙酸酯的量比酿酒酵母Lalvin T73高44~84倍,乙酸酯赋予葡萄酒香蕉、梨和热带水果的香气;酿酒酵母高产己酸乙酯、辛酸乙酯和癸酸乙酯3种酯类,4种非酿酒酵母的丁酸乙酯和异戊酸乙酯产量很高,这5种酯类使得葡萄酒带有菠萝、苹果等水果香气[12]。
非酿酒酵母和酿酒酵母在发酵过程中的相互作用对葡萄酒挥发性化合物存在影响。Philippe等人发现,乙酸异丁酯和乙酸异戊酯在戴尔凯氏有孢圆酵母和酿酒酵母混合发酵体系中的产量显著高于两者单独发酵[16]。Moreira等发现,与葡萄汁有孢汉逊酵母与酿酒酵母混合发酵过程中,酯类总体产量相比于该酵母纯种发酵过程有所增加,酯类中乙酸乙酯的产量降低[17]。Kurita等人对比研究低水平乙酸乙酯的异常毕赤酵母(Pichia anomala)突变体与野生型的代谢指标发现,由于异常毕赤酵母代谢产生的乙酸乙酯,酿酒酵母中乙酸酯水解酯酶活性增加,同时检测到混合发酵体系中乙酸乙酯含量的降低和乙酸异戊酯含量的升高[18]。可能的原因是乙酸酯水解酯酶分解乙酸乙酯释放乙酸,其与发酵产物异戊醇发生了酯化反应,因此尽管在乙酸酯水解酯酶活性高于纯种发酵的条件下,混合发酵依然增加了乙酸异戊醇含量。
1.1.3 陈酿香
葡萄酒在陈酿过程中酵母菌发生自溶,细胞中的代谢物质和酶被释放出来,细胞蛋白、核酸和脂类通过酶促反应被分解,氨基酸、肽、脂肪酸和核苷酸等反应产物是合成杂醇油、高级醇和酯类的前体物质。
总的来说,非酿酒酵母产甘露糖蛋白能力优于酵母菌,混合发酵体系甘露糖蛋白水平更高。甘露糖蛋白是位于酵母细胞外壁上的一类糖蛋白,其通过对葡萄酒中挥发性物质结合作用,避免香气成分的散失而增强葡萄酒香气的持久度[19]。葡萄酒中的甘露糖蛋白有两种来源,一是由酵母菌在酒精发酵过程中分泌(0.1~0.15 g/L)[20];二是陈酿过程中酵母自溶,即细胞壁结构破坏后甘露糖蛋白和细胞壁中的葡聚糖、几丁质分离。Pascale等利用提取的甘露糖蛋白在模拟酒液中检测乙酸异戊酯、己醇、乙酸乙酯和β-紫罗兰酮的挥发性发现,甘露糖蛋白可与这4种香气物质发生结合,使其挥发性降低,产生保留作用[21]。Juega发现高浓度的甘露糖蛋白对萜烯(香叶醇和芳樟醇)也有保留作用[22]。研究发现,某些非酿酒酵母在无多糖葡萄汁中释放甘露糖蛋白的能力高于酿酒酵母,例如耐热克鲁维酵母(Kluyveromyces thermotolerans)、嗜高渗汉逊酵母(Hanseniaspora osmophila)、美极梅奇酵母(Metschnikowia pulcherrima)、发酵毕赤酵母(Pichia fermentans)、路德氏酵母(Saccharomycodes ludwigii)和戴尔凯氏有孢圆酵母[23]。除此之外,Laura等人发现酿酒酵母和克鲁维酵母菌的天然杂种的发酵环境中甘露糖蛋白的含量高于酿酒酵母发酵环境,并发现天然杂种内基因组相互作用创造了促进甘露糖蛋白分泌的生物环境[24]。
1.2 与味觉、触觉相关的化合物
在品尝葡萄酒时,酸度、甜味、单宁、乙醇构成葡萄酒的基本味觉,苹果酸、酒石酸等有机酸形成酸味;糖和甘油具有甜味;单宁产生收敛感;乙醇与干葡萄酒的苦味相关并且有温热、轻微灼烧的感觉。酸度、酒度、单宁(红葡萄酒)和甜味组合形成的结构一般被认为支撑葡萄酒的酒体。
1.2.1 甘油
甘油浓度超过5.2 g/L会产生甜味,甘油还可以增加葡萄酒的黏稠度,赋予葡萄酒柔和圆润的口感和饱满的酒体。酿酒酵母产甘油量一般在5~8 g/L[25]。许多非酿酒酵母都有比酿酒酵母更优越的产甘油能力,如星形假丝酵母(Candida stellata)产甘油能力非常突出,最高可达到14 g/L[26]。有趣的是,这种非酿酒酵母通常只能代谢果糖,因而与酿酒酵母混合发酵完成时可使残糖含量大大降低,并缩短发酵时间。许多产区干红葡萄酒都存在残糖高(5~10 g/L)的问题。利用这种非酿酒酵母混合发酵是一种可能的解决方法。但需要注意的是,甘油会打破酵母细胞内氧化还原电位的平衡,乙酸、乙醛和乙偶姻的增加导致葡萄酒风味不良[27]。
1.2.2 多糖
多糖能够增加葡萄酒的黏性和酒体的饱满度,柔化涩感。葡萄酒中含量最丰富的多糖是来源于葡萄的阿拉伯半乳糖蛋白,其次是甘露糖蛋白[28]。研究发现,发酵毕赤酵母、嗜高渗汉逊酵母、路德氏酵母、贝利接合酵母(Zygosaccharomyces bailii)与酿酒酵母混合发酵后葡萄酒中多糖的浓度增加[29-30]。
1.2.3 有机酸
葡萄酒中与风味相关的有机酸主要包括酒石酸、苹果酸、乳酸、乙酸。混合发酵可以实现葡萄酒有机酸的协调。葡萄醪中过量的有机酸不仅影响酵母发酵,且葡萄酒酸/甜、风味/香气味感不平衡。葡萄果实酒石酸和苹果酸的比例在1∶1~1∶3,两者共同组成葡萄果实90%以上的有机酸,在正常红葡萄酒pH3.4下,酒石酸酸味强度是苹果酸的3倍[31]。苹果酸呈现尖锐的青苹果酸味,酒石酸带有柠檬酸味且不会被乳酸菌和酵母菌分解。乳酸酸味柔和,是由酒精发酵后乳酸菌完成的苹果酸-乳酸发酵产生的。乙酸是葡萄酒中最主要的挥发酸,是酒精发酵和乳酸菌代谢的副产物,葡萄酒中乙酸含量超过0.8~0.9 g/L就会显示出明显的醋味,果香丧失,酒体单薄。因此,维持乙酸正常水平同时使苹果酸降解转化是葡萄酒有机酸协调的目的。
苹果酸-乳酸发酵是降低苹果酸的常用方法。酿酒酵母对苹果酸利用能力很弱。研究发现,裂殖酵母属菌种在酒精发酵过程中可以有效代谢分解苹果酸[32]。耐热克鲁维酵母代谢产生乳酸,还具有降低葡萄酒乙酸含量的效果[33]。混合发酵调酸节约了二次发酵的时间,降低了细菌性腐败的风险。
Angel等发现,粟酒裂殖酵母(Schizosaccharomyces pombe)和耐热克鲁维酵母连续接种发酵体系中,粟酒裂殖酵母利用苹果酸产生乙醇和二氧化碳,葡萄汁中苹果酸几乎完全被消耗,耐热克鲁维酵母发酵产生乳酸,柔化尖锐的酸味,并且葡萄酒果香更浓郁,乙酸保持在正常范围内,无需进行苹果酸-乳酸发酵[34]。张亚强等人筛选出一株可高效降解苹果酸的粟酒裂殖酵母Y1703,其在发酵过程中降解苹果酸达96.83%,总酸含量下降30.07%[35]。克鲁维耐热酵母与酿酒酵母混合发酵可以提高葡萄酒酸度。采用低酸葡萄汁混合发酵后葡萄酒pH由4降低到3.5,这对气候炎热、葡萄酸度不足地区的葡萄酒生产具有积极作用[36]。
1.2.4 乙醇
目前,降低乙醇含量成为葡萄酒研究的一个目标。由于气候变暖导致葡萄果实生长期缩短,可溶性固形物积累速度快,发酵后乙醇含量偏高,许多地区葡萄酒酒精度时常超过15%[37]。高糖会引起微生物生长受抑制或裂解、酒精发酵推迟、酒精发酵副产物甘油和乙酸增加,乙酸可能引起不良风味,较高pH值(4左右)会降低葡萄汁和葡萄酒微生物的稳定性[38],增加酒体变质和感官品质退化的可能性。葡萄酒高乙醇含量降低了对其甜味、酸味的感知,并且不利于香气的表现[39];
发生在酵母细胞内的糖酵解过程是一个由NAD+/NADH平衡控制的氧化还原反应体系。一般情况下,大部分的NAD+在3-磷酸甘油醛脱氢过程中被消耗,因此,NADH的大量存在使得糖酵解反应体系还原性增强。而乙醛被还原生成乙醇的反应消耗了NADH,使得氧化还原电位平衡。因此通过改变NAD+/NADH平衡(消耗NADH)来重新定向反应终点是生物降醇的一种思路[40]。新的反应终点可以是糖酵解中的甘油或风味物质代谢中的风味物质。例如,用耐热克鲁维酵母和酿酒酵母连续接种混合发酵在降低乙醇的同时,甘油和丙酮酸含量升高[30]。改变氧化还原电位的方法有:添加代谢物、升温和利用具有特定代谢特征的酵母菌。代谢物包括糠醛、香草醛、有机酸(肉桂酸、苯甲酸、甲酸、丙酸)、氯化钾、氯化钠、二氧化硫和碳酸钠[41]。
Contreras等对50种不同非酿酒酵母在连续接种条件下的降醇能力进行了评估。结果发现,非酿酒酵母Metschnikowia pulcherrima AWRI1149降醇效果最好,分别使‘霞多丽’和‘西拉’葡萄酒的酒度下降了0.9%和1.6%[42]。葡萄汁有孢汉逊酵母、接合酵母(Zygosaccharomyces sapae)、贝利接合酵母和双孢接合酵母(Zygosaccharomyces bisporus)在纯种发酵‘维蒂奇诺’(Verdicchio)和‘特雷比奥罗’(Trebbiano)葡萄时具有低产乙醇的潜力[43]。仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)和葡萄汁有孢汉逊酵母可用于生产低酒精度的‘长相思’和‘比诺塔吉’(Pinotage)葡萄酒。杆状假丝酵母(Starmerella bacillaris)和酿酒酵母连续接种混合发酵使‘巴贝拉’葡萄酒酒度下降0.7%[44]。
混合发酵还可以弥补目前生产低醇葡萄酒普遍采用的减少可发酵糖分、蒸馏脱醇以及添加二氧化硫终止发酵造成的香气成分损失[45]。
1.3 花色苷
红葡萄酒中主要的呈色化合物是花色苷。但花色苷结构易受环境因素影响而破坏。因此,提高葡萄酒中总花色苷或稳态花色苷(聚合色素)含量,避免稳定的花色苷衍生物破坏是改善葡萄酒颜色和护色的目标。
首先,非酿酒酵母产生的果胶酶有利于花色苷在浸渍阶段从葡萄皮中浸出进入发酵液,提高发酵液中花色苷含量,并有助于澄清和过滤过程的进行。假丝酵母、隐球酵母、克鲁维酵母和红酵母都可以产生果胶酶[23]。其次,酵母菌能够通过改变色度和色调直接或间接地影响葡萄酒颜色,包括但不限于以下三种方式:第一,增加花色苷修饰物乙烯基苯酚、乙醛和丙酮酸和羟基肉桂酸等物质的产量形成更多的稳态葡萄酒色素[46]。第二,通过有机酸代谢降低pH,增强花色苷的呈色性[47]。如耐热克鲁维酵母代谢产的乳酸降低了pH值,起到护色的作用[48]。丙酮酸和乙醛与二甲花翠素-3-O-葡萄糖分别相互作用生成vitisin A和vitisin B[49]。这种花色苷衍生物抗氧化活性强,陈酿过程中不易分解,对SO2和pH变化稳定性强[50]。vitisins呈橙红色调,使酒体色泽呈现砖红色[51]。研究表明,混合发酵能够有效促进丙酮酸和乙醛量的增加[52],从而使vitisins含量增加,起到改善葡萄酒颜色的作用。研究发现,裂殖酵母具有较强的产丙酮酸能力[53],粟酒裂殖酵母和耐热克鲁维酵母连续接种发酵比酿酒酵母发酵产生更多vitisins A[54]。第三,部分β-葡萄糖苷酶会水解花色苷的糖苷键释放游离的花色苷分子,并迅速降解,其呈色结构破坏后导致葡萄酒红绿色调变弱[55]。不同菌株产生的β-葡萄糖苷酶对花色苷的降解作用不同,阿萨丝孢酵母(Trichosporon asahii)产生的β-葡萄糖苷酶对花翠素-3-葡萄糖苷具有明显的降解作用[56],而有研究者将有β-葡萄糖苷酶活性的酿酒酵母用于发酵‘桑娇维赛’葡萄汁时,葡萄酒颜色并未发生不良变化。β-葡萄糖苷酶对花色苷降解作用的差异可能与底物结构特征和β-葡萄糖苷酶的性质有关[57]。羟基肉桂酸脱羧酶能促进乙烯基苯酚类吡喃花色苷的形成,季也蒙毕赤酵母和裂殖酵母均具有较高的该酶活性[58-59]。
此外,甘露糖蛋白这种大分子胶体通过空间位阻稳定作用,减少单宁和花色苷聚集沉淀,增强葡萄酒颜色稳定性[60]。Valerie等研究从葡萄酒中提取到的6种多糖物质对单宁聚集的影响,发现只有甘露糖蛋白能显著降低单宁聚合形成的胶体颗粒的大小[61]。Alcalde等通过对葡萄酒色素成分分析发现,添加甘露糖蛋白能降低冷处理后葡萄酒中的花色苷衍生物(黄烷醇-花色苷复合物、vitisin A)的损失[62]。
表1列出了一些非酿酒酵母对葡萄酒酿酒质量参数的改善作用,几种非酿酒酵母已存在商业化产品[63]。
2 混合发酵动力学研究和混合发酵条件选择
混合发酵动力学是研究在同一发酵环境中多菌种的动态发酵活动。非酿酒酵母菌种实际应用时是否能顺利完成酒精发酵达到预期要求,需要混合发酵动力学指标来评估。除此之外,混合发酵条件的选择需要在充分了解不同酵母菌代谢活动过程后进行。
2.1 混合发酵动力学研究
葡萄酒酒精发酵期间酵母菌生长遵循“S”形生长曲线,单独发酵时,酵母菌在第3~5天进入生长稳定期,细胞数可达108cfu/mL左右[64]。非酿酒酵母和酿酒酵母同时接种条件下,酵母之间存在明显的竞争关系[65]。酵母菌的总生长量一致或高于酿酒酵母纯培养的生长量的情况都有出现[66]。
有孢汉逊酵母和酿酒酵母以相同的比例同时接种进行混合发酵时,酿酒酵母的生长曲线与纯发酵接近,酿酒酵母的生长未受到混合发酵的影响[67]。而李婷等利用毕赤酵母与酿酒酵母等比例接种的混合发酵过程中,酿酒酵母数量低于其纯种发酵时的数量[68]。随着毕赤酵母接种比例提高,其对酿酒酵母的影响愈发显著。表现为酿酒酵母达到稳定期时间推迟且细胞数降低[69]。
Viana等发现,混合发酵条件下发酵前期葡萄糖消耗速率降低,并且葡萄糖消耗速率下降程度与非酿酒酵母接种比例成呈负相关。嗜高渗汉逊酵母和酿酒酵母接种比例为75∶25和90∶10的混合发酵条件分别使葡萄糖消耗速率下降了10%~20%和20%~30%[70]。然而葡萄糖消耗速率下降不改变酿酒酵母在葡萄汁中的生长优势,非酿酒酵母通常存在于发酵初期阶段[71]。发酵结束时非酿酒酵母的数量取决于其对乙醇的耐受性,不同非酿酒酵母的乙醇耐受性存在差异。如荆雄等发现,柠檬形克勒克酵母与酿酒酵母混合发酵,在发酵结束时其几乎全部衰亡,而东方伊萨酵母混合发酵时,其细胞浓度在发酵结束时仍保持在105cfu/mL[72]。说明东方伊萨酵母对乙醇的耐受性高于柠檬形克勒克酵母。
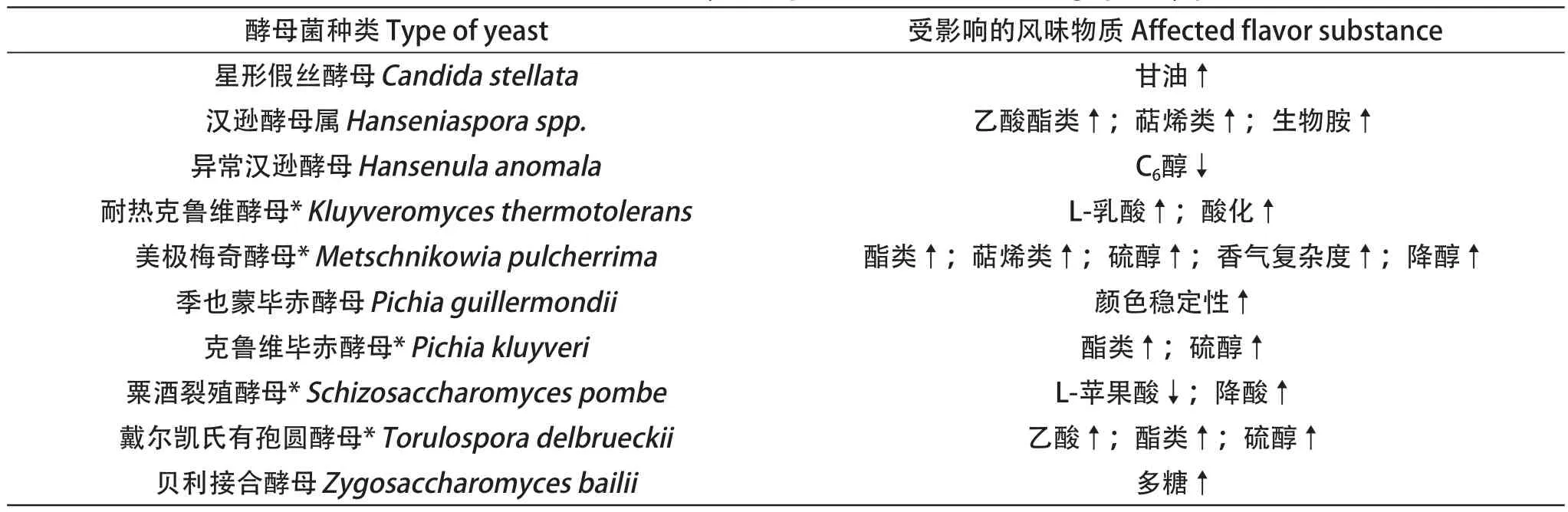
表1 非酿酒酵母品种对葡萄酒酿酒质量参数的影响Table 1 Influence of non-Saccharomyces species on winemaking quality parameters
2.2 混合发酵接种方式
混合发酵的接种方式有同时接种和连续(顺序)接种。同时接种混合发酵条件下,非酿酒酵母对于酵母菌生长动力学的影响和其细胞浓度、存活的时间和其生长代谢特性有关。酿酒酵母和非酿酒酵母的生长都有可能受到具有竞争优势一方的抑制。例如,Renault等对比分析了连续接种和同时接种发酵葡萄酒中的酯类物质发现,丙酸乙酯、异丁酸乙酯和二氢肉桂酸乙酯水平与非酿酒酵母戴尔凯氏有孢圆酵母的生长状况(最大菌数水平)直接相关,被视为非酿酒酵母的活动标记物,与连续发酵相比,同时接种发酵降低了这类物质的产生[9]。而有些非酿酒酵母在混合发酵竞争时处于优势地位。例如毕赤酵母对极端环境条件有更高的耐受性,比酿酒酵母具有更强的竞争优势[73],在同时接种条件下,往往使酿酒酵母的生长受到抑制。
同时接种增强了非酿酒酵母和酿酒酵母之间的相互作用,这种相互作用可能会引发酶类和挥发性物质的产量提升。李婷等发现,同时接种比提前接种的发酵体系中有更高的酯酶活性积累量[66]。在Renault的同一研究中,同时接种发酵条件下产生了更多乙酸异丁酯和乙酸异戊酯,赋予葡萄酒水果香气[9]。Philippe等发现,乙酸异戊酯、乙酸苯乙酯、丁酸乙酯和癸酸乙酯产量和酿酒酵母的最大菌数在同时接种发酵条件下显著高于顺序接种[16]。
提前接种酵母菌有利于其在发酵前期有更高的代谢表达量[74],提前接种非酿酒酵母有利于非酿酒酵母与香气代谢有关的酶类积累,避免酿酒酵母受到过分抑制。因此,提前接种非酿酒酵母进行连续混合发酵是一种常见的接种策略。由于酵母菌对氨基酸的利用存在偏好性,氮源不足会成为后接种酵母菌不能良好繁殖的主要原因[75]。王星晨在上述同一研究中发现,在提前接种条件下,有孢汉逊酵母的最高细胞浓度高于同时接种,发酵后期的衰减速率也更低[67],提前接种延缓了非酿酒酵母衰亡的速度。在实际生产中,酿酒师会根据葡萄酒的风格特点选择合适的非酿酒酵母以及接种方式。
2.3 混合发酵接种比例和数量
对于多菌种发酵体系来说,由于有限营养资源的竞争和相互抑制的关系更为复杂,非酿酒酵母和酿酒酵母的接种比例以及酵母菌数量对葡萄酒或培养物的风味香气特征的影响并未出现简单的放大和叠加效应,而是酵母生长量、存活时间和生长代谢特性的综合性体现。
酵母菌接种比例对葡萄酒风格特点有调节作用。Lee等[76]研究发现,接种比例是混合发酵调节木瓜酒风味的重要因素,土星拟威尔酵母(Williopsis saturnus)与酿酒酵母10∶1接种增加了木瓜酒中乙酸酯的相对含量,1∶1和1∶10接种则使乙醇酯、高级醇和2-乙酸苯乙酯含量增加。王倩倩等利用毕赤酵母进行混合发酵发现,较高比例同时接种毕赤酵母与酿酒酵母(1∶1、4∶1、10∶1)混合发酵条件下[77]对促进‘爱格丽’干白葡萄酒中乙酸异戊酯、高级脂肪酸及其酯类、异戊醇和苯乙醇的生成更加有利,不同接种比例间葡萄酒呈现出不同的风格,4∶1接种葡萄酒的花香特征明显,1∶1接种葡萄酒的柑橘类香气突出。
混合发酵的发酵剂是由一种或多种非酿酒酵母以合理比例混合作为复合发酵剂与酿酒酵母共同组成。白梦洋[78]发现酿酒酵母、毕赤酵母和东方伊萨酵母三者混合发酵时,毕赤酵母在竞争中处于优势地位,对酿酒酵母的抑制作用非常明显,因此发酵后主要由酿酒酵母产生的醇类物质相对含量下降;酯类相对含量显著增加,均高于纯种发酵或两两混合发酵。李艺凡[79]等利用3种非酿酒酵母H8、全美梅氏酵母、葡萄有孢汉生酵母作为混合发酵剂与酿酒酵母混合发酵时发现,葡萄酒中存在某些独有的挥发性化合物如薄荷醇、苯乙醇、柠檬烯、十一醛和肉豆蔻醛,且其在感官评价中香气浓郁度、酸甜协调性和酒体均优于酿酒酵母纯种发酵。
3 菌种相互作用机制
混合发酵过程存在微生物相互作用。大量研究表明,非酿酒酵母与酿酒酵母混合发酵与单菌株发酵之间代谢活动存在差异。混合发酵中存在或缺失不同于纯种发酵的菌株特异性组分。在‘长相思’葡萄汁中混合培养光滑念珠菌和毕赤酵母,经过65代繁殖,混合发酵条件下的菌株已经显示出可遗传的生长代谢差异,这种微生物相互作用被称为共同进化,共同进化对于优化酵母菌的发酵特性具有一定意义[80]。
酿酒酵母和非酿酒菌种之间的相互作用表现为协同、竞争或拮抗关系,其机制可以描述为:(1)代谢物(乙醛、乙偶姻、葡萄糖、果糖等)的补充消耗或交换,表现出协同效应;(2)营养资源(氧气、维生素、矿物质、碳源、氮源)的竞争;(3)具有拮抗作用的物质(乙醇、乙酸、乳酸、中链脂肪酸、嗜杀因子、抗菌肽)的分泌引起其他微生物代谢水平降低或死亡[81];(4)细胞膜(壁)成分介导的或代谢物介导的细胞直接接触共聚合,结果是细胞的生存能力提高或诱导细胞死亡。
刘茜等发现酿酒酵母和东方伊萨酵母对乙酸和乳酸的代谢差异是混合培养中酿酒酵母的生长受到抑制造成。乙酸和乳酸对酵母菌生长都有不同程度的抑制作用,东方伊萨酵母可以代谢消耗酿酒酵母产生的乙酸而酿酒酵母不能消耗前者产生的乳酸[82];Yamaoka发现乳酸克鲁维酵母(Kluyveromyces lactis)代谢产生的甘油、丙氨酸等物质可以改变酿酒酵母细胞内氨基酸水平,延长其细胞生命周期[83]。
蛋白质代谢物(嗜杀因子、抗菌肽)的产生对混合发酵中酵母菌种的生长和优势地位的确立有着显著的影响。嗜杀因子与酵母菌细胞壁受体和细胞膜受体结合,通过破坏细胞壁受体和细胞膜通透性、阻碍DNA合成等机制诱导细胞死亡[84]。非酿酒酵母比酿酒酵母具有更广谱的嗜杀能力,利用这一特点可对葡萄汁中有孢汉逊酵母、酒香酵母、德克酵母等破坏性酵母增殖进行控制[85]。陈玉茜利用原生质体融合技术进行酿酒酵母的选育,发现融合子具有更加广谱的抗菌能力[84]。Branco等发现酿酒酵母在酒精发酵时分泌的抗菌肽对某些非酿酒酵母菌(如布鲁塞尔德克酵母)和细菌(酒球菌)有抑制作用,这些抗菌肽与酿酒酵母中的3-磷酸甘油醛脱氢酶蛋白片段有一致性[86]。
4 展望
首先,混合发酵涉及到众多的非酿酒酵母,这些非酿酒酵母往往来源于自然环境,非酿酒酵母的分离鉴定、选育到实际应用面临许多困难。商业化生产的非酿酒酵母需要具备耐受性强且发酵特性良好的特点。其次,在微生物变量更加复杂的情况下,酵母菌的代谢活动、相互作用和混合发酵动力学变化规律还未研究清楚。另外,为了实现混合发酵的实际应用,混合发酵条件的控制需要精细到具体的酿造工艺环节,考虑到营养环境变化对混合发酵效果的影响,进行中型、大型混合发酵葡萄酒生产试验十分必要。最后,在基因组和转录组学层面研究酵母菌种群结构、非酿酒酵母酿造特性、多菌种相互作用机制是从根本上认识和调控混合发酵葡萄酒品质的基础,目前逐渐成为研究热点。

