清热利湿方对特应性皮炎小鼠皮肤屏障蛋白表达的影响
陈梦娇,朱晓燕
(浙江中医药大学附属绍兴中医院,浙江 绍兴 312000)
特应性皮炎是临床常见的慢性复发性皮肤病,常伴发哮喘和过敏性鼻炎,临床表现为全身皮肤泛发红斑、丘疹、丘疱疹、皲裂、糜烂渗出,且瘙痒剧烈[1]。目前该病主要以抗组胺药、钙调磷酸酶抑制剂及糖皮质激素等对症治疗,但这类药物长期使用存在潜在的不良反应[2-3]。清热利湿方是绍兴中医院用于治疗特应性皮炎的常用中药方,可明显减轻患者瘙痒及皮损,改善皮肤屏障功能,但其作用机制尚不清楚。本实验通过观察特应性皮炎小鼠皮肤病理变化及皮肤组织中表皮丝聚蛋白(FLG)、兜甲蛋白(LOR)、表皮蛋白(IVL)的表达水平,探讨了清热利湿方治疗特应性皮炎的分子生物学机制,现将结果报道如下。
1 实验材料与方法
1.1实验动物 SPF级BALB/c雌性小鼠60只,6周龄,体重18~22 g,购于上海西普尔-必凯实验动物有限公司,动物合格证号:20130016007771,饲养于浙江中医药大学动物实验中心。置于独立通风系统单笼饲养,室温24~25 ℃,湿度40%~50%,自由饮食和饮水。所有实验步骤均经浙江中医药大学动物实验及实验动物福利委员会审核批准。
1.2主要试剂 卵清蛋白购自Sigma公司,货号:S7951/O1641;TRIzol®Reagent (Invitrigen,Cat.No.15596-018);逆转录试剂盒:RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas,K1622),Realtime-PCR 试剂盒:Maxima SYBR Green/ROX qPCR Master Mix (2X)(Thermo Fisher,K0222),FLG、LOR及IVL引物合成自Invitrigen公司。
1.3主要实验药物 清热利湿方组成:金银花12 g、白花蛇舌草12 g、土茯苓9 g、乌桕叶9 g。药物适当粉碎后,放入砂锅用3倍量水浸泡30 min,武火烧开后用文火煎煮约2 h,水量减少至约1倍药物体积为宜,然后过滤,取出药汁,再加入适量水,复煎1次,时间约30 min,合并2次滤液,静置8 h,取上清液,加热浓缩为生药量4 g/mL浓度的水煎剂待用。
1.4实验方法 将小鼠随机分成空白组、模型组、清热利湿方低剂量组、清热利湿方中剂量组、清热利湿方高剂量组、西替利嗪组,每组10只。用电动剃须刀剃刮每只小鼠的背部毛发,并使用脱毛膏将残留的毛发脱尽,用胶布反复粘贴10次。空白组用生理盐水、其余组用100 μg/100 μL浓度的卵清蛋白溶液100 μL滴在1 cm×1 cm纱布上并贴于脱毛部位,外用胶带固定1周。间隔2周后重复上述步骤,共致敏3次。在最后一次致敏前一周开始给药,清热利湿方低、中、高剂量组分别给予1 g/mL、2 g/mL、4 g/mL的清热利湿方灌胃,西替利嗪组给予25 mg/mL的西替利嗪灌胃,空白组、模型组灌胃等量的生理盐水,均1次/d,连续2周。
1.5观察指标及方法
1.5.1皮肤病理HE染色观察 灌胃结束后24 h内处死各组小鼠,取背部皮肤,固定于中性福尔马林溶液中,石蜡包埋,切片,二甲苯脱蜡,梯度乙醇洗脱至水,进行HE染色,光镜下观察。
1.5.2皮肤组织中FLG、LOR及IVL mRNA表达RT-PCR检测 从液氮中取出各组小鼠背部皮肤,使用TRIzol试剂根据制造商的方案分离总RNA,通过逆转录将RNA转为cDNA,使用SYBR Green PCR Mix试剂盒,在20 μL的反应体积中进行实时PCR分析。以β-激动蛋白做标准化内参,引物序列:LOR正向引物5’-TCTCAGCAGACCAGTCAGACCTC-3’,反向引物5’-CCTCCACAGCTACCACCTCCTC-3’,编码长度83 bp;IVL正向引物5’-CATAAGCCAGAACTGTACCTGA-3’,反向引物5’-GATGCTGCTTCTCTTCCAATTG-3’,编码长度127 bp;FLG正向引物5’-CATGAGCACGAACAGCCAGAGTC-3’,反向引物5’-GTCCTCTTCCTCCTGAGCCTGATC-3’,编码长度190 bp;β-actin正向引物5’-CTACCTCATGAAGATCCTGACC-3’,反向引物5’-CACAGCTTCTCTTTGATGTCAC-3’,编码长度90 bp。用RT-PCR检测试剂盒进行实时定量PCR分析。通过熔解曲线分析验证PCR产物。相对表达水平用ΔΔ计算CT值。每个标本设3个复孔。
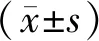
2 结 果
2.1各组小鼠背部皮损情况 空白组小鼠背部皮肤未见明显增厚,无红斑丘疹形成;模型组小鼠背部皮肤肉眼可见明显增厚、红斑、脱屑、渗出、糜烂及结痂等皮损现象;各药物组小鼠背部皮肤上述表现明显轻于模型组,清热利湿方低剂、中剂量组剩余轻微皮肤增厚、肿胀,清热利湿方高剂量组及西替利嗪组无明显渗出、出血或结痂。见图1。
2.2各组小鼠背部皮肤病理表现 HE染色显示:模型组小鼠背部表皮角化过度,棘层明显肥厚,表皮可见轻度细胞间水肿及炎症细胞浸润;各药物组小鼠背部表皮棘层轻度肥厚,细胞间水肿较轻,清热利湿方高剂量组病理表现与西替利嗪组相当。见图2。
2.3各组小鼠皮肤组织中FLG、LOR、IVL mRNA表达情况 模型组小鼠皮肤组织中FLG、LOR、IVL mRNA表达水平均明显低于空白组(P均<0.05)。各药物组小鼠皮肤组织中FLG、LOR、IVL mRNA表达水平均明显高于模型组(P均<0.05),清热利湿方低、中、高剂量组各指标呈浓度梯度依赖性增高,清热利湿方高剂量组与西替利嗪组各指标比较差异均无统计学意义(P均>0.05)。见表1。
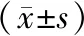
表1 各组小鼠皮肤组织中FLG、LOR、IVL mRNA表达水平比较
3 讨 论
特应性皮炎多起病于儿童期,常有过敏进行曲(atopic march)的最初表现,包括哮喘、食物过敏和过敏性鼻炎[4]。有研究显示全球有超过20%的儿童及3%的成年人患有特应性皮炎[5]。近年来该病患病率在工业化国家中呈显著增高趋势[6],正逐渐成为一个社会共同面临的健康问题。
特应性皮炎的致病因素复杂,全基因组关联研究表明皮肤屏障功能受损及个体免疫异常是引起该疾病的主要原因[7]。FLG、LOR及IVL是涉及角化包膜形成的关键蛋白,对皮肤屏障功能的形成起着不可替代的作用[8-9]。在中度至重度的特应性皮炎病例中,大约50%归因于FLG基因突变[10]。FLG的前体为一个约500 kDa的磷酸化组氨酸多聚蛋白——丝聚蛋白原,丝聚蛋白原合成后被磷酸化储存在角质透明颗粒中,经去磷酸化蛋白水解成约35 kDa的单体丝聚蛋白肽,这些有活性的丝聚蛋白肽协助角蛋白丝聚集形成致密的角蛋白纤维束,并在转谷酰胺酶的作用下形成一个不能溶解的屏障——角质包膜,阻止水分流失,同时也保护机体不受环境影响。FLG从角蛋白纤维束中解离后能进一步降解成自由氨基酸和吸水性衍生物,可通过结合水而维持皮肤的水分,因此FLG表达减少和缺失与皮肤干燥有关,它能影响角质层的渗透作用,导致角质层含水量下降,同时引起表皮水分丢失量增加[11]。LOR作为表皮角质化包膜的主要成分,在角化期间最初表达于颗粒层,其占角质层总蛋白质量的70%~85%[12]。IVL是表皮角化包膜的早期前体蛋白,是其他角化包膜蛋白附着的支架[13]。因此,恢复FLG、LOR、IVL的表达有助于表皮屏障功能障碍的复原。
目前,临床对于特应性皮炎的治疗以抗过敏药(如西替利嗪、氯雷他定等)、糖皮质类固醇激素、钙调磷酸酶抑制剂为主,其中抗过敏药可导致头痛、口干、嗜睡,甚至诱发青光眼及引起心律失常等问题,糖皮质激素长期使用可导致色素沉着或减退、毛细血管扩张、皮肤萎缩等[14-15],钙调磷酸酶抑制剂价格昂贵且有潜在致癌风险,因而这些药物不宜长期使用。
中医理论认为特应性皮炎属于中医“奶癣”“四弯风”“血风疮”范畴。病因为先天禀赋不耐,胎毒遗热,心火过旺,外加后天喂养不当,饮食失调,脾虚湿从内生,复外感风、湿、热诸邪,阻滞肌肤与气血搏结,引起脏腑功能紊乱,卫气不得宣泄,水湿不得运化,气血津液不得濡养肌肤而成[16-17]。中医药可通过多种途径达到祛风利湿、清热润燥的功效。清热利湿方由金银花、白花蛇舌草、土茯苓和乌桕叶组成,主要功效为清热祛湿、疏风解毒,临床用于治疗急性期特应性皮炎疗效确切。
本实验结果显示,各药物组小鼠皮损严重程度均轻于模型组,皮肤组织中FLG、LOR、IVL mRNA表达水平均明显高于模型组,且清热利湿方低、中、高剂量组LG、LOR、IVL mRNA表达水平呈浓度梯度依赖性增高,清热利湿方高剂量组与西替利嗪组各指标比较无明显差异。提示清热利湿方可减轻特应性皮炎小鼠的皮损严重程度,上调皮肤屏障功能相关的关键蛋白的表达,不失为一个治疗特应性皮炎新的可供选择的药物。然而特应性皮炎的发病机制复杂且诱发因素较多,加之清热利湿方为中药复方,其成分复杂,具体作用机制仍有待后续深入研究。
利益冲突:所有作者均声明不存在利益冲突。

