利用不同碳源调控椰果凝胶产品的结构和质构特性
李昭锋,曹潇,朱杰,陈思谦,于泓鹏
(1.广东工业大学轻工化工学院,广东广州 510006)(2.东莞理工学院化学工程与能源技术学院,东莞理工科技创新研究院,中国轻工业健康食品开发与营养调控重点实验室,广东东莞 523808)
椰果是一种以细菌纤维素和水组成的凝胶状食品,因其爽滑、多汁、脆嫩、细腻而有弹性的独特口感而备受消费者的青睐[1,2]。椰果独特的口感源自其结构和质构特性,虽然凝胶中的纤维素含量很低,通常只占凝胶总重量的1%~10%,但纤维素的纯度很高[3]。细菌纤维素具有无毒性、良好的液体吸附能力和力学性能[4],因此椰果凝胶被广泛应用于食品工业领域[5]。在东南亚,椰果一直被用作一种传统甜点食品nata-de-coco的原料[6]。同时,目前我国市面上部分的奶茶、饮料、果冻类产品中也有添加椰果凝胶成分。此外,椰果凝胶也可以用于改善食品的质地,例如用作乳化剂来防止巧克力饮料沉淀和用作冰淇淋中的稳定剂[7,8]。
椰果是通过纤维素产生菌在含有碳源和氮源的培养基中发酵获得[9]。工业上通常使用木糖驹形氏杆菌(原葡糖醋杆菌或木醋杆菌)(Komagataeibacter原Gluconacetobacter)作为生产菌株,同时使用葡萄糖作为培养基碳源[10]。不同木糖驹形氏杆菌的菌株对不同碳源的代谢活性存在差异[11],进而影响椰果凝胶的产量[12]、纤维素浓度、结构和质地[13]。以往研究表明,甘露醇作为碳源时,木糖驹形氏杆菌PTCC 1734[14]和ATCC 53524[15]的椰果凝胶产量和浓度均高于使用葡萄糖。对于同一株菌,使用果糖作为碳源产生的椰果凝胶较葡萄糖作为碳源的纤维结构更紧密[16]。这些特性会影响椰果凝胶的力学性能[13]。因此,在不同碳源条件下培养木糖驹形氏杆菌,是一种获得具有不同质地的椰果凝胶的潜在方法。本文使用两株木糖驹形氏杆菌(ATCC 23767和ATCC 53582),研究四种不同类型的碳源(葡萄糖、果糖、甘露醇、乙醇)对椰果凝胶产量的影响,着重讨论不同碳源对高产菌株所合成的椰果凝胶的结晶结构、纤维网络及多孔结构和力学性能(凝胶强度、黏弹性能及拉伸性能)的影响。研究结果将为建立椰果凝胶质地的分析方法,利用不同碳源生产具有不同质地和口感的椰果凝胶类食品提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
木糖驹形氏杆菌购自美国模式培养物集存库(American Type Culture Collection,ATCC),保藏编号为ATCC 53582和ATCC 23767,文中均以保藏编号表示。
1.1.2 培养基
液体种子培养基:葡萄糖20 g/L、无水磷酸氢二钠2.7 g/L、一水合柠檬酸1.26 g/L、酵母提取物5 g/L、蛋白胨5 g/L。固体培养基:在液体培养基的基础上添加琼脂粉20 g/L。
发酵培养基:将液体种子培养基中的葡萄糖设置梯度浓度(10 g/L、20 g/L、30 g/L、40 g/L和50 g/L),并分别替换成相同浓度的果糖、甘露醇、和乙醇,其它条件不变。
所有培养基均使用1 mol/L盐酸或氢氧化钠溶液调节培养基初始pH至5.0,115 ℃高压灭菌25 min[17]冷却后使用。
1.1.3 实验试剂
酵母提取物、蛋白胨购于赛默飞世尔(ThermoFisher)科技公司;琼脂粉购于广东环凯微生物科技有限公司;葡萄糖、无水磷酸氢二钠、一水合柠檬酸、浓盐酸、氢氧化钠、D-果糖、甘露醇、无水乙醇、山梨酸钾均为分析纯。
1.2 仪器与设备
ME104E万分之一分析天平,梅特勒-托利多国际贸易(上海)有限公司;Smart-Q15去离子纯水机,上海和泰仪器有限公司;PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;YM50立式压力蒸汽灭菌器,上海三申医疗器械有限公司;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;DNP-9162电热恒温培养箱,上海精宏实验设备有限公司;MCR702流变仪,爱尔兰安东帕(Anton Paar)公司;CP-25冲片机,扬州市道纯试验机械厂;TA.XT PlusC质构仪,英国SMS公司;ME104E液氮罐,查特低温设备(成都)有限公司;Scientz-10ND冷冻干燥机,宁波新芝冻干设备股份有限公司;MiniFlex 600台式X射线衍射仪,日本理学(Rigaku)公司;ETD-2000离子溅射仪,北京博远微纳科技有限公司;EM-30 PLUS台式扫描电镜,韩国库赛姆(COXEM)公司。
1.3 实验方法
1.3.1 椰果凝胶的生产
菌株活化:将甘油管中的木糖驹形氏杆菌以划线接种的方法转接到固体培养基上,置于恒温培养箱中30 ℃培养3 d。
种子液制备:挑取多个单菌落置于培养基中,然后于恒温培养箱中30 ℃培养2~4 d。
接种和培养:将种子液以10%的接种量接种于发酵培养基中,然后置于恒温培养箱中30 ℃下静置培养9 d。
1.3.2 椰果凝胶的处理
在培养结束后,将收获的椰果凝胶用去离子水冲洗3~5次以去除残留在膜表面的培养基。随后,将椰果凝胶在0.1 mol/L氢氧化钠溶液中搅拌加热至95 ℃并维持20 min以达到纯化效果。冷却至室温后,在搅拌下用去离子水洗涤多次,直至使用pH试纸检测凝胶pH值接近7。椰果凝胶低温保藏,或者在液氮罐中预冻3~5 min后低温冷冻干燥48 h。椰果凝胶产量以每升培养基生产的冻干椰果重量计算,总碳源转化率按下列公式计算,纤维素浓度以干重除以湿重计算。

1.3.3 X射线衍射
采用X射线衍射仪(X-ray diffraction,XRD)分析椰果凝胶样品的晶体结构和结晶度。测试条件如下:工作电压40 kV,工作电流为15 mA,CuKα辐射波长为0.15406 nm,步长为0.01 °,扫描速度为2.5 °/min,在2θ为10 °~30 °之间记录衍射图样。使用Origin软件对衍射图谱进行基线校准和峰形拟合。结晶度指数(CI)表示为所有晶体峰拟合面积占总衍射峰拟合面积的百分比。使用Scherrer公式[18]计算晶体的尺寸:

式中:D为平均晶体宽度;K为形状因子(0.9);λ为辐射波长;β为衍射峰的半峰宽;θ是衍射峰的中心角度。
1.3.4 扫描电子显微镜
使用锋利的刀片沿垂直方向将冷冻干燥的椰果凝胶切成尺寸约为3×3 mm的小块。然后通过离子溅射在样品表面喷金,最后使用扫描电子显微镜(Scanning electron microscopy,SEM)进行成像观察。机器参数设置如下:加速电压为5 kV,工作距离为6~10 mm(根据样品的厚度进行调整)。取景至少从三个不同样品的三个不同的位置随机进行,放大倍数为10000倍。
1.3.5 压缩/松弛测试和小振幅振荡剪切测试
使用应变控制型流变仪在25 ℃下测量椰果凝胶的凝胶强度和黏弹性。该方法遵循Lopez-Sanchez[19]等的先前报道。使用平行板(PP 40)进行测试。将椰果凝胶放置于两块平行板之间的中心区域并适当将凝胶表面抹平,以减小凝胶与平行板之间空气的影响。将板间距调节至与凝胶高度相同,法向力由压力传感器(50 N)测试[19]。每个测试循环包括以恒定速度(1 μm/s)将凝胶法向压缩100 μm的压缩过程和维持法向应变,以10 rad/s的剪切频率和0.01%的恒定剪切应变(处于线性粘弹性区域)进行120秒振荡测试的松弛/剪切过程,两个过程交替进行。记录压缩/松弛过程中的法向应力及振荡测试的弹性模量(G’)和损耗模量(G’’)。进行3次重复试验。
1.3.6 多孔弹性理论模型
采用Origin软件对法向压缩阶段椰果凝胶的力学行为进行建模。该方法遵循Lopez-Sanchez[19]和Bonilla[20]等人的报道。在压缩阶段的塑性变形区域(线性区域)使用线性方程进行拟合(图1)。其中,t为测试时间,m为拟合直线的斜率。表观渗透率k(受凝胶孔隙结构影响)由以下公式[19]得出:

式中:v为压缩速率;r为凝胶的半径;b为拟合直线的截距;h0为凝胶初始厚度。

图1 多孔弹性理论拟合模型[19]Fig.1 Poroelasticity theory fitting model[19]
1.3.7 轴向拉伸测试
使用质构仪对椰果凝胶进行拉伸测试。该方法遵循Mckenna[21]等人的描述,并稍加修改。按照ISO 37-4的标准,使用冲片机将椰果凝胶切割成哑铃形条带(宽面尺寸:6×35 mm;窄面尺寸:2×10 mm)。条带的两端以测试夹具夹住,并以10 mm/min的恒定速度进行拉伸。使用5 N的拉力传感器记录拉伸力,并计算条带断裂点的拉伸应力和应变。杨氏模量定义为拉伸阶段的应变-应力曲线线性变化区域的斜率。至少进行12次重复试验以确保实验精度。
1.3.8 数据分析
椰果凝胶的产量、总碳源转化率、结晶度和晶体尺寸均通过3组独立样品测定取算术平均值。纤维素网络的孔径为通过ImageJ软件在SEM图像上进行50次随机测量的平均值。数据通过SPSS软件进行统计分析,结果以平均值±标准差表示。组内、组间比较均采用t检验进行分析,当p<0.05时认为具有显著性差异。
2 结果与讨论
2.1 发酵碳源种类及其浓度对椰果产量的影响

图2 ATCC 53582(a、b)和ATCC 23767(c、d)的椰果产量(a、c)和总碳源转化率(b、d)Fig.2 Yields of coconut (a, c) and total carbon source conversion rates (b, d) of ATCC 53582 (a, b) and ATCC 23767 (b, d)
由图2可见,在所有测试的碳源中,ATCC 53582的椰果凝胶产量和总碳源转化率均显著高于菌株ATCC 23767。根据Florea[22]等人的报道,ATCC 53582具有两个额外的纤维素合成酶(Acetobactercellulose synthase,Acs)操纵子(Acs2和Acs3)及其包含的与纤维素合成相关的基因(AcsAB2、AcsC2、AcsAB3和AcsC3),这可能是菌株ATCC 53582高产的原因。当乙醇为碳源时,ATCC 53582的椰果产量较其它碳源低,而当葡萄糖为碳源且浓度为30或40 g/L时,ATCC 23767的椰果产量较低,这可能与不同菌株在代谢过程中的生理活性差异有关[23]。当葡萄糖为碳源且浓度为20 g/L时,ATCC 53582的椰果产量最高(6.07 g/L),这个结果与史志强[24]等人的结果一致。以果糖为碳源时,ATCC 53582的椰果产量随着果糖浓度的升高而增加,这与Chao[25]等人的研究结果相似。根据Ross[26]等人的研究,果糖在木糖驹形氏杆菌代谢过程中产生的酸性副产物较少,发酵前后培养基pH值没有明显下降[23],但葡萄糖为碳源会产生大量葡萄糖酸,酸性物质的积累导致椰果产量降低,苏建宇[27]等人也证明了相同的结论。甘露醇为碳源时培养基pH值的变化与果糖类似[28],而乙醇为碳源则会产生大量乙酸[29]。
2.2 发酵碳源对椰果纤维素晶体结构的影响

图3 在四种不同碳源条件下产生的椰果样品的XRD衍射图Fig.3 XRD patterns of coconut samples produced under four different carbon source conditions

表1 在不同碳源下生产的椰果纤维素的晶体结构Table 1 The crystal structure of coconut cellulose produced under different carbon sources
由图3可见,所有椰果样品(碳源浓度30 g/L,生产菌株ATCC 53582)在2θ为14.4 °,16.8 °和22.6 °附近均有较强的衍射峰,分别由纤维素Iα型(100)、(010)和(110)晶面的反射引起[30]。此外,所有椰果样品的结晶度均高于85%,并且(100),(010)和(110)晶面的D值均在一定的范围(4~8 nm)。Ruka[31]等人发现ATCC 53524在不同类型的培养基中生产的椰果纤维素具有相似的结晶度(范围68%~79%)。Sheykhnazari[32]等人发现在不同培养时间下生产的椰果纤维素也具有较高的结晶度(75%~80%)。这些结果表明在不同的培养条件下生产的椰果纤维素均具有较高的结晶度。
2.3 发酵碳源对椰果纤维网络形态的影响

图4 由四种不同碳源产生的椰果样品的SEM图Fig.4 SEM images of coconut samples produced from four different carbon sources
由图4可知,果糖培养基生产的椰果样品(碳源浓度30 g/L,生产菌株ATCC 53582)具有最小的平均孔径(0.48 μm),而从乙醇培养基中获得的椰果样品具有最大的孔径(1.06 μm)。另外,从葡萄糖和甘露醇培养基中获得的椰果样品具有相似的孔径,分别为0.61 μm和0.57 μm。Kaewnopparat[33]等人使用另一株木糖驹形氏杆菌在以甘露醇为碳源的培养基中产生的椰果样品的纤维孔径(0.02 μm)小于以甘油为碳源产生的椰果样品(0.03 μm)。也有研究表明,使用产生葡萄糖酸较少的碳源生产的椰果样品具有更紧密的纤维结构,孔隙率更低[16]。结果表明,产生较少酸性副产物的碳源能减小椰果样品纤维网络的平均孔径。
2.4 发酵碳源对椰果凝胶的强度和恢复能力的影响

图5 四种不同碳源产生的椰果凝胶在压缩/松弛测试中的法向应力变化Fig.5 Changes in normal stress of coconut gels produced from four different carbon sources in the compression/relaxation test

表2 将压缩/松弛测试数据与多孔弹性模型拟合得到的椰果凝胶的力学参数Table 2 The mechanical parameters of coconut gels obtained by fitting the data of compression/relaxation test to the poroelastic model

图6 储能模量(G’)与椰果凝胶高度(a)的关系图,G’与纤维素浓度(b)的关系图Fig.6 The relationship between storage modulus (G′) and height of coconut gels (a), the relationship between G′ and cellulose concentration (b)
在压缩阶段,所有椰果凝胶(碳源浓度30 g/L,生产菌株ATCC 53582)均表现出明显的黏弹性区域(样品高度减少量为0~0.025 mm)和塑性变形区域(0.05~0.1 mm)。该结果与Chen[13]等人的结果类似。压缩过程中,从果糖培养基中产生的椰果凝胶具有更小的纤维孔径(图4b),因此在压缩阶段法向应力增加相对较快[13]。在中和高压缩应变下,所有椰果凝胶的法向应力的增加量分别约为低压缩应变下的2和6倍(图5)。Bonilla[20]等人发现在较高的压缩应变下椰果凝胶中出现大量的纤维纠缠和形变,导致法向应力的剧烈增加。在松弛阶段,所有椰果凝胶的法向应力先迅速下降,再缓慢降低,这是由于水分不能及时完全地返回纤维网络结构中,该过程受纤维孔隙的影响。因此从葡萄糖、果糖和甘露醇培养基中产生的椰果凝胶的恢复能力(回复率80%、79%和68%)低于从乙醇培养基获得的椰果凝胶的恢复能力(回复率82%)。从表2可知,碳源为葡萄糖、果糖和甘露醇的椰果凝胶均具有较大的纤维浓度(1.36~3.64%)和较小的k值(0.44~3.98),而碳源为乙醇的椰果凝胶的纤维浓度最小(0.60~0.97%),k值最大(6.55~42.70),这与SEM的结果相对应(图4d)。
2.5 发酵碳源对椰果凝胶黏弹性的影响
由图6可知,在相同的椰果凝胶高度(0.50 mm)下,从葡萄糖、果糖和甘露醇培养基中产生的椰果凝胶(碳源浓度30 g/L,生产菌株ATCC 53582,下同)的储能模量G’(分别为210 kPa、230 kPa和170 kPa)高于乙醇培养基产生的椰果凝胶的储能模量(17 kPa)(图6a),说明乙醇发酵得到的凝胶强度较弱。Whitney[34]等人发现椰果凝胶的模量大小通常由纤维缠结的数量决定,高纤维浓度的椰果凝胶在剪切应变时纤维缠节数量增加更多。Chen[13]等人的研究发现,高纤维浓度(2.4%)的椰果凝胶的储能模量(1.2 kPa)高于低纤维浓度(1.6%和1.3%)的椰果凝胶的储能模量(0.8 kPa和0.6 kPa)。我们的结果与之相似(图6)。在相同的纤维素浓度下,从果糖培养基中产生的椰果凝胶的储能模量高于其它三种椰果凝胶(图6b),这与果糖培养基得到样品的较小孔隙结果一致(图4a)。
2.6 发酵碳源对椰果凝胶拉伸性能的影响
在拉伸实验中,从果糖培养基中获得的椰果凝胶具有最大的杨氏模量(6.49 MPa)(表3),而从乙醇培养基中获得的椰果凝胶具有最弱的拉伸强度(1.62 MPa),这与振荡剪切得到的储能模量的结果一致(图7)。Lanasa[35]等人的研究表明孔径较小的椰果凝胶具有更大的极限拉伸应力,因此从果糖培养基中产生的孔径较小的椰果凝胶(图4b)表现出最大的断裂应力(0.80 MPa)。Zhong[16]等人的研究发现,比起使用葡萄糖为碳源,菌株CGMCC 2955在以甘油为碳源的培养基中产生的小孔隙率椰果凝胶具有更大的拉伸强度(83.50 MPa),这与我们的结果类似。另外,孔径较小的网络结构增加了纤维素层间的各向异性结构[21,36],延缓拉伸过程中纤维条带的矫直和断裂,从而提高最大拉伸应变值(19.79%)(表3)。
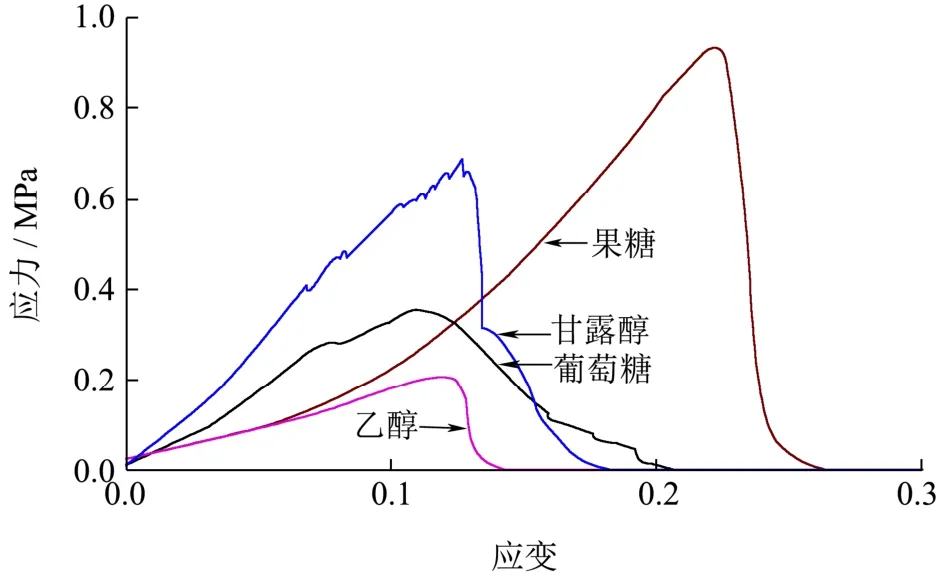
图7 四种不同碳源产生的椰果凝胶在拉伸测试过程中的代表性应力/应变曲线Fig.7 Representative stress/strain curves of coconut gels produced from four different carbon sources during tensile testing

表3 四种不同碳源产生的椰果凝胶的拉伸测试数据Table 3 Tensile test data of coconut gels produced from four different carbon sources
3 结论
椰果生产中,木糖驹形氏杆菌菌株的选择和合适的碳源对于提高其产量和质地都十分重要。当葡萄糖碳源浓度为20 g/L时,菌株ATCC 53582具有最高的椰果产量(6.07 g/L)。另外,由果糖培养基产生的具有小孔径的椰果凝胶具有更高的凝胶强度、黏弹性和拉伸性质,这可运用于生产质地较硬、咀嚼性更强的椰果凝胶;而由乙醇培养基产生的具有大孔径的椰果凝胶具有更低的强度、黏弹性和拉伸性质,这可运用于生产质地较软、方便吸食的椰果果冻。

