不同方法提取的羊栖菜多糖理化性质及益生活性
孔秋红,张瑞芬,曾新安,张名位,马永轩,3,游丽君
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(3.广州力衡临床营养品有限公司,广东广州 510610)
羊栖菜(Sargassum fusiforme)是我国东南沿海地区广泛分布的褐藻之一,在我国作为经济藻类种植已有多年历史。研究报道,羊栖菜具有丰富的营养价值,主要含有多糖、蛋白质、维生素和一些微量矿物质成分,对人体健康可产生多种有益的影响[1]。其中,多糖一直是藻类活性成分研究热点之一,研究发现羊栖菜多糖具有抗氧化[1]、抗肿瘤[2]、抗炎[3]、降血糖、降血脂[4]、抗光老化[5]等作用。但是由于多糖是一类大分子聚合物,近年来许多研究表明其被摄入人和动物体内后主要通过调节肠道菌群,发挥 “ 益生元 ” 作用促进机体健康[6]。益生元是一类在肠道中能够选择性地刺激肠道益生菌生长的活性物质[7]。而乳杆菌是能够对肠道健康产生有益影响的一类益生菌,它们在肠道内可以利用未消化的大分子碳水化合物产生酸性代谢产物(如短链脂肪酸),对肠道健康具有重要的作用[8]。体内、外实验研究发现,褐藻多糖能够调节肠道中的微生物群并且增加有益菌群的生长,其作为益生元补充剂具有巨大的潜力[9]:饲料中添加褐藻多糖喂食大鼠一周能够提高老鼠的肠道健康,增加肠道内有益菌如产丁酸菌Faecalibacterium prausnitzii的丰度[10];海带多糖膳食补充也对大鼠的肠道内有益菌群具有很好的益生作用,并且可以减少大鼠的肥胖现象[11]。目前关于羊栖菜多糖的益生活性尚未见报道。
不同的提取方法得到的多糖具有不同的理化性质和结构特征。大量研究发现,多糖的益生活性与其单糖组成和分子量等性质密切相关[12-16]。因此,不同的提取工艺对多糖的理化性质与益生活性之间关系的影响不容忽视。传统的植物多糖提取方法主要是热水提取法,该方法简便易行但提取效率较低。在该法的基础上增加物理场(如超声、脉冲电场和微波等)或酶法辅助提取可大大提高多糖的提取率,提高原料利用率。超声辅助水提法可以通过超声气泡的破裂产生空化效应,释放出大量的能量,从而提高多糖提取率[17];脉冲电场辅助水提法是一种非热处理新技术,可产生脉冲波使细胞瞬间破壁,造成细胞膜的电位发生混乱,促进胞内物质溶出,这种方法具有能耗低、作用均匀、处理时间短和较大程度上保留产品活性等优点[18];生物酶处理能够以较温和的方式促进植物细胞的破裂,使细胞内容物更加充分地溶出,从而提高目标活性物质的提取效率,同时具有生物相容性好、催化效率高、无毒、环境友好等优点[19]。已有研究报道,超声和酶处理能提高一些多糖的益生活性[12,13]。而目前关于不同提取工艺对羊栖菜多糖益生活性的影响还未见报道。
综上所述,本实验以热水提取、纤维素酶辅助水提取、超声辅助水提取和脉冲电场辅助水提取四种方法制备羊栖菜多糖,比较其产物的得率、分子量、单糖组成、流变性质及对乳杆菌的促增殖活性,为羊栖菜多糖的高效制备及潜在的益生活性研究开发提供参考依据。
1 材料与方法
1.1 材料
材料与试剂:羊栖菜,购自浙江温州;乳杆菌粉,购自北京川秀科技有限公司;C109262纤维素酶(10,000 U/g),购自上海阿拉丁生化科技有限公司;磷酸氢二钾、磷酸二氢钾,均购自国药集团化学试剂有限公司;无水乙醇、浓硫酸、柠檬酸三铵、七水硫酸镁、硫酸锰、乙酸钠,均购自天津市大茂化学试剂厂;苯酚,购自广州市化学试剂厂;酵母提取物、蛋白胨、牛肉浸粉,均购自麦克林(上海)公司;吐温80,购自广州东巨公司;单糖标品(岩藻糖、半乳糖、葡萄糖、木糖、甘露糖),购自美国Sigma公司。
主要仪器:FW135粉碎机,天津泰斯特仪器有限公司;XDW-661振动式细胞级超微粉碎机,济南达微机械有限公司;SY-E-500脉冲电场提取设备,华南理工大学食品科学与工程学院自行研制;JY NⅡ 细胞超声破碎仪,宁波新芝有限公司;Hei-VAP Value Digital旋转蒸发仪,德国Heidoph公司;DU 730型核酸蛋白分析仪,美国Beckman Coulter公司;LC-20A高效凝胶渗透色谱仪,日本岛津株式会社;ICS5000离子色谱仪,美国Dionex公司;AR-1500 ex流变仪,美国TA公司;Alpha 1-2 LD Plus冷冻干燥机,德国Christ公司。
1.2 方法
1.2.1 羊栖菜预处理
将购自江浙沿海的羊栖菜洗净晒干,用普通粉碎机将其进行粉碎并过40目筛,再利用超微粉碎机继续处理5 min,最后以1:4(W/V)的料液比加入95%乙醇回流3 h进行脱脂脱色,弃去乙醇,再重复以上步骤加入乙醇继续回流1 h两次,弃去乙醇,50 ℃低温烘干得到羊栖菜超微粉,置于常温干燥避光的环境中保存备用。
1.2.2 羊栖菜多糖的提取
1.2.2.1 热水提取
参考季德胜[5]的方法,略做修改。称取一定量经过预处理得到的羊栖菜超微粉,以1:50(W/V)的料液比加入去离子水,100 ℃下提取4 h,提取完成后将溶液以8000 r/min的转速离心15 min,收集上清液,真空旋蒸浓缩至原体积的1/4,加入无水乙醇至浓度为80%置于4 ℃冰箱醇沉12 h,8000 r/min离心10 min,收集沉淀,待乙醇挥发,加水复溶,真空冻干得热水提羊栖菜多糖H-SFP。
1.2.2.2 纤维素酶辅助热水提取
称取羊栖菜超微粉,先以料液比1:30(W/V)的比例加入去离子水,再往羊栖菜水溶液中加入最终溶液质量0.1%的纤维素酶,搅拌均匀,将其置于50 ℃水浴下反应4 h。灭酶后再加入去离子水使终料液比达到1:50(W/V),将其置于100 ℃水浴提取4 h。后续步骤如1.2.2.1,得到酶助辅水提羊栖菜多糖E-SFP。
1.2.2.3 超声辅助热水提取
称取羊栖菜超微粉,以1:50(W/V)的料液比加入去离子水,置于细胞超声破碎仪中,400 W功率下超声40 min,反应完成后再在100 ℃的水浴条件下提取4 h。后续步骤如1.2.2.1,得到超声辅助水提羊栖菜多糖U-SFP。
1.2.2.4 脉冲电场辅助热水提取
称取羊栖菜超微粉,以1:50(W/V)的料液比加入去离子水,倒入反应槽中,设置电场强度为3.6 kV/cm,脉冲次数50次。反应完成后在100 ℃的水浴条件下提取4 h。后续步骤如1.2.2.1,得到脉冲电场辅助水提羊栖菜多糖P-SFP。
1.2.3 多糖得率的测定
以苯酚-硫酸法[20]测定总糖含量。
多糖的得率按以下公式计算:
多糖得率/%=总糖含量×冻干产物质量/羊栖菜原料质量×100%
1.2.4 多糖分子量的测定
通过高效凝胶渗透色谱仪测定多糖的平均分子量,多糖的处理方法如下:称取2 mg多糖溶于1 mL 0.02 MK2HPO4缓冲液,过0.22 μm无菌水相滤膜,备用。色谱条件参数设置为:色谱柱TSK G-5000PWXL(7.8×300 mm)和TSK G-3000PWXL(7.8×300 mm),柱温35 ℃,检测器为Waters 2414示差折光检测器,流动相0.02 M K2HPO4缓冲液,流速0.6 mL/min。以不同分子量(5.2、11.6、14.8、23.8、48.6、273、410、668 ku)的葡聚糖绘制标准曲线。多糖样品的分子量根据其洗脱出峰时间对照标准曲线计算得到。
1.2.5 单糖组成的测定
产物的单糖组成通过离子色谱方法测定,多糖预处理方法参照Chen等[21]的方法。色谱条件为:色谱柱CarboPac PA20色谱柱,柱温30 ℃,检测器为IC系统,流动相为H2O/NaOH,流速0.5 mL/min,进样量10 μL。以不同浓度的单糖溶液(葡萄糖、岩藻糖、半乳糖、木糖、阿拉伯糖、甘露糖)绘制标准曲线。样品的单糖组成根据对应峰面积对照单糖标准曲线计算确定摩尔百分比。
1.2.6 流变特性
将不同提取方法得到的羊栖菜多糖样品配制成浓度为30 mg/mL的溶液,充分溶解,于25 ℃室温静置12 h,利用AR-1500 ex流变仪测定其表观黏度(直径为40 mm的铝板,Gap值为0.500 mm),测试温度为25.0 ℃,剪切速率0.01~200 s-1,采用TA Orchestrator-7采集数据。
1.2.7 多糖对乳杆菌促增殖作用研究
1.2.7.1 菌的准备
将保存于-40 ℃的混合乳杆菌粉(内含保加利亚乳杆菌、嗜酸乳杆菌、嗜热链球菌、植物乳杆菌和干酪乳杆菌)稀释于适量0.9%无菌生理盐水中制成菌悬液,取200 μL菌悬液接种到MRS液体培养基中,置于37 ℃恒温培养箱中培养24 h进行活化。取活化好的菌液继续传代培养。将传代培养至稳定期的菌液3500 r/min离心10 min,弃去上清液,用0.9%无菌生理盐水洗涤沉淀两次,最后加入10 mL生理盐水重悬菌体制成菌悬液备用。
1.2.7.2 MRS培养基的制备
无碳源MRS培养基:蛋白胨10.0 g/L、牛肉浸粉10.0 g/L、酵母提取物5.0 g/L、柠檬酸三铵2.0 g/L、K2HPO42.0 g/L、无水乙酸钠5.0 g/L、MgSO4·7H2O 0.58 g/L、MnSO40.05 g/L和吐温801.0 g/L。
为评价不同提取工艺得到的羊栖菜多糖对乳杆菌的益生活性,分别按10.0 g/L(1.0%W/V)的量称取H-SFP、E-SFP、U-SFP、P-SFP样品作为唯一碳源加入到上述培养基中,每个样品做3次平行。此外,以在培养基中加入等量低聚半乳糖GOS作为阳性对照,以不加糖的基础培养基为空白对照。调节MRS培养基最终pH 6.2±0.2。随后将培养基置于高压灭菌锅中,121 ℃灭菌20 min。
1.2.7.3 促增殖作用的测定
按照4%(V/V)的接种量将1.2.7.1制备好的菌悬液接种至以不同多糖样品为碳源的培养基中,于37 ℃厌氧培养。在发酵24 h、48 h时分别取样离心(5000 r/min,10 min),加入适量生理盐水把培养基洗掉,最后用等量生理盐水重悬,以生理盐水为空白,在600 nm处测各组OD值,每个样品重复测定3次。采用比浊度法,以OD600值(即溶液中菌的总菌数)为评价指标比较各多糖对益生菌的增殖作用。
1.2.8 数据处理
采用SPSS Statistics 25软件对数据进行一维方差分析(one-way ANOVA),采用LSD检验进行两两比较。
2 结果与讨论
2.1 羊栖菜多糖的得率
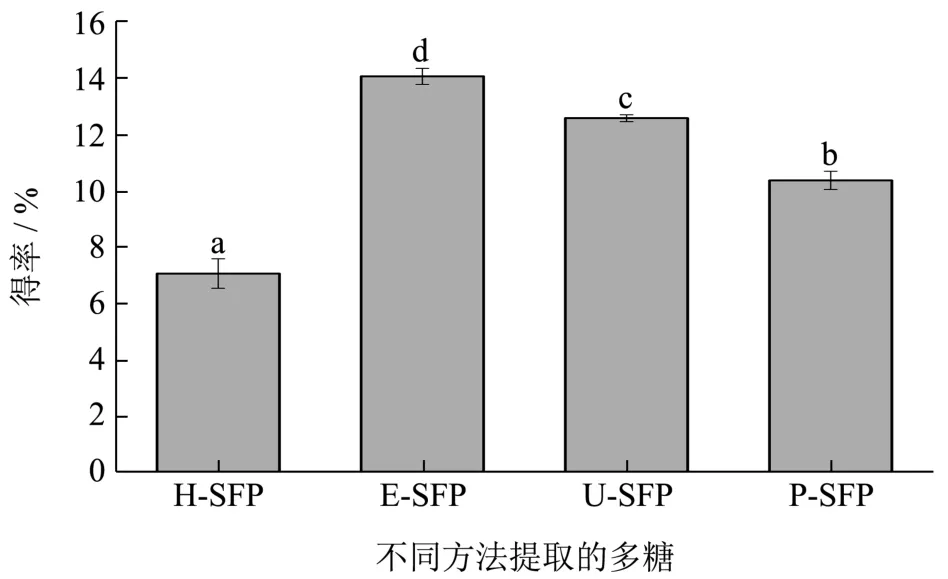
图1 不同方法提取羊栖菜多糖的得率比较Fig.1 The yields of SFPs extracted by different methods
由于不同提取方法对细胞的破壁情况不同,导致多糖的溶出量也不同,因此多糖的得率也各有差异。如图1所示,四种提取方法中,纤维素酶辅助提取所得的E-SFP得率最高(14.02%),其次为超声辅助提取U-SFP(12.57%),再者为脉冲辅助提取P-SFP(10.38%),三种辅助提取的方法较之传统的热水提取方法都能显著地提高羊栖菜多糖的得率(p<0.05),其中纤维素酶辅助提取所得的E-SFP得率为单纯热水提取H-SFP得率的2倍左右。与传统热水提取方法相比,用纤维素酶辅助提取方法能较大程度地提高植物多糖的得率,这可能这是由于纤维素酶能特异地对细胞壁产生破壁作用,还能对一些难溶或不溶性多糖进行水解,促进更多细胞壁多糖和胞内多糖溶出,大大提高了羊栖菜多糖的得率。
根据现有文献报道,周峙苗[22]采用纤维素酶复合果胶酶(配方比为2:1,添加量12%)再结合热水浸提两次的方法得到羊栖菜多糖,得率达到14.88%,为热水浸提多糖得率(6.85%)的2.17倍。Chen等[23]用不同方法提取竹笋多糖,传统热水提取所得多糖得率为7.2%,采用酶辅助提取所得多糖得率提高至8.3%,并表现出更好的益生活性。赵晨淏等[24]采用水提法、酶提法、酸提法、超声法、碱提法5种方法提取龙眼多糖,结果显示酶提法得到多糖的得率最高,为6.78%,是最低的碱提法所得多糖得率(1.84%)的3.68倍,并且酶提龙眼多糖表现出较强的抗氧化活性。因此,利用生物酶法辅助提取多糖不仅可以提高多糖的得率,而且可以较好地提高其生物活性。
2.2 分子量
如表1所示,H-SFP、E-SFP、U-SFP、P-SFP的平均分子量分别为201.32、244.30、218.08、228.52 ku,4个多糖的平均分子量差别不大,可能本实验采取的辅助提取的手段主要是破坏细胞壁,促进了多糖特别是一些大分子多糖的溶出,并未对羊栖菜多糖的特殊结构造成破坏。文献也曾报道,Chi等[25]用纤维素酶辅助提取浒苔多糖,发现EAP的平均分子量比传统热水提取多糖HAP高361.5 ku。Hmelkov等[26]采用超声提取的岩藻多糖F2的平均分子量跟传统方法提取的多糖F1相比也并未下降,与本文研究结果相似。
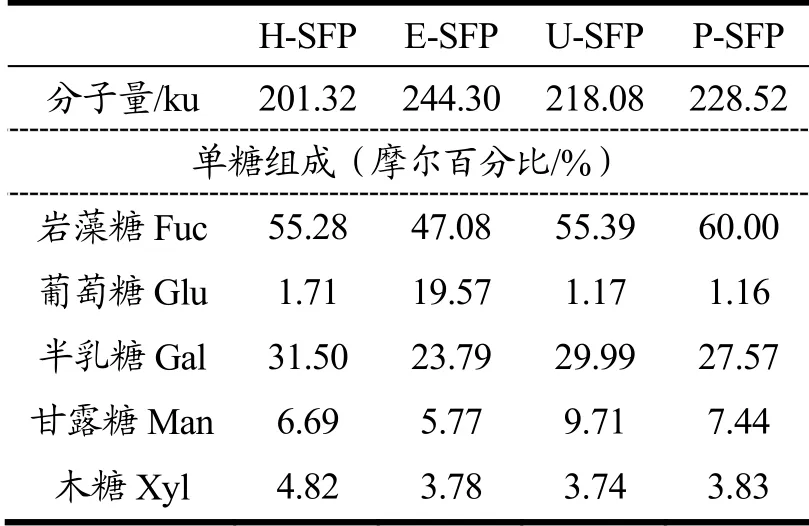
表1 不同方法提取的羊栖菜多糖分子量和单糖组成摩尔百分比Table 1 The molecular weights and monosaccharide compositions of SFPs extracted by different processes
2.3 单糖组成
不同方法提取的羊栖菜多糖的单糖组成结果如表1所示,羊栖菜多糖主要是由岩藻糖、葡萄糖、半乳糖、甘露糖和木糖组成,其中,H-SFP的摩尔百分比55.28:1.71:31.59:6.69:4.82;E-SFP 为 47.08:19.57:23.79:5.77:3.78;U-SFP为55.39:1.17:29.99:9.71:3.74;P-SFP为60.00:1.16:27.57:7.44:3.83。结果表明不同提取方法所得羊栖菜多糖都主要由岩藻糖和半乳糖组成,与季德胜[5]、胡晨曦[1]、杨斯淇[4]等研究一致。有大量文献表明,岩藻糖作为羊栖菜多糖的一个主要单糖组成成分,与羊栖菜多糖的活性密切相关[27]。另外,E-SFP与其他提取方法所得多糖相比,其葡萄糖组成含量高达19.57%,这可能是因为纤维素酶能促进细胞壁纤维溶出,而细胞壁纤维中的葡萄糖组成较多。
2.4 流变特性
不同提取方法所得羊栖菜多糖的流变特性如图2所示,在0.01~200 s-1的剪切速率下,随着剪切速率的增加,4个多糖的表观粘度都呈下降趋势,表现为典型的假塑性特征,最终趋于平缓,表明这些多糖属于非牛顿流体。在初始范围内的同一剪切速率下,四种多糖的粘度大小跟平均分子量大小排序一致,如在0.11 s-1剪切速率下,粘度由大到小依次为E-SFP>P-SFP>U-SFP>H-SFP,表明分子量和粘度呈现正相关关系。另外从变化曲线也可看出,4个多糖的粘度变化差异不大,与分子量结果之间的差异保持一致,说明辅助手段并未对多糖的糖苷键和活性基团造成破坏。
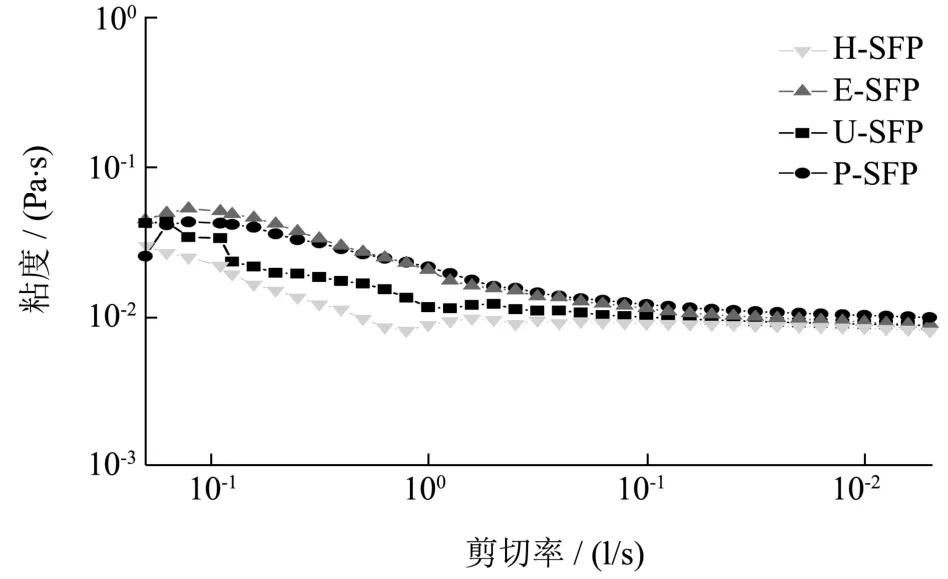
图2 不同方法提取的羊栖菜多糖的流变特性Fig.2 Rheological properties of SFPs extracted by different methods
2.5 对乳杆菌的促增殖作用
乳杆菌属Lactobacillus是人体内一类重要的益生菌,主要有嗜酸乳杆菌、发酵乳杆菌、干酪乳杆菌等,这些益生菌会利用肠道内未消化的大分子碳水化合物代谢产生对人体健康有益的产物,比如短链脂肪酸(主要是乙酸、丙酸和丁酸),这些酸性产物还会进一步降低肠道内的pH值,抑制肠道内有害菌的生长[28]。低聚半乳糖GOS是目前公认的益生元之一,因此选择它作为实验的阳性对照。
不同方法提取的羊栖菜多糖对乳杆菌体外增殖活性结果如图3所示,发酵24 h后,空白组Blank在600 nm波长下的吸光值为0.22,H-SFP组、E-SFP组、U-SFP组、P-SFP组的OD600分别为0.37、0.40、0.35和0.34;发酵48 h后,Blank组的OD600值为0.28,而四个多糖组H-SFP、E-SFP、U-SFP和P-SFP的值分别达到了0.46、0.50、0.46和0.46。不管是发酵24 h还是48 h,4个多糖对乳杆菌的促增殖作用均明显优于未加碳源的空白组Blank(p<0.05),其中促增殖效果最好的是E-SFP(与其它三个多糖组相比有显著性差异)。Ajanth等[29]采用生物酶辅助提取方法分别得到三种印度食用海藻的多糖,体外发酵实验研究发现这三种多糖都能有效地促进植物乳杆菌的增殖活性并能增加短链脂肪酸的含量。分析上述结果,表明四个方法所得羊栖菜多糖都能够促进乳杆菌的生长,具有潜在的益生活性。
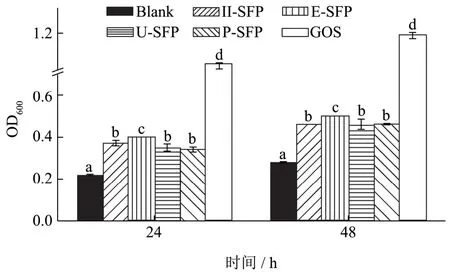
图3 不同方法提取的羊栖菜多糖对乳杆菌的促增殖作用Fig.3 Proliferation effects on Lactobacillusof SFPs extracted by different methods
3 结论
在本研究中,采用了4种工艺(传统热水提取法、纤维素酶辅助水提法、超声辅助水提法、脉冲电场辅助水提法)制备羊栖菜多糖,研究了它们的得率、分子量、单糖组成、流变特性和对乳杆菌的促增殖作用。结果表明,纤维素酶辅助水提法制备的羊栖菜多糖E-SFP得率最高(14.02%),其次分别为U-SFP(12.57%)、P-SFP(10.38%)、H-SFP(7.07%);分子量测定结果表明4个多糖的平均分子量在200~245 ku之间;离子色谱结果显示4个多糖主要由岩藻糖、半乳糖、葡萄糖、甘露糖和木糖组成,其中岩藻糖和半乳糖是主要成分;4个多糖都是典型的非牛顿流体,且表观粘度的大小与分子量呈现正相关;采用体外发酵法研究羊栖菜多糖对乳杆菌的促增殖作用,结果发现与空白组比较,4个多糖均能在一定程度上促进乳杆菌的增殖,其中E-SFP的促增殖作用显著高于其它三个多糖(p<0.05)。综上所述,采用纤维素酶辅助提取方法能有效地提高羊栖菜多糖的得率,并能较好地促进乳杆菌的体外增殖活性。本研究结果为羊栖菜多糖的高效制备及其益生活性研究提供一定的参考依据,但是更多关于羊栖菜多糖的益生活性与结构之间的关系有待于进一步深入研究。

