白莲莲子皮多糖的理化性质及免疫调节活性
吴磊,吴静,胡居吾,熊伟,顾震,王慧宾
(江西省科学院应用化学研究所,江西南昌 330096)
自由基是一种具有高氧化活性的原子、分子或离子,在新陈代谢过程中可以携带一种或多种不对称的电子。生物体在代谢过程中产生的自由基是超氧阴离子自由基、羟基自由基及其衍生物。正常情况下,自由基调节细胞间信号和细胞生长,抑制病毒和细菌。然而,体内过多的自由基会损伤细胞、组织和器官,诱发许多疾病和生理疾病,如炎症、癌症、衰老和辐射损伤[1]。因此,有效清除体内多余的自由基是非常重要的。巨噬细胞通常是宿主防御系统的第一道防线,在先天性和适应性免疫反应中具有重要作用。巨噬细胞表面的受体,如Toll样受体(TLR)和补体受体3型(CR3)可能与多糖作用,刺激巨噬细胞释放一氧化氮(NO)和细胞因子杀死病原体[2]。因此,外源性抗氧化剂和巨噬细胞的免疫调节能力可能在抗病毒防御中具有的重要作用。
多糖不仅是高等植物、动物细胞膜和微生物细胞壁的重要组成部分。它还与生物的生理功能密切相关。多糖作为新一代的天然药物资源,具有抗氧化、抗肿瘤、抗炎、免疫调节等重要的生物学特性,其中,抗氧化和免疫调节活性被认为是多糖的两种主要的生物活性,特别是阿拉伯半乳聚糖、半乳甘露聚糖和来自高等植物的果胶多糖以及从蘑菇中提取的糖蛋白、海藻中提取的硫酸多糖都被证明具有很强的抗氧化和免疫调节活性。由于其安全性和无毒性,其中一些多糖已被成功地用作抗氧化剂和免疫调节剂[1,2]。因此,鉴于其在功能食品和医疗领域的潜在应用,人们越来越关注从天然产物中开发新型的植物源多糖。
莲(Nelumbo nucifera),睡莲科莲属多年生水生草本植物。莲属植物主要分为两种,包括中国莲(N.nuciferaGaertn)和美洲黄莲(N.nuciferaFemald)[3]。目前,我国拥有的荷花品种多达800个以上,主要分布于福建、浙江、湖北、湖南、江苏、安徽以及江西等地[4]。莲富含生物碱、黄酮、糖苷类、三萜类、多糖、多酚、挥发油等多种活性成分,具有抗氧化、消炎、抗菌、抗心律失常、降血糖、止泻、免疫调控等生理活性[5-9]。广昌白莲,中国国家地理标志产品。广昌县自古以来就被称为 “ 莲乡 ” ,历来被称为 “ 贡莲 ” ,为 “ 莲中珍品 ” ,一直畅销海内外。目前关于莲产品的开发与研制多停留在莲叶、莲子与莲心等植物器官制品上,而对于废弃下脚料莲子皮(约占整个莲子重量的15%)的研究较少,目前只是作为废弃物被随意丢置于路边或沟旁,腐烂霉变,或直接掩埋和焚烧。这不仅造成环境污染,还是对莲资源的极大浪费。国内外目前对莲子皮中化学成分及其药用作用的相关研究只有 “ 零星 ” 报道[10,11],一直未得到重视。本研究旨在通过热水提取法从白莲莲子皮中提取纯化多糖,并对纯化后的多糖进行表征,研究纯化多糖的抗氧化与免疫调节活性。旨在为合理开发利用白莲莲子皮资源提供依据。
1 材料与方法
1.1 材料与试剂
白莲莲子皮为广昌县白莲科学研究所提供,由徐刚研究员鉴定为白莲的莲子皮,样本编号为LP-201707,已存放在江西省科学院应用化学研究天然产物研究室的植物标本室。
所有标准品包括D-葡萄糖(Glc)、D-半乳糖(Gal)、L-鼠李糖(Rha)、L-阿拉伯糖(Ara)、D-木糖(Xyl)和D-甘露糖(Man)均购自中国食品药品检定研究院;1640培养基、胰蛋白酶和胎牛血清均购于Gibco公司;二甲基亚砜(DMSO)、脂多糖(LPS)、维生素C(Vc)、1,1-二苯基-2-三硝基苯肼(DPPH)以及2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)均购于Sigma公司;肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)ELISA试剂盒均购自南京建城生物工程研究所。除非另有规定,否则使用的所有其他试剂均为分析级试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
台式高速冷冻离心机:H1850型,厦门森态仪器仪表有限公司;冷冻干燥机FDU-1200:EYELA东京理化;分析天平:北京赛多利斯仪器系统有限公司;Tecan Infinite 200 PRO M Nano酶标仪:瑞士Tecan公司;KQ-500B超声波清洗器:昆山市超声仪器有限公司;CLM-170B-8-NF二氧化碳培养箱:新加坡ESCO公司;奥林巴斯倒置显微镜CKX53:日本Olympus公司;SYKAM S501 Series高效液相色谱仪;S-3250示差检测器;S-4115柱温箱;S-5300自动进样器;S-1130 四元泵;SYKAM 色谱工作站;气相色谱仪:GC-2010型,SHIMADZU公司;气相色谱检测器:FID;色谱柱:WondaCap5型毛细管柱(0.25 mm×30.0 m×0.25 μm);自动进样器:AOC-20S型,SHIMADZU公司;自动注射器:AOC-20i型,SHIMADZU公司;傅立叶红外光谱仪:FTIR-7600型,Lambad公司;压片机:DF-4型,天津港东科技发展股份有限公司。
1.3 试验方法
1.3.1 莲子皮粗多糖的提取
将阴干的莲子皮粉碎(500 g),用95%乙醇在80 ℃下热回流提取6 h以去除脂类、色素、单糖和小分子化合物。残渣在50 ℃的烘箱中干燥以获得脱脂的莲子皮粉。称取100 g脱脂粉末,以蒸馏水为提取溶剂,料液比为1:30(m/V),在90 ℃下的热回流提取三次,每次提取3.5 h。提取液经离心、过滤,使用真空旋转蒸发器浓缩至适当体积,加入4倍体积的无水乙醇混合,置于4 ℃冰箱过夜,在12000 r/min下离心10 min后,通过冷冻干燥获得白莲莲子皮粗多糖(LSSCP)。
1.3.2 莲子皮多糖的纯化
将所得莲子皮粗多糖(1 g)加热水10 mL溶解,然后加入sevage试剂(正丁醇:氯仿=1:4,V/V)充分震荡,在分液漏斗中静置,此步骤重复三次去除蛋白质,合并上层液体,用旋转蒸发仪浓缩去除有机溶剂残留。并加入粗多糖质量10%的活性炭,60 ℃、150 r/min搅拌3 h,抽滤,浓缩。浓缩液装入截留分子量为3000 u的透析袋中用自来水透析48 h,蒸馏水透析48 h以去除小分子化合物,将透析后的多糖溶液经冷冻干燥得到纯化莲子皮多糖(LSSP)[12]。
1.3.3 多糖结构表征
1.3.3.1 莲子皮多糖含量测定
莲子皮的多糖含量采用经典的苯酚硫酸法[13]进行测定,使用葡萄糖为标准品,以葡萄糖浓度为横坐标,吸光值为纵坐标绘制标准取线,计算多糖含量。
1.3.3.2 红外光谱分析
将2 mg的LSSP与KBr粉末150.0 mg(光谱级)混合,用压片机压制成厚度为1 mm透明薄片,用于FT-IR测量。使用傅里叶变换红外分光光度计测定了波长范围为400~4000 cm-1的FT-IR光谱,分辨率为2 cm-1观察谱峰情况。
1.3.3.3 分子量测定
采用SYKAM S501 Series高效液相色谱仪测定经过纯化后得到的莲子皮多糖分子量大小。使用五种葡聚糖标准分子量(Mw)(分别为Mw 10000 u、40000 u、70000 u、200000 u和2000000 u)进行校准。将标准品配制成2 mg/mL的标准溶液,通过0.22 μm微孔膜,在上述条件下进行高效液相色谱分析,色谱峰保留时间(T)为横坐标,葡萄糖标准品的平均分子量。该值(lgMw)为纵坐标,得到回归方程。色谱条件:TSKG5000色谱柱;流动相:0.1 M的磷酸盐缓冲液(pH 7.2);流速:0.5 mL/min,柱温30 ℃,进样量20 μL,运行时间30 min。将样品配成10 mg/mL的LSSP溶液,用0.22 μm的微孔滤膜过滤后进行HPLC分析。
1.3.3.4 单糖组分测定
根据先前报告的方法[13],将LSSP(10.0 mg)在100 ℃下,用2 mL的2 M三氟乙酸(TFA)在密封玻璃管中水解6 h。水解物在氮吹仪下至干。然后,将10.0 mg盐酸羟胺和0.5 mL吡啶加入密封玻璃管中,在90 ℃下反应30 min,孵育后,室温冷却,混合液中加入0.5 mL乙酸酐,旋涡彻底混合。将管密封并在水浴中孵育30 min,温度为90 ℃。反应液在氮吹仪下至干,加入2 mL氯仿溶解乙酰化衍生物。单糖标准品(单标与混标)与内标按照多糖的乙酰化步骤进行操作。采用气相色谱法测定LSSP中的单糖组成,在以下条件下进行气相色谱操作:N2:30.0 mL/min;进样温度为240 ℃,柱色谱程序为:初始温度:140 ℃,保留3 min;以10 ℃/min时升至240 ℃,保留15 min;运行时间:28 min,检测器温度:260 ℃;进样体积为1 μL。
1.3.4 多糖活性实验
1.3.4.1 清除DPPH自由基能力的测定
多糖样品的DPPH自由基清除活性的测定方法[14]根据之前文献报道稍作修改。将3 mL的新鲜配置浓度为200 μmol/L的DPPH溶液作为自由基的母液分别加到不同浓度的样品溶液中,样品溶液的浓度分别为0.025、0.05、0.1、0.2、0.4 mg/mL,所需样品的体积为1 mL。溶液快速摇动混合,并在25 ℃下反应25 min。将Vc用作阳性对照,吸取反应液至96孔板中,在517 nm用酶标仪测定吸光度。DPPH自由基清除率由下式计算
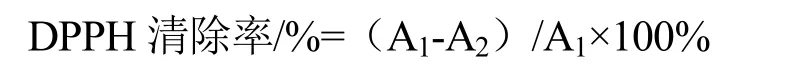
式中,A1:对照品溶液(无样品)的吸光度;A2:样品溶液的吸光度。
1.3.4.2 ·OH自由基清除能力的测定
根据献[14]方法测定羟自由基清除活性。将1 mL不同浓度的多糖溶液(0.025、0.05、0.1、0.2、0.4 mg/mL)、1 mL硫酸亚铁溶液(6 mmol/L)和1 mL水杨酸-乙醇溶液(6 mmol/L)混合。用1 mL的0.1%过氧化氢摇匀,然后在37 ℃下黑暗反应30 min。取反应液200 μL转移至96孔板中,以Vc为阳性对照。用酶标仪在510 nm下测定吸光度A。根据下列公式计算LSSP及Vc的·OH自由基清除率:
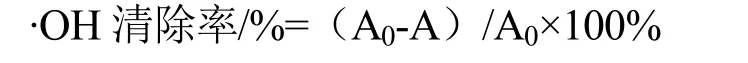
式中,A0:蒸馏水代替样品溶液作为空白对照的吸光度;A:样品吸光度。
乱象归乱象,流量归流量。人们应该清醒地意识到,当前充斥于自媒体领域的“失范”现象,是媒体转型期的特殊现实。
1.3.4.3 Fe3+还原能力的测定
按文献方法测定多糖的铁还原抗氧化能力[15]。将0.8 mL样品(0.025、0.05、0.1、0.2、0.4 mg/mL)与0.4 mL磷酸盐缓冲液(pH=6.6,0.2 mol/L)和0.4 mL铁氰化钾溶液(1%,W/V)混合,并在50 ℃下反应20 min,然后再将0.4 mL三氯乙酸溶液(10%,W/V)加入。静置10 min,加入1.6 mL蒸馏水和0.4 mL氯化铁溶液(0.1%,W/V),室温下静置10 min,然后在700 nm处测定样品的吸光度。以Vc为阳性对照。
1.3.4.4 细胞培养
RAW 264.7细胞系是一种小鼠巨噬细胞细胞系,购自美国典型培养物保藏中心(ATCC),用RPMI 1640培养基于37 ℃、5% CO2培养箱中进行培养,培养基中需添加10%胎牛血清(在56 ℃水浴中热灭活30 min)、100 U/mL青霉素和100 μg/mL链霉素。培养基每2~3 d更换一次。当融合率达80%,传代培养。
1.3.4.5 细胞活性检测-MTT法
LSSP对RAW 264.7细胞活力的影响通过常规MTT法[12]进行测量,对数生长期细胞以1×106个细胞/孔接种于96孔板中。置于CO2培养箱培养18 h后,向悬浮液中加入不同浓度的LSSP,孵育24 h,吸取上清液,加入100 μL MTT溶液(0.5 mg/mL),继续培养4 h,每孔加入100 μL MTT停止液。继续培养16~20 h后,在550 nm处用酶标仪测量吸光度,实验重复三次。细胞存活率按照以下公式进行计算:
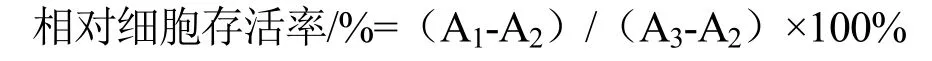
式中,A1:实验组孔吸光值;A2:空白组孔吸光值;A3:对照组孔吸光值。
1.3.4.6 对细胞因子分泌量的影响
将RAW264.7巨噬细胞(1×105个/mL)接种于48孔板中,置于CO2培养箱中培养24 h,洗旧培养基,用不同浓度(12.5、25、50、100、200或400 μg/mL)的LSSP和1 μg/mL LPS(阳性对照)在37 ℃下继续培养24 h,NO的分泌量采用Griess法进行检测,具体以亚硝酸钠为标品,配置不同浓度的亚硝酸溶液,加入Griess试剂反应测其吸光度,以浓度为横坐标,吸光度为纵坐标绘制标准曲线,ELISA试剂盒测定TNF-α、IL-1β和IL-6的分泌量。
试验数据处理和作图软件采用Excel 2013及Sigmaplot 10.0软件,数据以平均值±标准差(SD)表示。两组间的显著性采用t检验进行分析,多组比较采用单因素方差分析(ANOVA)进行比较。p值小于0.05被认为是显著的。
2 结果与分析
2.1 白莲莲子皮多糖的提取与纯化
按照方法步骤1.3.1与1.3.2所得白莲莲子皮粗多糖和纯化多糖的质量分别为7.92 g和0.47 g,多糖得率的计算方式为与投药量的比值,经计算粗多糖与纯化多糖的得率分别为9.45%和3.72%,粗多糖与纯化多糖含量经苯酚-硫酸法测得梯度葡萄糖的吸光值,得到标准曲线。回归方程:Y=0.0031X+0.0182,R²=0.9993,其中Y为吸光度,X为浓度。测得粗多糖与纯化多糖含量分别为35.78%和86.79%。这可能由于在多糖纯化过程中,选择了单一的纯化方式,所得纯化的多糖中可能还含有大分子物质和微粒如水溶性高聚物、多肽、核酸以及残留色素等杂质成分。徐虹等[16]利用酶解研究莲子红皮多糖的得率可达8.42%,所得多糖纯度为83.19%;李杨等[17]超声波辅助提取莲子皮多糖,多糖提取率为17.37%,多糖质量分数为63.75%。比本研究白莲莲子皮粗多糖的得率和纯度都要高,这可能是由于莲的种类、提取方式的不同引起的。
2.2 红外光谱分析
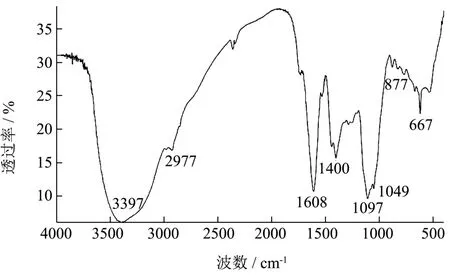
图1 LSSP的红外光谱图Fig.1 IR spectra of LSSP
红外吸收是由分子偶极矩或电荷分布的振动而引起。是分析多糖结构的有效手段,根据多糖的特征吸收峰可推断出其组分一些可能的结构特征。红外光谱分析了LSSP的主要官能团和化学键,结果如图1所示,3397 cm-1处的特征峰是由于O-H伸缩振动引起的;峰值出现在3000~2800 cm-1处是由于饱和的甲基或亚甲基的C-H伸缩振动引起的[18],2977 cm-1是LSSP糖环上的C-H伸缩振动。信号在1608 cm-1处的特征吸收峰归因于结合水引起的[19];在1400 cm-1处的吸收峰归因于C=C的拉伸振动和C-H的变形振动[20];吸收波长在1049 cm-1处的吸收峰是C-O-H中O-H的变角振动所引起的,在多糖红外光谱中,可能是LSSP中C-4位C-O的振动[21]。在877 cm-1的观察带表明,LSSP可能含有α构型糖苷键[22]。LSSP的红外吸收光谱显示,与其它多糖相比,在667 cm-1附近有一个吸收峰,这可能是由于糖链上的芳香峰和芳香族C-H弯曲振动的吸收峰所致[23]。红外光谱表明LSSP多糖在400~4000 cm-1范围内有明显的多糖特征吸收峰。
2.3 单糖组成及其分子质量分析
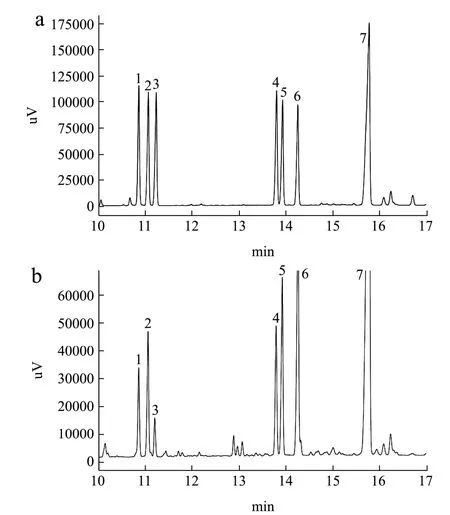
图2 标准单糖气相色谱图(a)与样品气相色谱图(b)Fig.2 GC chromatogram of complex monosaccharide derivative
通过对6种标准单糖和莲子皮多糖样品先后进行气相色谱分析,由图2a得知,6种单糖标准品在此色谱下分离完全。莲子皮多糖单糖组成由图2b所示,13.35 min处的单糖由于缺少相应单糖标品,暂时未分析出来。莲子皮多糖主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖六种单糖组成,六种单糖的摩尔比为2.23:3.47:1.00:3.08:4.27:7.00,其中半乳糖含量最大,为33.25%,葡萄糖和阿拉伯糖次之。刘恩超、孙丰婷等[24,25]研究发现莲藕渣多糖主要由半乳糖和阿拉伯糖组成,其中半乳糖的含量最高,为25.98%,邓添华等[26]研究表明莲子多糖中半乳糖的含量最高,都与本研究的结果一致,推测半乳糖是一种存在于莲多糖中的含量最高的单糖。
多糖的分子量具有相对性,代表相似链长的平均分布,通常用统计平均值来表示所测定的多糖分子量大小[27]。采用高效液相色谱法测定不同标准品分子重量。以标准品的保留时间(T)为横坐标,标准品的分子量平均值取对数(lgMw)为纵坐标,根据标准曲线LgMw=9.6167-0.2897T,(R2=0.9967)(其中Mw是分子量,T表示保留时间)计算LSSP相对分子量。LSSP有两组不同的分子量分布,如图3所示,出峰时间分别为23.52 min和24.15 min,平均分子量分别为6.35×105u和4.18×105u,属于非均一多糖。Tian等[28]利用超声辅助提取莲子多糖,并利用柱色谱纯化后检测分总量为4484 u,小于本研究的莲子皮多糖的平均分子量,这可能由于原料、提取纯化方式的不同造成的。
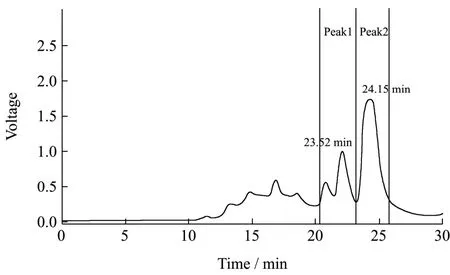
图3 LSSP的分子量分布Fig.3 Molecular weight distribution chromatograms of LSSP
2.4 白莲莲子皮多糖的体外抗氧化活性
2.4.1 对DPPH的清除效果
DPPH是一种非常稳定的以氮为中心的自由基,如能消除,说明供试品具有降低过氧化自由基和中断脂质过氧化链式反应的作用,是基于抗氧化剂的供氢能力。它广泛用于测定各种抗氧化剂样品的抗氧化能力,其方法简单、快速、灵敏。DPPH在乙醇溶液中呈紫色。DPPH的颜色与DPPH自由基含量呈正相关。DPPH在紫外517 nm处的有最大吸收峰。通过比较加样前后吸光度的变化来计算DPPH自由基的清除率[29]。如图4a所示,莲子皮多糖的DPPH自由基清除率随浓度从0.025~0.4 mg/mL呈剂量依赖性增加,但均小于Vc。在0.1 mg/mL浓度下,Vc对DPPH自由基的清除作用迅速提高,达到91.34%,之后随着浓度的增加,其清除率逐渐趋于平缓。而莲子皮多糖对DPPH自由基的清除作用在浓度为0.025~0.2 mg/mL时增强较快,后趋于平缓,在0.2 mg/mL和0.4 mg/mL时,其清除率分别为57.76%和59.75%。薛淑静[30]研究发现莲子红皮多糖对DPPH有清除作用,多糖浓度在0~120 μg/mL时清除作用随浓度的增大呈增长趋势,在120 μg/mL时最大,达到41.79%,之后清除率呈下降趋势,与本研究结果基本一致。
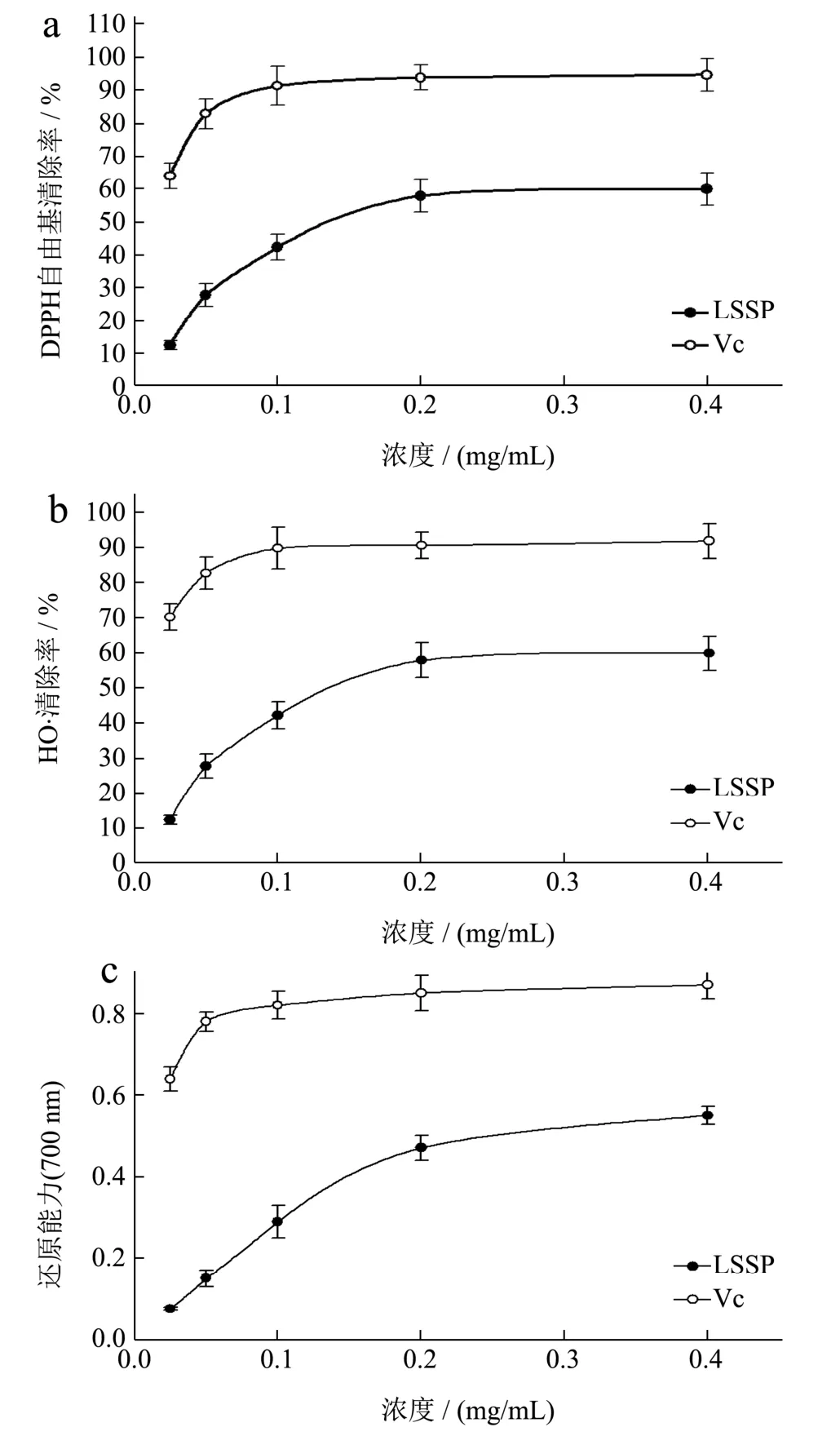
图4 LSSP对DPPH(a)、·OH(b)自由基清除能力以及还原能力(c)Fig.4 The scavenging effect on DPPH (a), hydroxyl (b) radicals and reducing power (c) ability of polysaccharide
2.4.2 对·OH自由基清除能力
羟基自由基(·OH)是一种高度氧化的自由基。它能与生物体内的任何物质发生反应,特别是脱氧核糖核酸(DNA)中的嘌呤和嘧啶,羟基自由基具有强大的破坏力,会导致细胞死亡或突变[31]。这个实验的原理是羟基自由基由Fenton反应产生,水杨酸反应与·OH形成有色物质,在510 nm下有紫外吸收。当添加样品时,有色化合物的产生会减少,峰值相应减小,以此来计算样品的清除能力。如图4b所示,Vc具有良好的清除羟基自由基能力,当Vc浓度为0.1 mg/mL,清除率达89.77%,但是,随着Vc浓度的增加,其清除率基本趋于平缓趋势。从图中可以看出莲子皮多糖的清除率随浓度的增加而增加,但是整体清除率比Vc低。在给药浓度范围内,莲子皮多糖的清除率在浓度为0.4 mg/mL时达到最大,其清除率为59.75%。薛淑静[30]研究发现莲子红皮多糖对·OH有一定的清除作用。随着多糖浓度的不断增加,对·OH的清除作用呈现增强的趋势,多糖浓度6.0 mg/mL时,趋势渐缓;多糖浓度10.0 mg/mL时清除率最高,达到96.29%,与本研究趋势基本一致,所不同的是本研究中并未研究浓度更大的莲子皮多糖对·OH自由基清除能力。
2.4.3 还原力的测定
多糖的还原能力与抗氧化活性有关。因此,多糖还原能力的测定可以间接比较多糖的抗氧化能力。本实验的原理是还原剂将铁氰化钾中的Fe3+还原成Fe2+,与三氯化铁反应生成普鲁士蓝。产物在700 nm处有最大吸收值。吸光值越高,还原剂的还原能力越强,抗氧化活性越好[32]。样品的还原能力结果如图4C所示。可见Vc的还原能力最强。其增长趋势与清除DPPH自由基的结果基本一致,随着样品浓度的增加,先迅速增长,然后趋于平缓Vc。而样品的还原能力虽然随着给药浓度的增加而有所增强,但是增加幅度偏小,莲子皮多糖还原能力在给药浓度为0.4 mg/mL时达到最大,其吸光值为0.55。
2.5 LSSP对细胞存活率的影响
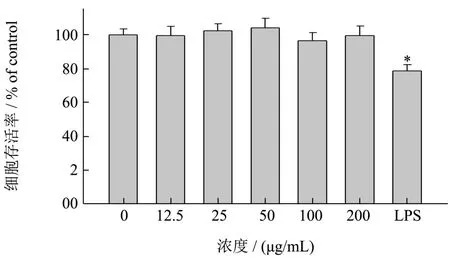
图5 LSSP对RAW 264.7细胞存活率的影响Fig.5 Effect of LSSP on the viability of RAW264.7 cells(*p<0.05)
在研究LSSP的免疫调节活性之前,采用MTT法测定多糖对RAW264.7巨噬细胞的增殖作用的影响。如图5所示,在用LSSP(200、100、50、25、12.5 μg/mL)时,细胞存活率分别为99.67%、96.53%、104.12%、102.45%、99.65%,说明LSSP(200 μg/mL以下)对于细胞是安全的,在安全的浓度范围内可以进行下面的实验研究。
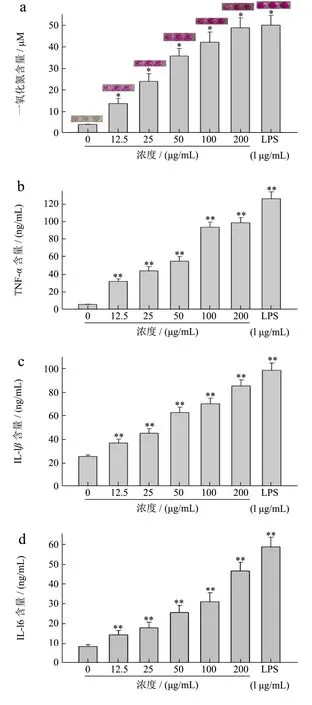
图6 LSSP对NO、细胞因子(TNF-α、IL-6和IL-1β)的影响Fig.6 Effects of LSSP treatment on the secretion of (A) NO,(B–D) cytokine (TNF-α, IL-1β and IL-6) in RAW 264.7 cells.
2.6 LSSP对RAW264.7细胞NO、TNF-α、IL-6和IL-1β分泌的影响
巨噬细胞积极参与宿主对外源性病原体和微生物的免疫防御,能够增强促炎因子和趋化因子的产生。多糖可通过调节巨噬细胞免疫功能发挥多种有益的药理作用。NO是参与巨噬细胞的抗菌活性和抗肿瘤免疫反应的重要物质之一,NO是由L-精氨酸通过一氧化氮合酶(NOS)合成的,众所周知,NO在感染过程中起着关键作用,能够抑制病原体的增殖和生长[33]。TNF-α是目前发现的最具杀灭肿瘤作用的细胞因子之一,而IL-6是在免疫细胞间传递信号的关键细胞因子[34]。
本研究观察了LSSP对NO、细胞因子(TNF-α、IL-6和IL-1β)的影响。正常组中RAW264.7细胞只释放少量的NO(3.12 μM)、TNF-α(5.52 ng/mL)、IL-6(8.43 ng/mL)和IL-1β(27.56 ng/mL),如图6a~d所示,与正常组相比,LSSP(25、50、100和200 μg/mL)处理能显著促进NO、TNF-α、IL-6和IL-1β的分泌,呈剂量依赖性。在添加LSSP浓度为200 μg/mL时,NO、TNF-α、IL-6和IL-1β的分泌量达到了最大值,与空白组相比,NO、TNF-α、IL-6和IL-1β的分泌量分别增加了48.86 μM、98.75 ng/mL、85.64 ng/mL和46.67 ng/mL。然而,用LSSP(100和200 μg/mL)处理后NO、TNF-α、IL-6和IL-1β的分泌缓慢增加说明LSSP对巨噬细胞的激活是有限的,过度激活巨噬细胞将会导致炎症的产生。众所周知,脂多糖会诱发巨噬细胞发生炎症。然而,LSSP对巨噬细胞的作用远小于LPS。
文献报道莲藕、荷叶、莲子、莲藕节、藕皮、莲子等器官的多糖能够刺激RAW264.7细胞释放NO和细胞因子(TNF-α、IL-6、IL-1β)来增强免疫调节活性,与本研究基本一致,说明莲的不同器官的多糖具有免疫调节活性。另外有研究发现多糖对巨噬细胞的免疫刺激作用依靠受体的识别。识别的分子基础取决于多糖的结构特征,包括分子量、糖基残基和链构象,分子量较大的多糖可能含有较多的多糖高度重复的结构可以多向性交叉连接受体或其他膜靶向增强免疫刺激效果。本研究中LSSP就有较强的免疫调节活性可能与其分子量较大有一定的关系。
3 结论
3.1 目前对多糖活性的大量研究表明,从植物中提取的天然多糖具有多种生物活性,如免疫调节、抗肿瘤和抗氧化作用。多糖的生物活性与单糖组成、分子量、糖苷键和化学结构有关[35]。因此,多糖结构的系统表征是研究多糖生物活性的重要的一步。LSSP单糖组成分析表明,LSSP是一种杂多糖,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖组成,其中半乳糖含量最大,为33.25%,葡萄糖和阿拉伯糖次之。红外光谱分析表明LSSP呈现出多糖类物质的典型特征吸收峰。
3.2 莲子皮多糖作为新发现的天然多糖之一,证实莲子皮多糖具有较强的DPPH、羟基自由基清除活性和还原能力,可以作为一种潜在的天然抗氧化剂资源,另外对Raw264.7细胞的免疫调节实验表明,LSSP可通过刺激巨噬细胞释放NO和细胞因子(TNF-α、IL-6、IL-1β)来增强免疫调节活性,LSSP可作为一种新型的功能性食品免疫调节剂。此研究将为深入研究莲子皮多糖活性作用机制及莲子皮资源开发提供理论依据。同时,下一步的研究工作主要集中在对LSSP进行进一步纯化,再详细探讨其免疫调节作用的蛋白信号通路。

