肿瘤坏死因子受体相关因子6泛素化位点突变载体的构建及其功能位泛素化位点的鉴定
王 琴,林春霖,程志彬,何若凡,林鹏航,陈 辉,叶建新,朱广伟
(1.福建医科大学附属第一医院胃肠外科二区 腹部外科研究所,福建 福州350005;2.福建医科大学消化道恶性肿瘤教育部重点实验室,福建 福州350005)
结直肠癌是世界范围内主要的恶性肿瘤之一[1],也已经成为我国第三大常见恶性肿瘤[2]。本课题组前期研究[3]证实:肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)在结直肠癌中高表达,且对结直肠癌的生物学行为有重要的影响。肿瘤坏死因子受体相关因子(tumor necrosis factor receptorassociated factor,TRAF)家族总共有7个相关蛋白,其中包括6个典型成员TRAF1~6和1个不典型成员TRAF7[4]。羧基末端的TRAF-C结构域、卷曲螺旋的TRAF-C结构域以及氨基末端的RING指结构(TRAF1除外)是TRAF家族成员的共有特征[5-6]。与TRAF家族内其他蛋白比较,TRAF6的TRAF-C结构域差异性最大[5]。研究[7]表明:TRAF6的TRAF-C结构域有其独特的氨基酸序列,这可能与TRAF6具有特殊的生物学功能相关。TRAF6在脑、肺、肝、骨骼肌和肾脏组织中呈高表达,在心脏、脾脏和睾丸组织中呈低表达。有研究[8-9]显示:与周围正常组织比较,TRAF6在多种恶性肿瘤组织中呈高表达,并且影响着肿瘤细胞增殖、迁移和凋亡。TRAF6是一种特异性的E3连接酶,可特异性偶联赖氨酸(K)63连接的聚泛素链[10]。TRAF6已经被确定为NF-κB和MAPK通路的关键介质[11]。SUN等[9]研究显示:下调TRAF6可通过细胞周期蛋白D1(cell cycle protein D1,cyclin D1)阻断结直肠癌细胞的增殖,抑制TRAF6还可以提高5-氟尿嘧啶和依托泊苷的治疗效果。SHEN等[12]研究显示:TRAF6通过辅助分子转化生长因子β活化激酶1(transforming growth factor-β-activated kinase 1,TAK 1)激活蛋白激酶B(protein kinase B,AKT)/糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)的调控信号通路,在mRNA水平促进细胞增殖,在人乳腺肿瘤发生中发挥正向调控作用。MENG等[13]研究显示:miR-124在人骨肉瘤组织和细胞系中的下调增加了TRAF6蛋白的表达,并通过调节TRAF6促进细胞凋亡。但TRAF6是否是通过其泛素化的作用参与肿瘤的发展目前尚不清楚。本研究采用定点突变技术对TRAF6预测的泛素化位点进行突变,获得了泛素化突变质粒,检测其在结直肠癌细胞中对核因子κB(nuclear factor kappa-B,NF-κB)和激活蛋白1(activator protein-1,AP-1)相对荧光素酶活性的影响,从而为进一步研究TRAF6对结直肠癌进展的分子机制奠定良好的基础。
1 材料与方法
1.1 质粒、菌株和细胞携带FLAG标签的过表达质粒pcDNA 3.1-3×FLAG-TRAF6由本实验室构建保存。大肠杆菌感受态细胞DH5α由本实验室制作保存,海肾荧光素酶报告载体p RL-TK、人结直肠癌HCT 116和SW480细胞由福建医科大学消化道恶性肿瘤教育部重点实验室提供,报告基因质粒pNF-κB-Luc和pAP-1-Luc购于武汉淼灵生物科技有限公司。
1.2 主要试剂和仪器DMEM培养基和胎牛血清(美国Gibco公司),磷酸钙转染试剂由本实验室配制,快速突变试剂盒和双荧光素酶报告基因检测试剂盒(南京诺唯赞生物科技有限公司),DNA凝胶回收试剂盒(北京天根生化科技有限公司),质粒提取试剂盒(德国MACHEREY-NAGEL公司)。无菌清洁工作台(苏州苏净安泰空气技术有限公司),PCR仪和细胞培养箱(美国赛默飞世尔科技公司)。
1.3 TRAF6基因泛素化位点的预测通过美国国家生物技术信息中心(National Center Biotechnology Information,NCBI)数据库获得人TRAF6的氨基酸序列(基因序列号:NM_145803.3),标记所有的赖氨酸(K,AAA)位点。采用UbPred、UbiSite和BDM-PUB软件预测TRAF6可能存在的泛素化位点,取3个软件预测的泛素化位点的交集为预测的TRAF6泛素化位点。
1.4 TRAF6泛素化位点突变载体构建以pcDNA 3.1-3×FLAG-TRAF6为模板,采用突变试剂盒(Fast Mutagennesis Kit V 2)对泛素化位点进行定点突变。采用CE Design V 1.04软件设计泛素化位点突变引物,引物由福州博尚生物技术有限公司合成,引物序列见表1。采用PCR法对目标质粒进行扩增。50μL反应体系:2×Max Buffer 25 μL,dNTP Mix(10 mmol·L-1) 1μL,pcDNA 3.1-3×FLAG-TRAF6 1μL(约1μg·L-1);上 游 引 物(10μmol·L-1) 2μL;下 游 引 物(10μmol·L-1)2μL;Phanta Max Super-Fidelity DNA Polymerase 1μL;ddH2O 18μL。反应条件:预变性95℃、30 s;95℃、15 s,68℃、15 s,72℃、3 min,共30个循环;彻底延伸72℃、5 min。扩增产物采用1%琼脂糖凝胶电泳检测,在紫外灯下切胶回收。将扩增产物用一种限制性核酸酶Dpn l酶消化,去除甲基化模板质粒。将50μL扩增产物中加入1μL Dpn l酶,将上述反应体系置于37℃恒温水浴锅中反应2 h。将消化产物进行同源重组,完成扩增产物环化过程。重组反应体系:5×Cell Buffer 4μL;Dpn l消化产物(400 ng)2μL(约200 mg·L-1);ExnaseⅡ2μL;加入ddH2O至20μL。将上述反应体系置于37℃恒温水浴锅中反应30 min。待反应完成后,立即将反应管置于冰上冷却,获得重组质粒。

表1 TRAF6泛素化位点突变质粒的引物序列Tab.1 Primer sequences of mutant plasmids with uniquitination site of TRAF6
1.5 突变载体的转化和鉴定 取-80℃保存的大肠杆菌感受态细胞DH5α置于冰上融化。取20μL上述冷却反应液加入至120μL感受态细胞中,轻弹管壁数下混匀,在冰上放置30 min。42℃恒温水浴锅中热激90 s,冰上孵育2 min。加入900μL LB培养基,37℃恒温水浴锅中孵育10 min充分复苏,250 r·min-1、37℃恒温摇床中摇菌45 min。5 000 g离心2 min,弃去800μL上清液,将剩余菌液混匀后均匀涂布在含有氨苄青霉素抗性的LB琼脂培养基上,将平板倒置,于37℃恒温培养箱中培养16 h后挑取单克隆并扩大培养,将菌液送至福州博尚生物技术有限公司进行DNA测序。
1.6 双荧光素酶报告基因活性检测将处于对数生长期的5×104个结直肠癌细胞接种于24孔板中,置于培养箱中过夜。采用磷酸钙转染法[14]将TRAF6及其泛素化突变质粒、pRL-TK和pNFκB-Luc或pAP-1-Luc质粒共转染结直肠癌细胞,48 h后检测荧光素酶活性,每组设3个复孔。吸弃细胞培养基,采用PBS洗涤2次,加入100μL细胞裂解液(1×Cell Lysis Buffer),放在室温摇床上裂解5 min,吹打并吸取细胞裂解液产物至1.5 mL离心管中,12 000 g常温离心2 min。将100μL平衡至室温的荧光素酶底物加入检测管中,小心吸取20μL细胞裂解上清至检测管中,迅速混匀后立即于荧光检测仪中检测萤火虫荧光素酶报告基因活性。在以上反应液中加入100μL新鲜配置的海肾底物工作液,迅速混匀后立即于荧光检测仪中检测海肾荧光素酶报告基因活性,计算其相对荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。每次实验独立重复3次。
1.7 统计学分析采用GraphPad Prism 8统计软件进行统计学分析。细胞中的相对荧光素酶活性符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 TRAF6泛素化位点的预测经过UbPred、UbiSite和BDM-PUB软件预测:TRAF6最有可能的泛素化位点共有8个,在氨基酸序列上的位置分别为第32、91、124、319、331、371、384和469位点。分别将这8个位点进行突变,把赖氨酸(K,AAA)突变为谷氨酸(E,GAA),并将其分别 命 名 为32mut、91mut、124mut、319mut、331mut、371mut、384mut和469mut(图1)。
2.2 TRAF6泛素化突变载体成功构建采用突变引物以pcDNA 3.1-3×FLAG-TRAF6为模板进行PCR扩增,采用1%琼脂糖凝胶电泳进行鉴定,目的条带的位置在5 000 bp之上(图2),与理论大小7 188 bp相符合。将重组质粒进行转化,LB培养基上成功长出单克隆菌落(图3),即重组质粒成功转化至大肠杆菌中。挑取单克隆菌落进行扩增,将菌液送检进行DNA测序。采用DNAMAN软件将测序结果与TRAF6碱基序列进行比对,结果显示碱基突变成功(图4),即TRAF6各泛素化位点突变质粒构建成功。
2.3 转染泛素化突变质粒后HCT 116和SW480细胞中NF-κB和AP-1相对荧光素酶活性将pcDNA 3.1-3×FLAG-TRAF6及其各泛素化位点突变质粒、pRL-TK和pNF-κB-Luc或pAP-1-Luc共转染结直肠癌细胞,检测其荧光素酶活性。采用双荧光素酶报告基因系统检测荧光素酶活性,将TRAF6野生型的相对荧光素酶活性设置为1。与TRAF6野生型基因比较,结直肠癌细胞转染第124位点突变质粒后,HCT 116和SW480细胞中NF-κB相对荧光素酶活性降低最明显(P<0.01),其次为转染第319位点突变质粒(P<0.01),最后为转染第331位点突变质粒(P<0.05)。转染第124(P<0.01)、第319(P<0.01)和 第331(P<0.05)泛素化位点突变质粒后,HCT 116和SW480细胞中AP-1相对荧光素酶活性变化出现了相似趋势。见表2。
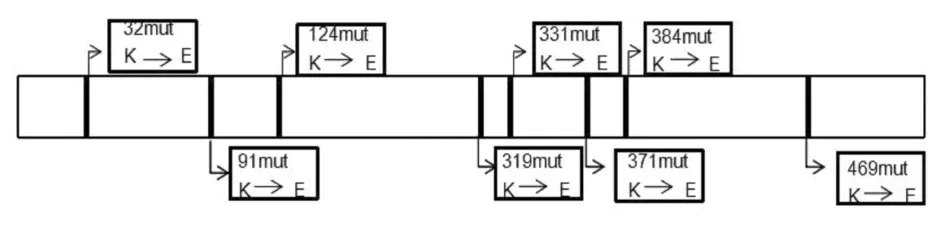
图1 TRAF6氨基酸序列泛素化突变位点示意图Fig.1 Schematic diagram of ubiquitination mutation site of TRAF6 amino acid sequence
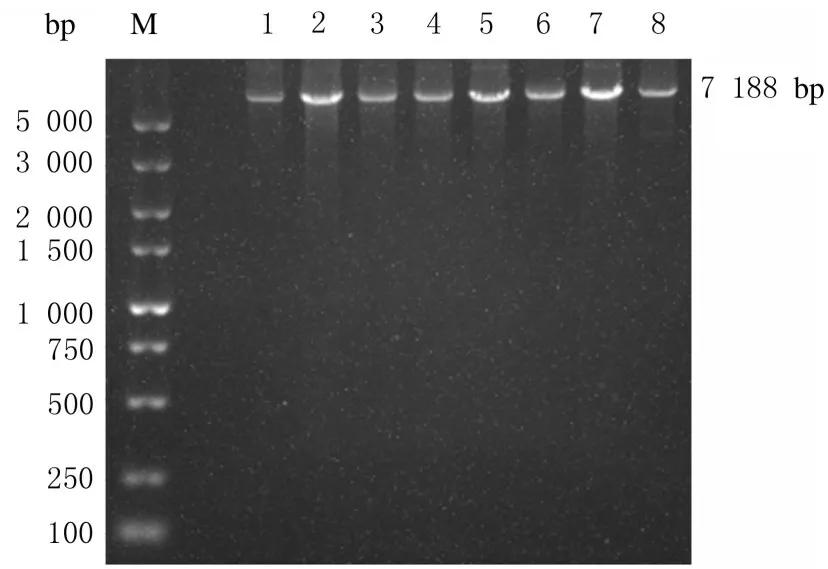
图2 TRAF6各泛素化位点突变质粒PCR扩增电泳图Fig.2 PCR amplification electrophoregram of mutant plasmids at various ubiquitination sites of TRAF6

图3 重组质粒转化后单克隆菌落形成图Fig.3 Diagram of monoclonal colony formation after recombinant plasmid transformation
3 讨 论
泛素是一种存在于所有真核生物(大部分真核细胞)中的小蛋白,泛素由76个氨基酸组成[15]。泛素化是指泛素分子在一系列特殊的酶作用下,将细胞中的蛋白分类,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程。泛素化在蛋白质的功能、代谢、调节和降解中均发挥重要作用[16-17]。同时,其也参与了细胞周期、增殖、凋亡和转录等生命活动的调控[18-20]。泛素化在肿瘤组织中也发挥重要作用,如组蛋白去甲基化酶LSD2通过发挥其E3泛素连接酶的作用来促进O-Glc NAc转移酶(OGlc NAc transferase,OGT)蛋白酶体的降解,进而影响癌细胞的生长[21]。Smurf2经过诱导Smurf1的泛素依赖降解来阻止乳腺癌细胞的迁移[22]。进一步研究泛素化在肿瘤发展中的具体机制也将是一种趋势。泛素化通常是发生在赖氨酸残基上[23]。泛素化修饰需要3种酶的参与,分别是泛素化活化酶E1、泛素结合酶E2和泛素连接酶E3,其中泛素连接酶E3决定着泛素化的特异性[24]。TRAF6是一种具有环状结构域的E3泛素连接酶,参与一些靶蛋白的K63连接泛素化[25]。但是,TRAF6参与泛素化发生的具体相关机制尚未明确。本研究首先通过泛素化位点预测软件获得了TRAF6基因上可能存在的泛素化位点(共有8个),再将这8个泛素化位点进行定点突变,获得8个TRAF6的泛素化位点突变质粒。
TRAF6首次被发现是在鼠的cDNA上。TRAF6的cDNA可以编码530个氨基酸,相对分子质量为60 000[7]。TRAF6的TRAF-C结构域主要是发生寡聚化和特异性的结合,TRAF-N结构域主要行使作为E3泛素连接酶的功能,与E2结合酶结合调节多种蛋白的多聚泛素化[26]。TRAF-N结构域中的RING指区域被认为是下游信号的关键[27]。TRAF6已经被证实是调节炎症和免疫信号的转换器[28-29]。TRAF6作为一种E3连接酶,与K63连接发生泛素化来激活NF-κB和MAPK信号通路,而且TRAF6的泛素化在触发初始激活步骤中起关键的作用[10]。有研究[30]显 示:β-arrestin-TRAF6形成的复合物通过阻止TRAF6的自身泛素化来阻止TRAF6激活NF-κB和AP-1,影响其信号通路的激活。MiR-146可通过靶向TRAF6介导的NF-κB和MAPK信号通路来诱导软骨细胞增殖和凋亡[31]。MiR-574-5p可以直接调控TRAF6来抑制NF-κB信号通路以减轻肺损伤[32]。TRAF6对肿瘤的发生发展也起重要作用。MiR-146a-5p通过抑制TARF6的表达来调节细胞凋亡、增殖和侵袭进而调控胰腺导管细胞的癌变和化疗耐药性[33]。在人肺癌细胞中,抑制TRAF6将会抑制NF-κB的激活、非锚定生长和肿瘤形成,而在这些肺癌细胞中,RAS需要TRAF6才能发挥致癌作用[34]。TRAF6对肿瘤的影响是否与其泛素化有关有待进一步的研究。本研究结果显示:124mut、319mut和331mut位点对NF-κB和AP-1相对荧光素酶活性有重要影响,其中124mut对NF-κB和AP-1相对荧光素酶活性的影响最为明显。
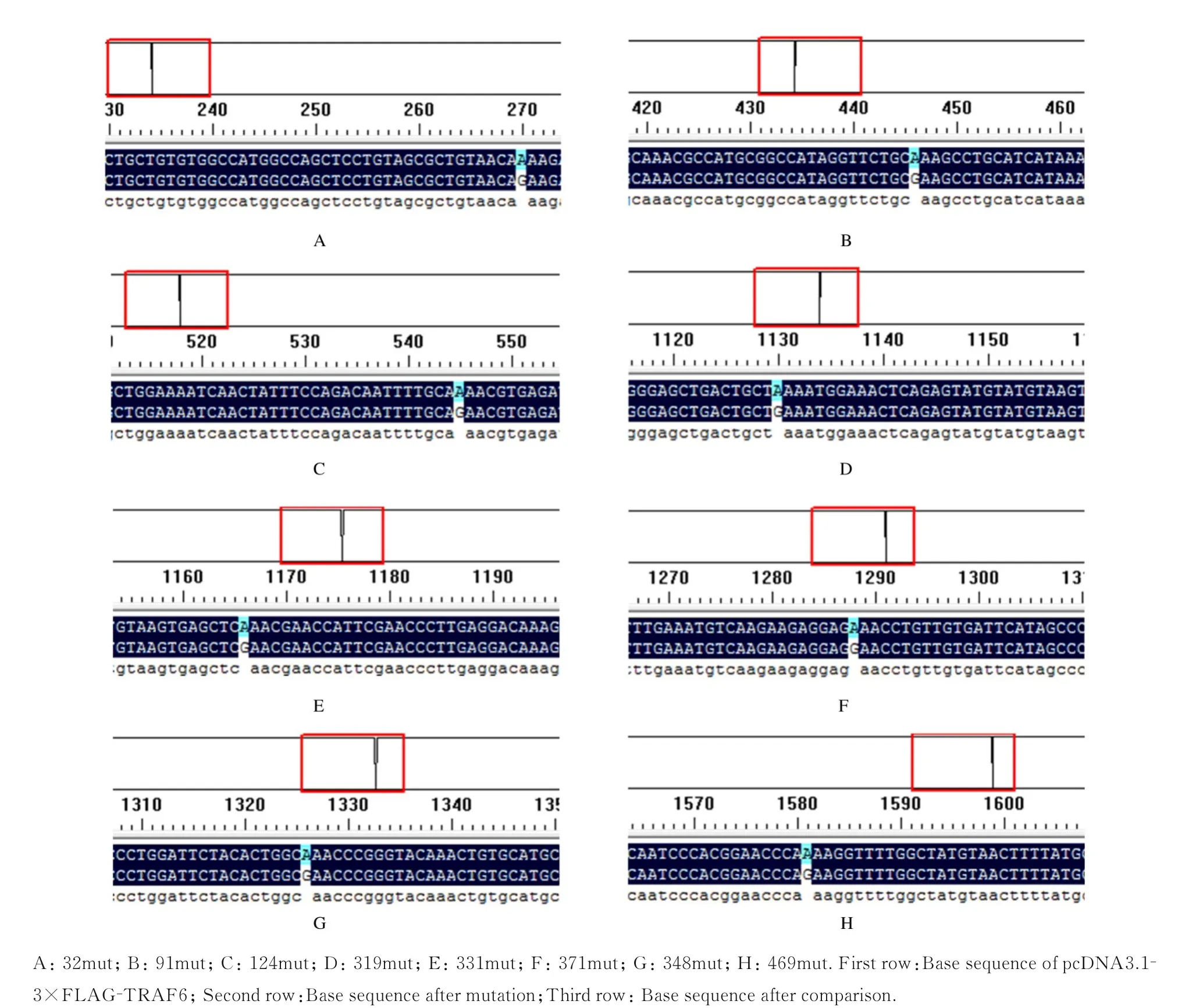
图4 各泛素化突变质粒的测序结果Fig.4 Sequencing results of ubiquitination mutant plasmid

表2 转染泛素化突变质粒后HCT 116和SW480细胞中NF-κB和AP-1相对荧光素酶活性Tab.2 Relative luciferase activities of NF-κB and AP-1 in HCT 116 and SW480 cells after transfected with ubiquitination mutant plasmid
本课题组成功构建了TRAF6泛素化位点突变载体,采用突变载体验证了其在结直肠癌细胞中对NF-κB和AP-1相对荧光素酶活性的影响,发现TRAF6基因的第124个氨基酸位点是其最为关键的泛素化位点,也可能是影响下游信号通路中NF-κB和AP-1因子活性的关键位点。本研究结果为进一步探讨TRAF6基因对结直肠癌进展的分子机制奠定了基础。

