黑茶菌添加量对包包曲培菌过程品质的影响
范斌强 吴浩人 余有贵 刘安然 熊 翔
(1.邵阳学院食品与化学工程学院,湖南 邵阳 422000;2.生态酿酒技术与应用湖南省高校重点实验室,湖南 邵阳 422000;3.湖南省茶业集团股份有限公司,湖南 长沙 410000;4.湖南湘窖酒业有限公司,湖南 邵阳 422000)
白酒生产过程中,大曲为白酒发酵提供霉菌、酵母菌、细菌以及酶类[1],因此控制大曲质量是白酒酿造的关键[2]。大曲是通过富集自然环境中各种微生物经发酵培养制成[3],而强化大曲是将分离出来具有某种特定功能的微生物添加到大曲的制曲原料中[4],以增强大曲的某种性能,从而提高酿酒原料的出酒率或改善白酒的品质。Li等[5]将片球菌、酵母菌等纯种微生物接种至酒曲中,丰富了大曲中微生物群落结构。刘宇[6]通过添加纯种细菌和霉菌至酱香大曲中,改善了白酒的风味。姜鹏[7]将高产酯的酵母菌添加至大曲中提高了出酒率和白酒中总酸、总酯含量。王晓娜[8]研究了夏秋茶制作大曲的工艺对大曲品质和固态发酵茶酒的影响。冠突散囊菌(Eurotium cristatum)又称金花菌,是茯砖茶在适宜条件下,通过“发花”工艺生长的有益菌[9]。冠突散囊菌在发酵期间会通过代谢产生对人体健康有益的产物,使茯砖茶具有降血糖、抗氧化以及调节肠胃等功能[10]。目前,冠突散囊菌的研究大多集中在分离鉴定[11]、抑菌活性[12]、工艺优化[13]、抗氧化性[14]等方面,关于冠突散囊菌的黑茶培养物制成强化大曲方面的研究尚未见报道。研究拟以偏高温包包曲制作工艺为基础,采用含冠突散囊菌黑茶制备强化大曲,对培菌管理过程中主要微生物类群、酶活力和常规理化指标的动态变化进行对比分析,探索黑茶强化大曲与传统大曲的差异,为黑茶大曲的开发和提高酒曲的糖化力提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
黑毛茶:要求黑褐油润、紧结肥壮,湖南省茶业集团股份有限公司;
冠突散囊菌:从传统黑茶的金花中分离获得,湖南省茶业集团股份有限公司;
黑茶菌:根据参考文献[15]的研究方法进行制备改良,以黑毛茶为原料,杀菌处理后接种冠突散囊菌菌悬液,发酵条件为接种量9%,料液比1.0∶14.5 (g/mL),发酵时间125 h,干燥后获得黑茶菌培养物,简称黑茶菌,用于包包曲强化,生态酿酒技术与应用湖南省高校重点实验室;
小麦:选用颗粒饱满,无虫害的小麦,粉碎过20目筛,湖南湘窖有限公司;
葡萄糖、琼脂、蛋白胨、可溶性淀粉、酒石酸钾钠、浓盐酸、氢氧化钠、次甲基蓝等:分析纯,邵阳市科仪化玻有限公司。
1.1.2 主要仪器和设备
恒温培养箱:DH-420型,北京科伟永兴仪器有限公司;
恒温水浴锅:DK-99-3型,江苏金坛中大仪器厂;
磁力搅拌器:HJ-1型,常州越新仪器制造有限公司;
自动压力蒸汽灭菌器:GI54DWS型,致微(厦门)仪器有限公司;
《蒲团》的创作时间是明治40年。正是日俄战争结束的时候。那个时候,日本的现代化的速度变快了。生驹夏美在论文中如此写道。“也就是说,即使不能否认明治维新要将日本变身为西洋的近代国家而出发了,但这一想法并非等同于大家的共享,而且,西方的压力和思想也广泛流传下来了吗?正是因为他们出现了强烈的反对和反动,所以也产生了江户时代以前日本存在的愿望吧。当时的日本无论是技术还是外表都是西洋化的,但内心的根本就是日本式。日本的封建思想又深深地留在了人们的心中。封建思想的力量很强。当时的日本人崇尚西方文明,但它只停留在行为和服装等水上。由于日本的传统文化和西方文明的根本不同,西方文明也无法彻底接受。
便携式pH计:LE438型,梅特勒—托利多仪器(上海)有限公司;
超净工作台:SW-CJ-1FD型,苏州智净净化设备有限公司。
1.2 工艺流程
以湖南湘窖酒业有限公司的偏高温包包曲的制曲工艺为基础,以常规小麦包包曲为对照组,每块曲坯重3.2 kg;分别按小麦重量的5%,10%,15%,20%添加黑茶菌,经混合润粮,制备曲坯,每个添加量制作10块曲坯、3批次,经入室安曲、培菌管理制成新曲,其工艺流程图如图1所示[16]。

图1 黑茶曲工艺路线Figure 1 Technological route of dark tea Jiuqu
1.3 试验方法
1.3.1 培养基配制
(1) 孟加拉红培养基:蛋白胨5 g、磷酸二氢钾1.0 g、硫酸镁0.5 g、葡萄糖10.0 g、氯霉素0.1 g、孟加拉红0.033 g、琼脂20.0 g,蒸馏水1 000 mL。
(2) 营养琼脂培养基:蛋白胨10 g、牛肉膏3 g、氯化钠5 g、琼脂15~20 g,蒸馏水1 000 mL。
(3) 察氏琼脂培养基:硝酸钠3 g、磷酸氢二钾1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、琼脂15 g,pH (6.2±0.2),蒸馏水1 000 mL。
1.3.2 微生物的培养与计数 准确称取25 g大曲粉至装有225 mL无菌稀释液的三角瓶中,充分振荡,取1 mL至装有9 mL无菌稀释液的试管中,得到10-2稀释液,依次操作得到10-3,10-4,10-5稀释液。吸取1 mL稀释液加至培养皿中,倒入温度适中的营养琼脂培养基、孟加拉红培养基养基、察氏琼脂培养基,摇晃混匀,待凝固后倒置,营养琼脂培养基放入35 ℃培养箱中,其余放入28 ℃培养箱中,培养1~2 d,分别对细菌、酵母菌、霉菌和冠突散囊菌进行计数。
1.3.3 大曲的理化指标与酶活检测 参照QB/T 4257—2011《酿酒大曲通用分析方法》。
2 结果与分析
2.1 对培菌过程中微生物类群动态变化的影响
2.1.1 霉菌和冠突散囊菌 由表1可知,随着发酵时间的增加,霉菌数量先升后降,并在培菌第3天达最大值。随着发酵时间的增加,大曲温度逐渐升高,霉菌生长受到抑制,霉菌数量开始减少;随着大曲温度的降低,霉菌数量略有回升,并在入库时趋于稳定。黑茶曲添加组的霉菌数量与传统大曲对照组之间呈显著变化(P<0.05)。培菌前期,温度、湿度适宜,霉菌数量增加,培菌第2天,各黑茶曲添加组之间差异显著(P<0.05);随着发酵时间的增加,大曲温度在培菌第8天达到顶温,15%黑茶菌添加组的霉菌数与对照组之间差异显著(P<0.05);随着大曲温度的降低,传统大曲对照组的霉菌与黑茶菌添加组之间差异显著(P<0.05)。在培菌管理结束的第28天入库时,15%和20%黑茶菌添加组的霉菌数与对照组之间差异显著(P<0.05)且协同促进霉菌的生长;15%和20%黑茶菌添加组的霉菌数量与5%,10%黑茶菌添加组之间存在显著性差异(P<0.05),但5%和10%黑茶菌添加组之间的差异不显著。
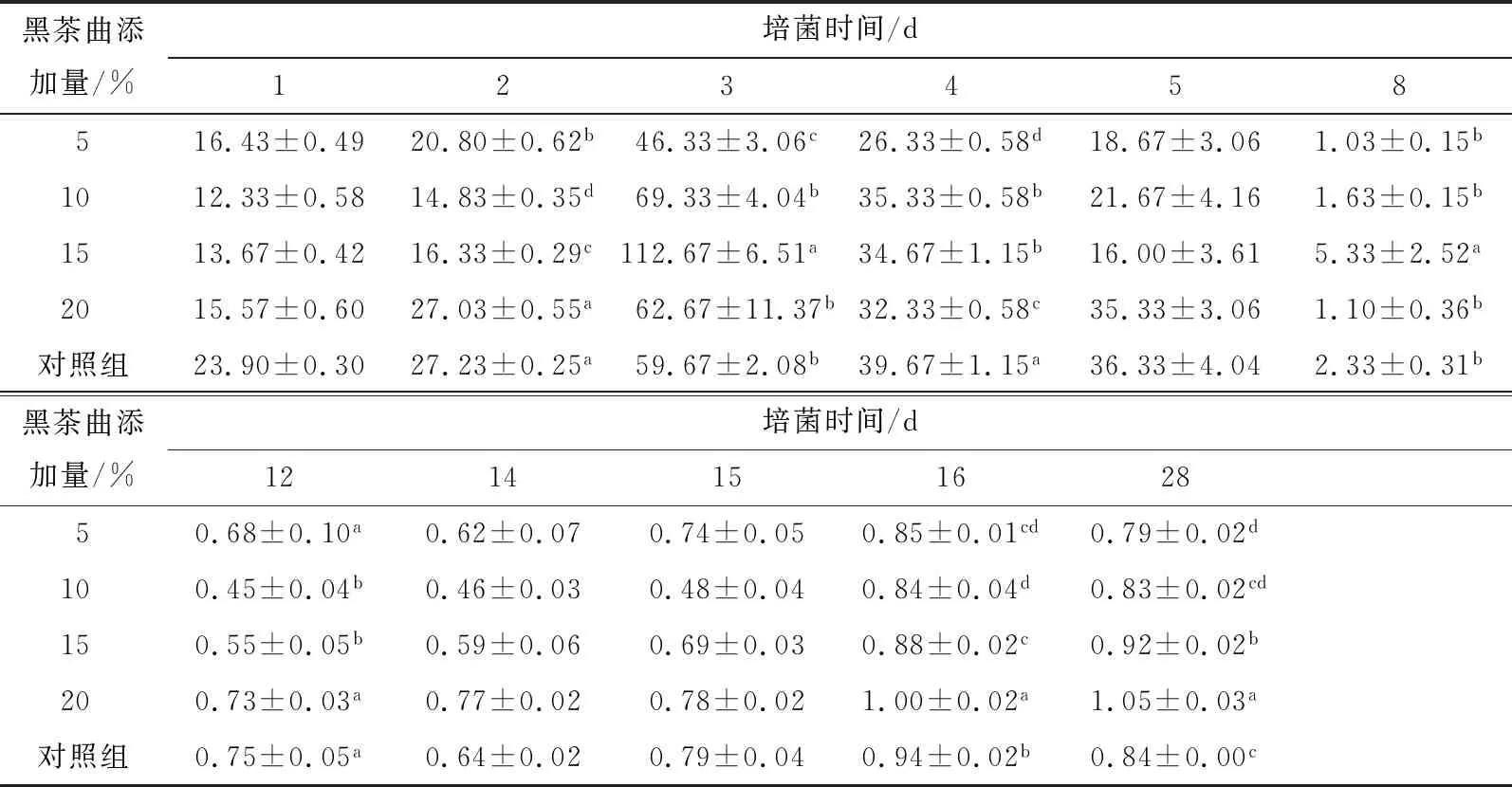
表1 大曲中霉菌总数的动态变化†Table 1 Total number of molds in different Aspergillus ×105 CFU/g
考虑到培菌管理前、中期冠突散囊菌在小麦培养基中生长不明显,故只在培菌结束的新曲入库时进行检测。由表2可知,强化大曲中有冠突散囊菌检出,说明冠突散囊菌能够在小麦包包曲中生长繁殖。

表2 培菌第28天大曲中冠突散囊菌总数Table 2 Total number of Corona aspergillus in different Daqu ×105 CFU/g
2.1.2 酵母菌 由表3可知,随着发酵时间的增加,酵母菌先升后降再缓慢上升。主要原因在于培菌前期温度适宜,大曲中酵母菌大量繁殖;而当发酵温度上升至50 ℃时,超过酵母菌最佳生长繁殖温度,酵母菌生长处于抑制状态;发酵培菌后期随着温度的降落,酵母菌略有增加,但基本处于稳定状态。黑茶菌添加组的酵母菌数量与传统大曲对照组之间差异显著(P<0.05)。培菌第3天,5%黑茶菌添加组的酵母菌数量与传统大曲对照组之间无显著性差异,但其他黑茶菌添加组与传统大曲对照组之间呈显著性差异(P<0.05)。进入高温发酵阶段,酵母菌数量降低,培菌第12天,黑茶菌添加组与传统大曲对照组之间存在显著性差异(P<0.05)。随着大曲温度的降低,传统大曲对照组的酵母菌数量与其他黑茶添加组之间差异显著(P<0.05)。在培菌管理结束的第28天入库时,黑茶菌添加组的酵母菌数量与传统大曲对照组之间差异显著(P<0.05)且抑制酵母菌的生长;但各黑茶菌添加组之间的酵母菌数量差异不显著。酒曲中黑茶菌、霉菌和酵母菌的生长繁殖均需要耗氧,可能是黑茶菌、霉菌的生长繁殖能力强,对酵母菌具有竞争性抑制作用,从而在大曲中强化黑茶菌会相对减少酵母菌的数量。

表3 大曲中酵母菌总数的动态变化†Table 3 Total number of yeast in different Daqu ×105 CFU/g
2.1.3 细菌 由表4可知,培菌前期养分比较充足,细菌数量在入房前3 d增加,随着发酵时间的延长,大曲温度升高,不耐高温的微生物数量减少,细菌在第4天时处于最大值,此时温度恰好适合耐高温的细菌生长繁殖;进入高温发酵培菌阶段后,细菌开始减少。随着大曲温度的下降,细菌数量有所回升。黑茶菌添加组的细菌数量与传统大曲对照组之间差异显著(P<0.05)。大曲培养第2,3天,5%黑茶菌添加组的细菌数量与传统大曲对照组之间无显著差异,但其他黑茶菌添加组的细菌数量与传统大曲对照组之间差异显著(P<0.05)。在培菌管理结束的第28天入库时,黑茶菌添加组的细菌数量与传统大曲对照组之间差异显著(P<0.05)且抑制细菌的生长;且5%的黑茶菌添加组的细菌数量与其他各添加量之间差异显著(P<0.05)。
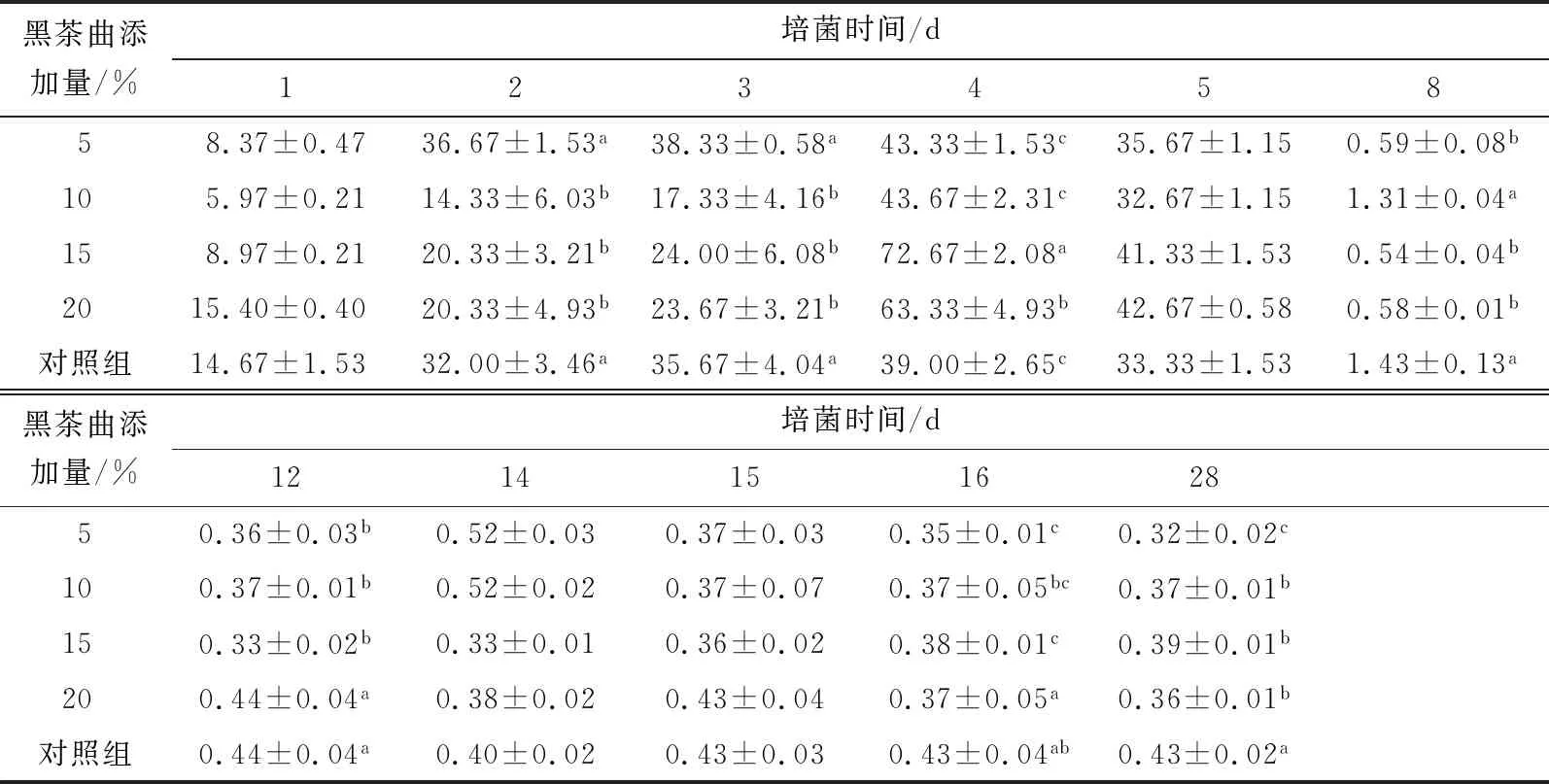
表4 大曲中细菌总数的动态变化†Table 4 Total number of bacteria in different Daqu ×105 CFU/g
2.2 对培菌过程中理化指标的影响
2.2.1 大曲温度 由图2可知,大曲温度随发酵时间的增加先增加后缓慢下降,第5天时达到顶温58 ℃,共持续7 d;第12天大曲温度缓慢降低,第16天时大曲温度降至室温(26 ℃),符合中高温大曲“前缓中挺后缓落”的变化趋势。第28天入库,大曲温度为20 ℃。
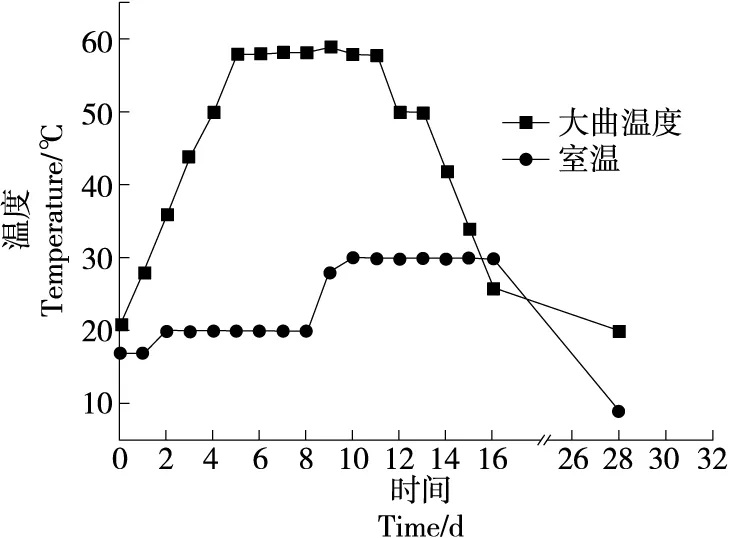
图2 大曲温度的变化趋势Figure 2 Trend of temperature variation of different Daqu
2.2.2 水分 由图3可知,随着发酵时间的增加,大曲的水分含量迅速降低。大曲刚入房成“川”字摆放,有助于水分挥发。培菌前期,大曲温度较低,水分减少较缓。随着发酵时间的增加,大曲进入高温发酵阶段,水分开始迅速降低。第28天入库,各黑茶菌添加组的大曲水分维持在15%左右,说明大曲水分变化与大曲温度密切相关。

图3 大曲水分动态变化图Figure 3 Dynamicchanges of water in different Daqu
2.2.3 酸度 由图4可知,培菌第1~4天,产酸微生物迅速繁殖,酸度增加;培菌第5~11天,进入高温发酵阶段,不耐高温的微生物开始死亡,酸度降低,此阶段大曲温度维持在58 ℃左右;培菌第12~16天,大曲温度逐渐降低,微生物开始生长繁殖,酸度增加。第28天入库时,大曲温度趋于室温,微生物死亡与代谢速率基本维持稳定,酸度也基本维持稳定。

图4 大曲酸度动态变化图Figure 4 Dynamicchanges of acidity of different Daqu
2.2.4 淀粉含量 由图5可知,淀粉含量在整个发酵过程中呈下降趋势。培菌前期,合适的温度导致微生物数量快速增加,并且由于淀粉是多糖,为大曲中微生物生长提供所需的能量,因此微生物对原料中淀粉分解和消耗增加;进入高温发酵期后,大量微生物死亡导致对淀粉的利用率降低,淀粉含量趋于平缓;第28天入库时,大曲温度趋于室温,且水分含量降低,微生物生长趋于平衡,微生物对淀粉的消耗比较稳定。

图5 大曲淀粉含量动态变化图Figure 5 Dynamic changes of starch content in different Daqu
2.3 对培菌过程中酶活力的影响
2.3.1 发酵力 由图6可知,发酵力在整个发酵过程中先升高后降低。培菌前期,发酵力开始增加;培菌第5~12天进入高温发酵期,微生物的生长繁殖速度降低,发酵力随温度的升高开始降低;进入高温发酵后期,温度降低,微生物数量缓慢回升,发酵力基本维持稳定。
由图6还可知,黑茶菌添加组的发酵力与传统大曲对照组之间差异显著(P<0.05)。培菌第2天,10%和20%的黑茶菌添加组的发酵力与传统大曲对照组之间差异显著(P<0.05);但培菌第3,4,8,12天,有部分黑茶菌添加组的发酵力与传统大曲对照组之间差异显著(P<0.05);培菌第16天,茶曲试验组发酵力与对照组之间差异显著(P<0.05);在培菌管理结束的第28天入库时,5%和10%的黑茶菌添加组的发酵力与传统大曲对照组之间无差异显著(P>0.05),15%和20%的黑茶菌添加组的发酵力与传统大曲对照组之间差异显著(P<0.05),且能显著提高大曲的发酵力。大曲中功能霉菌以曲霉和根霉为主,其中黑曲霉和根霉含有较强的酒化酶,有产乙醇能力[17],试验以15%和20%含冠突散囊菌的黑茶菌制备强化大曲,虽然竞争性抑制了发酵力强的酵母菌的生长繁殖,但可能是霉菌数量显著增多而具有较强的发酵力,因此试验组的发酵力有明显提升。
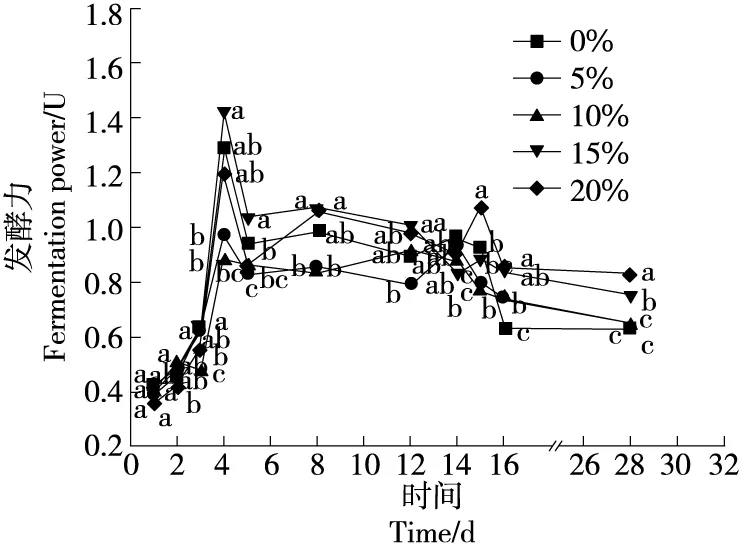
图6 大曲发酵力动态变化Figure 6 Dynamic changes of fermentation power of different Daqu
2.3.2 液化酶活力 由图7可知,大曲的液化力在入库发酵时为0,培菌前期微生物开始生长繁殖,液化力增加;液化力在高温发酵期开始降低;培菌第12~16天,温度逐渐趋于室温,液化力升高,是由于此时微生物开始繁殖。
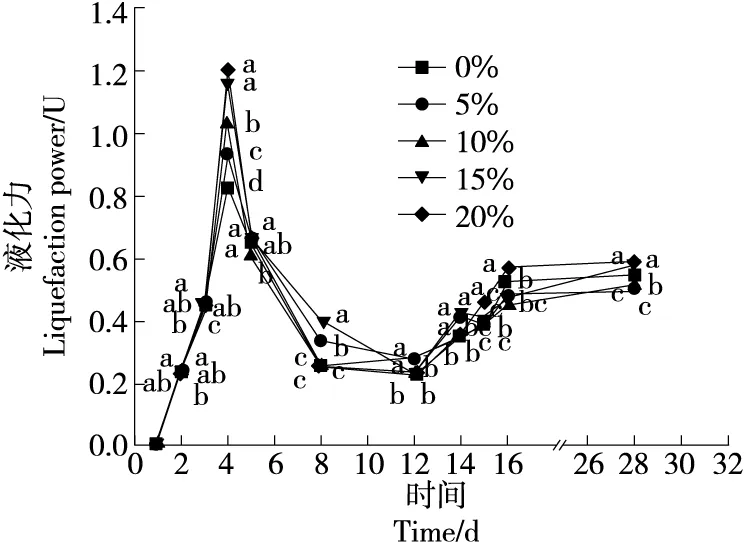
字母不同表示差异显著(P<0.05)图7 大曲液化力动态变化Figure 7 Dynamic changes of Daqu liquefaction force
由图7还可知,黑茶菌添加组的液化力与传统大曲对照组之间差异显著(P<0.05)。培菌第2天,黑茶菌添加组的液化力与传统大曲对照组之间无显著差异;但培菌第3,4,8,12,16天,有部分黑茶菌添加组的液化力与传统大曲对照组之间差异显著(P<0.05),且15%和20%的黑茶菌添加组的液化力与传统大曲对照组之间差异显著(P<0.05)。在培菌管理结束的第28天入库时,黑茶菌添加组的液化力与传统大曲对照组之间差异显著(P<0.05)且能显著提高大曲的液化力;各黑茶菌添加组之间的液化力无显著差异。
2.3.3 糖化酶活力 由图8可知,大曲刚进入培菌期时,由于原料中带有一定量的糖化酶,因此大曲具有很高的糖化力,随着发酵时间的增加,环境温度升高,微生物大量死亡,尤其是霉菌的大量死亡,微生物代谢产生的酶量减少,糖化力较大幅度降低;培菌第12~16天,糖化力有所回升;第28天入库时,糖化力均维持在稳定状态。
由图8还可知,黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05)。培菌第2天,只有10%黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05);培菌第3天,黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05)且能显著提高糖化力;培菌第4天,15%和20%的黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05)且能显著降低糖化力;培菌第8天,5%,15%和20%的黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05)且能显著降低糖化力;培菌第12天,只有15%黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05)且能显著提高糖化力;培菌第16天,黑茶菌添加组的糖化力与传统大曲对照组之间差异显著(P<0.05),其中20%的黑茶菌添加组能显著提高糖化力,但其他黑茶菌添加组能显著降低糖化力。第28天入库时,除10%的黑茶菌添加组外,其他3个黑茶菌添加组的糖化力与对照组之间差异显著(P<0.05),且15%和20%的黑茶菌添加组能显著提高大曲的糖化力,但5%的黑茶菌添加组能显著降低大曲的糖化力;且各黑茶菌添加组之间的糖化力均有显著性差异(P<0.05)。

字母不同表示差异显著(P<0.05)图8 大曲糖化力动态变化Figure 8 Dynamic changes of Daqu saccharification power
3 结论
在培菌管理的28 d内,与传统大曲对照组相比,各黑茶菌添加组会引起微生物类群数量(霉菌、酵母、细菌和冠突散囊菌)、常规理化指标(培菌温度、酒曲水分、酸度和淀粉含量)和酶活力(发酵力、液化力和糖化力)均有不同程度的变化,且各黑茶菌添加组之间也呈不同程度的变化。在传统偏高温包包曲中,采用含冠突散囊菌的黑茶菌培养物进行强化,在培菌管理结束的第28天入库时,15%和20%的黑茶菌添加组的霉菌、细菌和酵母数量与传统大曲对照组之间差异显著(P<0.05),说明黑茶菌的添加能显著促进大曲中霉菌的生长繁殖、抑制大曲中细菌和酵母菌的生长繁殖;同时,15%和20%的黑茶菌添加组的液化力和糖化力与传统大曲对照组之间呈显著性差异(P<0.05),说明黑茶菌的添加能显著提高大曲的液化力和糖化力。利用现代分子生物技术,后续可进一步对黑茶菌强化大曲微生物区系的作用机理进行分析。

