亚低温辅治重型颅脑损伤及对血清和肽素、高迁移率族蛋白B1、微管相关蛋白tau的影响
祁金敏,李宗喜,全 凯
(1.成都医学院第一附属医院神经外科,四川 成都 610500;2.重庆海吉亚肿瘤医院神经外科,重庆 401331)
重型颅脑损伤(STBI)系脑部遭遇暴力撞击导致的颅脑严重损伤,常进展迅速,若无法获得及时有效治疗,极易导致患者在短时间内死亡[1]。对于STBI,临床多行手术治疗,手术治疗尽管可清除血肿,降低颅内压,减少脑组织损伤,使多数患者获益,但难以彻底抑制脑组织生理损伤机制,且其作为侵袭性操作,常给患者带来二次创伤,影响患者预后[2]。资料显示,亚低温可保护STBI患者脑组织,改善神经功能,有助于患者康复[3]。我院于2015年7月至2020年6月以亚低温辅治STBI,在评价其疗效的同时探究其对血清和肽素(Copeptin)、高迁移率族蛋白B1(HMGB1)、微管相关蛋白tau(Tau)的影响,报道如下。
1 资料与方法
1.1 一般资料选择2015年7月至2020年6月成都医学院第一附属医院收治的96例STBI患者,纳入标准:经影像学诊断为STBI者;有明确的外伤史,符合大骨瓣减压术指征者;入院前半年内无手术及创伤史;治疗依从性良好;经医学伦理委员会批准,患者或家属签署知情同意书。排除标准:颅脑开放性损伤者;重症多发伤者;预期生存<90天者;脑部重症疾病史者;肝肾功能异常者;中途放弃治疗或自愿要求出院者;恶性肿瘤者。本组男65例,女31例,年龄24~75岁[(47.88±4.92)岁];损伤因素:交通伤41例;高坠伤32例,摔伤20例,打击伤3例;受伤至入院时间1~8小时[(3.42±0.36)小时];损伤类型:颅内血肿合并脑挫裂伤53例,单纯脑挫裂伤23例,单纯颅内血肿15例,弥漫性轴索损伤5例;GCS评分3~8分[(5.94±0.62)分]。按照随机数字表分为试验组与对照组各48例,两组患者性别、年龄、损伤因素、受伤至入院时间、损伤类型、GCS评分等基线资料比较差异无统计学意义(P>0.05)。见表1。本研究通过医院伦理委员会批准。

表1 两组基线资料比较
1.2 方法对照组行常规治疗,包括降低颅内压,改善脑循环,营养神经等。治疗时间30天。试验组在此基础上加亚低温辅治:头颅以冰帽降温,全身以冰毯持续降温。输液泵持续泵入杜冷丁(100 mg)+生理盐水(50 ml)+异丙嗪、氯丙嗪各50 mg,起始泵入速度:10~20 ml/h,按照患者情况将泵入速度逐渐调整至5~10 ml/h并维持。维持肛温32~34 ℃。亚低温辅治时间5天。亚低温辅治后以自然复温法于12小时内使肛温逐渐恢复至正常。
1.3 观察指标观察两组治疗前及治疗后嗜睡情况、日常生活能力及GCS评分。治疗前及治疗7天后脑部血流动态阻力(DR)、平均血流量(Qmean)、平均血流速度(Vmean)等脑部血流指标及颅内压;血清Copeptin、HMGB1、Tau水平;并发症及预后情况。嗜睡情况、日常生活能力分别以Epworth嗜睡量表(ESS)[4]、日常生活活动能力量表(ADL)[5]进行评价;多普勒血流成像仪检测脑部血流指标;颅内压监护仪检测颅内压;ELISA法检测Copeptin、HMGB1、Tau。
1.4 统计学方法采用SPSS 19.0统计软件分析数据。计量资料以均数±标准差表示,组内比较行配对t检验、组间比较行独立样本t检验;计数资料以n(%)表示,组内、组间比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 两组ESS、ADL、GCS评分比较治疗前,两组ESS、ADL、GCS评分差异无统计学意义(P>0.05);治疗后,两组ESS、ADL、GCS评分均较治疗前增加,且试验组优于对照组(P<0.05)。见表2。
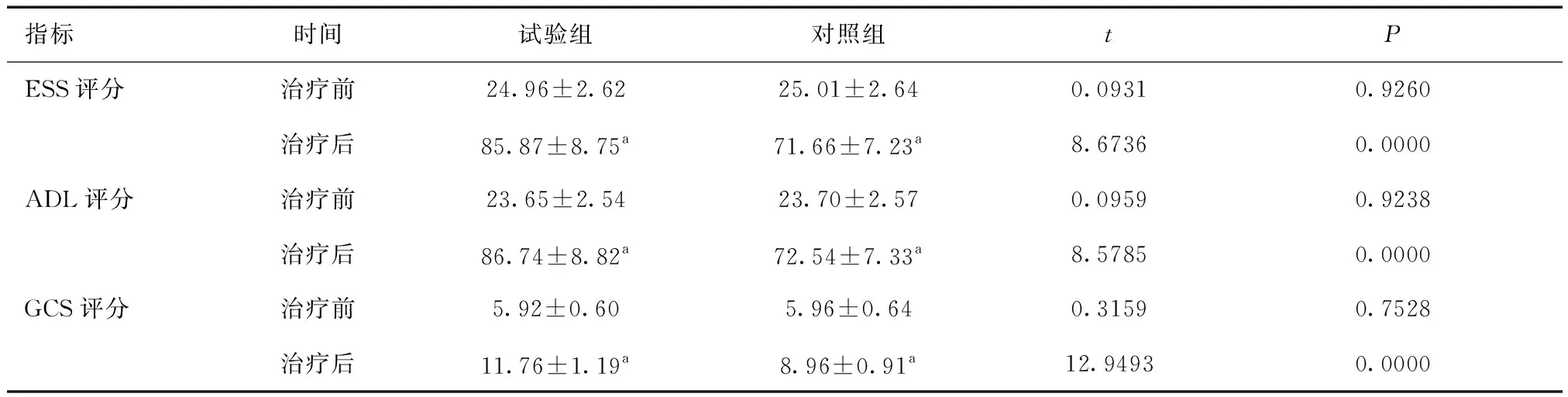
表2 两组ESS、ADL、GCS评分比较 (分)
2.2 两组脑部血流指标及颅内压比较治疗前,两组DR、Qmean、Vmean及颅内压差异均无统计学意义(P>0.05);治疗7天后,两组Qmean、Vmean均较治疗前增大,DR、颅内压均较治疗前减小(P<0.05),且试验组Qmean、Vmean大于对照组,DR和颅内压小于对照组(P<0.01)。见表3。
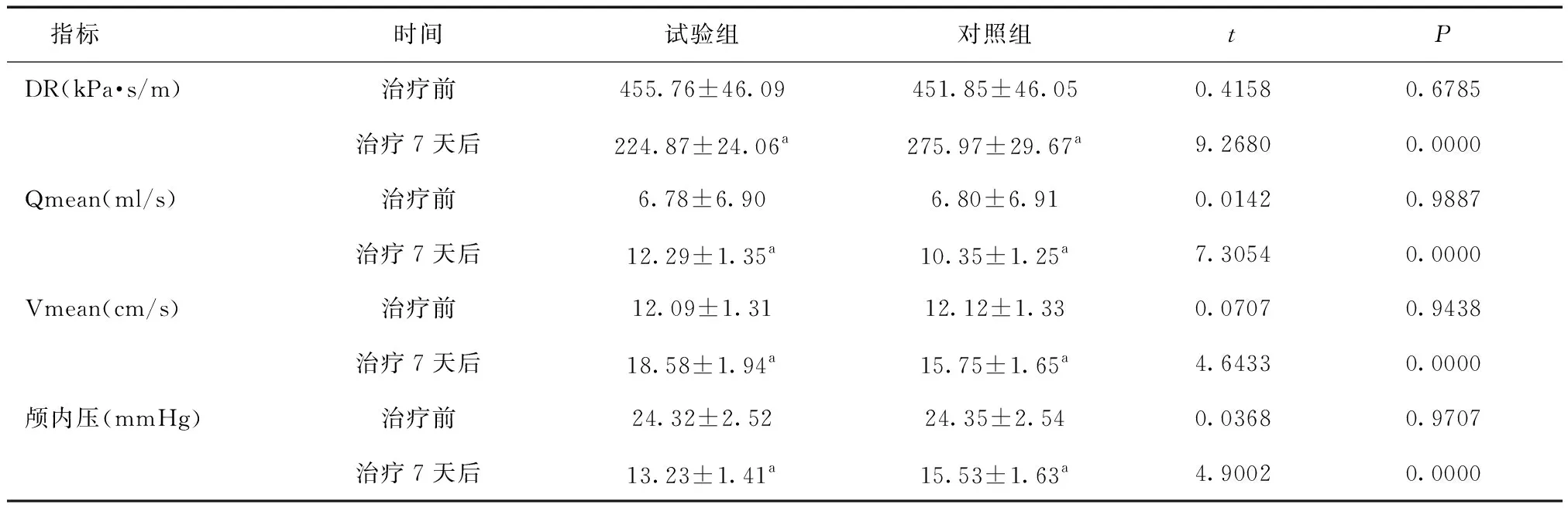
表3 两组脑部血流指标及颅内压比较
2.3 两组Copeptin、HMGB1、Tau水平比较治疗前,两组Copeptin、HMGB1、Tau水平差异均无统计学意义(P>0.05);治疗7天后,两组Copeptin、HMGB1、Tau水平均较治疗前降低,且试验组均低于对照组(P<0.01)。见表4。

表4 两组Copeptin、HMGB1、Tau水平比较
2.4 两组并发症比较试验组并发症发病率低于对照组(P<0.05)。见表5。
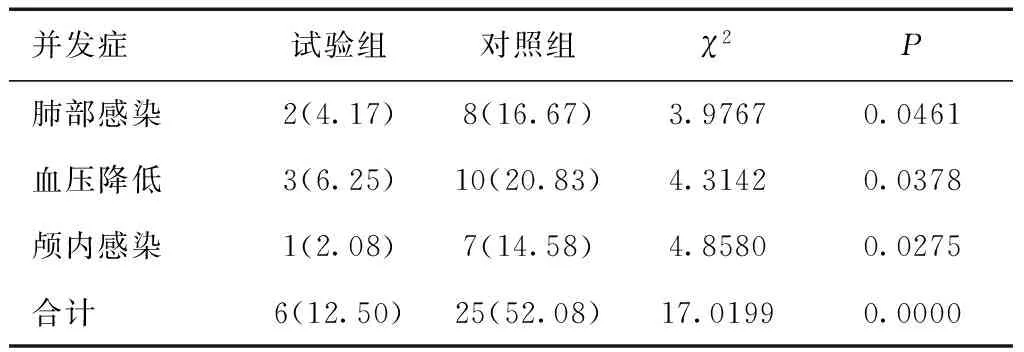
表5 两组并发症发生情况比较 [n(%)]
2.5 两组预后情况比较试验组无残或轻残率高于对照组(P<0.05)。见表6。
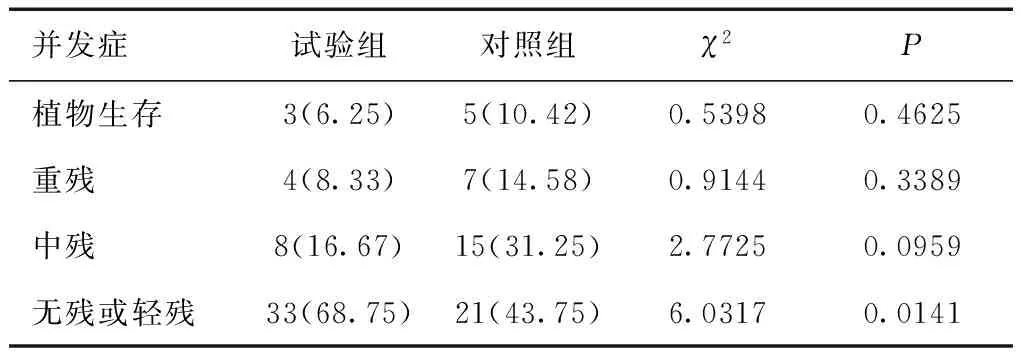
表6 两组预后情况比较 [n(%)]
3 讨论
继发性脑损伤是STBI预后不良的重要因素,抑制或避免继发性脑损伤有助于患者转归[6]。亚低温可经下述方式抑制或避免继发性脑损伤[7~11]:亚低温可降低颅内压,提高血管功能稳定性,改善缺血区血流灌注,保护脑组织,避免脑细胞坏死及程序性凋亡。亚低温可经降低机体及颅脑温度,抑制脑代谢,降低脑细胞的血糖、血氧需求,避免有害物质生成,减轻细胞、血管源性脑水肿,促进血脑屏障恢复,避免其发生病理性改变。亚低温可缓解氧化应激及炎性反应,抑制氧化应激因子及炎性因子过度生成,在保护受损脑组织的同时促进其修复。亚低温可干预电子传递酶链,保护线粒体功能,为脑细胞修复提供能量。亚低温可抑制释放内毒素、兴奋性氨基酸及氧自由基,促进合成神经细胞泛素,弱化脑细胞Ca2+超载,避免神经细胞凋亡,恢复神经信号传导。本研究治疗后,试验组ESS、ADL、GCS评分均大于对照组,说明亚低温应用于STBI可提高患者日常生活能力及神经功能。治疗7天后,试验组Qmean、Vmean均大于对照组,试验组颅内压、DR均小于对照组,说明STBI患者亚低温治疗可改善其脑部血流,降低颅内压,改善预后。
炎性反应是导致STBI患者继发性脑损伤的重要因素[12]。研究证明,炎性反应可激活模式识别受体,进而激活炎性信号通道,促进生成炎性因子及促炎因子,诱发炎性级联反应并最终导致继发性脑损伤,推动病情进展[13]。HMGB1为促炎因子,在脑组织中多分布于胞浆外,发生STBI后,HMGB1被大量释放,导致神经胶质细胞被激活,诱导并分泌促炎因子,引发炎性反应,炎性反应又可加重脑组织损伤,从而导致恶性循环,致使脑部HMGB1水平不断升高,并经血脑屏障进入外周血[14]。Copeptin为与精氨酸加压素(AVP)等量释放的同源多肽,AVP水平可准确反映HPA轴的激活程度,检测AVP可准确评价多种重症疾病严重程度及患者预后,但AVP在体外较不稳定,临床检测较为困难。而Copeptin在外周血中较为稳定且检测容易,故临床多经检测Copeptin以评价AVP水平[15]。Tau为神经细胞微管相关蛋白,可参与微管形成并维持其稳定。作为神经支架蛋白,Tau在神经细胞损伤后可被降解,致使血清或脑脊液中水平升高。检测STBI患者血清Tau水平,对于评价神经细胞损伤程度及治疗效果具有重要作用[16]。本研究治疗7天后,试验组Copeptin、HMGB1、Tau水平均低于对照组,说明STBI患者亚低温治疗可保护其脑组织,促进血脑屏障恢复,避免Copeptin、HMGB1、Tau大量生成,并进入外周血。此外,本研究中,试验组各并发症发病率均低于对照组,无残或轻残率高于对照组,说明亚低温辅治STBI有助于减少并发症,提高无残或轻残率。
总之,亚低温辅治STBI可降低颅内压,改善STBI脑部血流,保护脑组织,降低血清Copeptin、HMGB1、Tau水平,减少并发症,促进患者康复。

