植物叶绿素代谢途径及其分子调控
李 根,张 成,王 强,王 科,刘思汐,杨 勋,吴继开,卿秋静
(成都市农业技术推广总站,四川 成都 610041)
1 叶绿素代谢途径的研究进展
叶绿素(chlorophyll)是一类与植物光合作用有关的最重要的色素。高等植物叶绿素主要为叶绿素a和叶绿素b,两者的差异在于吡咯环Ⅱ的附加基团上,叶绿素a为甲基(-CH3),叶绿素b为甲醛基(-CHO)。结构的差异导致两者的颜色存在明显的差异,叶绿素a呈蓝绿色,叶绿素b呈黄緑色。叶绿素吸收大部分的红光和紫光但反射绿光,所以叶绿素呈现绿色,它在光合作用的光吸收中起核心作用。叶绿素分子核心部分为卟啉环(Porphyrin ring),具有光能吸收的功能;而侧链部分为较长的脂肪烃(叶绿醇,Phytol),是叶绿素插入到类囊体膜上的支点。
叶绿素的生物合成及降解途径较为复杂(如图1所示),合成途径包括15步酶促反应,其中涉及的酶由27个相关基因编码;降解途径分为两步,第一步在叶绿体中进行,有4种酶参与,叶绿素被降解为无色的、蓝色荧光中间产物pFCC,第二步是经过修饰的pFCC在液泡中发生非酶学异构最终形成非荧光叶绿素代谢产物NCCs。
降解途径的研究进程重要的转折点是1991年Kräutler等发现了大麦中非荧光叶绿素代谢物(Hv-NCC-1)。NCCs被解析之后,研究人员以脱镁叶绿酸a为底物,进行体外转化,相继鉴定了红色叶绿素代谢物(RCC)及其还原产物即初级荧光叶绿素代谢物(pFCC)。叶绿素降解过程早期发生在叶绿体中,但其代谢“终”产物非荧光叶绿素代谢产物(NCC)存储在液泡中。叶绿素b能在叶绿素b还原酶作用下还原生成叶绿素a。据截止目前的报道,Chl a在去镁离子去植基生成脱镁叶绿酸a(Pheide a)的过程中存在2条不同途径:一条途径是Chl a在叶绿素酶(CLH)和脱镁螯合酶(MCS)作用下脱去植基与镁离子,最后生成Pheide a;另一种途径则是以脱镁叶绿素为中间产物,在脱植基之前在MCS作用下先除去镁离子,生成的Phein a则在脱镁叶绿素酶(PPH)作用下除去植基,最后也生成Pheide a。然而,第一条降解途径早已受到质疑。有研究表明,拟南芥编码Chlase基因突变体仍能在衰老过程中降解叶绿素,表明了叶绿素酶并不是叶绿素早期代谢过程中必需的酶。PPH已被证实对Phein a有专一性,是真正负责叶绿素脱植基的水解酶。因此,认为叶绿素早期代谢过程以第2条代谢途径存在较为合理(如图1所示)。叶绿素脱植基脱镁离了后生成的Pheide a在脱镁叶绿酸a加氧酶(PA0)和红色叶绿素代谢产物还原酶(RCCR)作用下,最后生成初生荧光叶绿素代谢产物(pFCC),其中间产物为红色叶绿素代谢产物(RCC)。
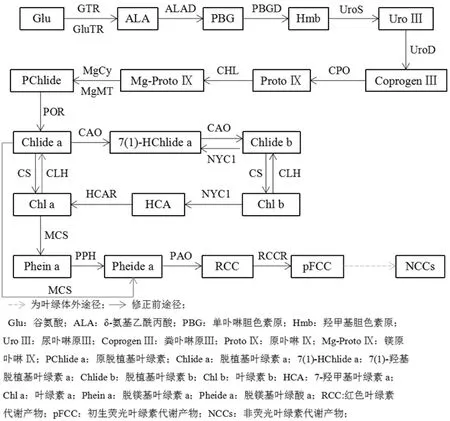
图1 高等植物叶绿素代谢途径
2 叶绿素合成及降解途径关键酶
在叶绿素代谢途经中,近年来随着物质代谢分析手段、生物信息学等的发展进步,新的观点不断涌现,从单纯的代谢途径,逐步深入到调控机制。其中报道较多的关键酶包括7种。
2.1 叶绿素合成途径关键酶及其调控
2.1.1 原脱植基叶绿素还原酶(POR) 原脱植基叶绿素在光照和NADPH存在下,由NADPH原脱植基叶绿素还原酶(POR)催化形成脱植基叶绿素a是叶绿素生物合成途径和叶绿体发育过程最关键的需光过程。在生物体中,催化原脱植基叶绿素还原形成脱植基叶绿素a的酶可分为2种:不依赖光的NADPH原脱植基叶绿素还原酶(DPOR)和依赖光的NADPH原脱植基叶绿素还原酶(POR)。无氧光合细菌只有DPOR酶,光合细菌、蓝细菌、藻类和裸子植物具有两种POR酶,而被子植物只有POR酶。因此,无论黑暗或光照条件,光合细菌、蓝细菌、藻类和裸子植物都能合成chl;而被子植物幼苗在黑暗条件下则会发育形成黄化苗。
目前,已经从大麦、拟南芥等植物中分离到3种POR基因:PROA、PORB、PORC。PORA和PORB普遍存在,在黄化幼苗中形成。同时CAOPORACAO作为植物黄化幼苗质体中的主要蛋白酶,是光诱导叶绿体发育起始时期唯一具有活性的POR。与PORA不同的是,PORBCAOmRNA则是随着光照时间的延长,其含量也逐渐升高。PORC是最后一个被鉴定出的POR基因,它主要在植物迅速积累chl时期到质体发育成熟的过程中起着重要作用。在黄化幼苗中,其mRNA水平很难检测到,但是在光照之后却有显著的增加。
2.1.2 脱植基叶绿素a加氧酶(CAO) 脱植基叶绿素a加氧酶(CAO)作为一种Rieske型单加氧酶,能专一识别脱植基叶绿素a,通过两步氧化反应将其C7侧链上的甲基(-CH3)氧化成甲酰基(-CHO),形成脱植基叶绿素b。然后脱植基叶绿素b由叶绿素合酶(CS)催化在D环加上一个植醇尾巴,形成叶绿素b。因此,CAO在叶绿素b的生物合成过程具有极其重要的作用。CAO基因编码脱植基叶绿素a加氧酶,最早从莱茵衣藻中分离出来。随后在藻类、拟南芥和水稻中也相继得到了分离和鉴定。此外,高等植物CAO的氨基酸序列一般含有4个功能结构域,从N末端开始依次为导肤序列、A domain、B domain和C domain,而原核生物并没有A domain和B domain。C domain包含一个Rieske簇和一个铁结合基元,该结构域具有催化活性,能催化脱植基叶绿素a转化为脱植基叶绿素b。将缺失A domain的CAO基因转入拟南芥后,转基因植株中的CAO蛋白含量显著下降,同时叶片中叶绿素a/b的比值也减小;相似地,使仅含有C domain的藻类CAO基因在拟南芥中过表达后,叶绿素a/b的比值也显著减小。由此说明,A domain参与调节CAO蛋白的表达。然而这种调节机制并不存在于叶绿素b合成缺陷突变体中,其CAO蛋白的表达水平受叶绿素b含量的调节。目前关于domain B的生物学功能仍是不太清楚,仅从B domain中鉴定出了一个基元结构-PEST motif,从结构上看其属于亲水性氨基酸序列。它的功能主要是充当A domain和C domain的链接者,起到稳定CAO蛋白的作用,并不能参与调节CAO蛋白的表达。
2.1.3 镁离子螯合酶(CHL) 镁原卟啉IX合成始于原卟啉IX,随后经多步酶促反应最终形成叶绿素。催化该途径的酶是镁离子螯合酶(CHL)。镁离子螯合酶是一个ATP依赖的异源聚合酶,由I、D和H3个亚基组成。研究者们利用镁离子螯合酶3个亚基的重组蛋白进一步研究发现,镁离子螯合酶激活步骤需要I亚基、D亚基、ATP以及镁离子的共同参与;而在镁离子螯合步骤中,H亚基被认为是镁离子螯合酶的催化亚基,能结合底物原卟啉IX,结合了底物原卟啉IX的H亚基与ATP-I-D-Mg2+复合物结合后,D亚基发生变构,I亚基的ATP酶活性被激活从而水解ATP为镁离子螯合提供能量;此时,形成的镁离子螯合酶全酶将镁离子螯合到原卟啉IX中形成镁原卟啉IX,完成整个催化过程。目前研究表明,参与调控镁离子螯合酶活性的因素包括光照和昼夜节律、叶绿体氧化还原状态及镁离子螯合酶各亚基之间的相互作用等(图2)[1]。

图2 植物镁离子鳌合酶活性调控及参与的信号通路[1]
光照和昼夜节律能调控镁离子螯合酶各亚基CHLI、CHLD和CHLH基因表达。在去白化过程中,高等植物镁离子螯合酶各亚基受光照诱导后表达量明显上调。此外,昼夜节律对植物镁离子螯合酶各亚基的表达具有调控作用,且呈现不同的调控模式。在去白化过程中,光照是镁离子螯合酶基因表达的重要调控因素;而昼夜节律同样是镁离子螯合酶基因转录的调节因素。这暗示着镁离子螯合酶基因转录水平上的调控是镁离子螯合酶活性调控的关键点。在黑暗下,叶绿体中处于氧化状态,TRX-F和TRX-M等叶绿体氧化还原调控蛋白氧化镁离子螯合酶,镁离子螯合酶失去催化活性。在光照下,叶绿体中处于还原状态,I亚基半胱氨酸巯基被叶绿体氧化还原调控蛋白还原,镁离子螯合酶恢复活性,催化叶绿素合成。
2.2 叶绿素降解途径关键酶及其调控
2.2.1 叶绿素酶(CLH) 叶绿素酶(CLH)是叶绿素分解代谢第一条途径的起始酶,Harpaz-Saad等[2]对柑橘(Citrussinensis)CLH的异源表达研究表明,CLH是一个叶绿素分解代谢的限速酶。细胞通过剪切多肽 N端与Glu脱羧酶结合的调控结构域,或者负责膜结合的结构域而进行转录后调控。目前,通过体外研究已经对叶绿素酶的催化特性,如动力学参数、pH值与温度的影响等有了比较详细地了解。叶绿素酶的测活体系与一般的酶有所不同。在有机溶剂或去垢剂存在时,叶绿素酶在室温时即可表现活性,而在以水为微环境的反应体系中,其表现活性的温度较高(65~75℃ )。叶绿素酶在微碱性(pH值7.5~8.0)环境中催化活性高,橄榄的叶绿素酶的最适pH值是8.5,而柑橘叶片叶绿素酶的最适pH 为7.8。尽管有学者指出CLH在叶绿素降解过程中无足轻重[3],但是仍有不少研究证明CLH在叶绿素降解过程中起到了毋庸置疑的作用。与叶绿素酶生理研究相比,在分子水平上研究叶绿素酶还比较少,在叶绿素酶基因克隆或转录水平的表达的研究不多,在叶绿素酶的研究中还存在着许多棘手问题。
2.2.2 脱镁鳌合酶(MCS) 脱镁鳌合酶(MCS)催化叶绿素a脱去鳌合的镁原子形成脱镁基叶绿素a。迄今为止,该酶是唯一发现具有催化叶绿素a转化为脱镁基叶绿素a功能的酶。通过比较衰老与未衰老叶绿体中的活性,发现此酶与叶绿素酶一样,也属于组成性表达的酶,但与叶绿素酶不同的是,在衰老叶片中保持MCS的活性需要不断地有新的蛋白质合成。脱镁鳌合酶(MCS)具有热稳定性,且在不同植物中分子量较低且不一致。Shioi等[4]从藜叶片中发现了一种耐热的、具有MCS活性的小分子物质。Matile等[5]认为,此种小分子物质可能就是MCS的辅基。值得一提的是,催化反应的产物脱镁基叶绿酸a是一种可见光的敏感物质,此物质可以在无氧条件下对质粒进行光裂解。
2.2.3 脱镁叶绿素酶(PPH) 脱镁叶绿素酶(PPH)是叶绿素降解代谢的关键酶,在叶绿素降解过程中PPH是卟啉—植醇水解过程参与的候选酶,对脱镁叶绿素很活跃,但对叶绿素却没有作用。PPH酶的作用是将脱镁叶绿素a转换为脱镁叶绿酸a。在叶片衰老过程中PPH基因的表达加强,加快脱镁叶绿素a转换为脱镁叶绿酸a,加速叶片衰老。PPH酶的缺失能够造成植物滞绿表现型,是一种非功能的滞绿,叶绿素代谢在一定程度上受损,叶绿素缓慢降解,叶片保绿时问较长,衰老被延迟。
2.2.4 脱镁叶绿酸a加氧酶(PAO)SID基因是编码PAO(脱镁叶绿酸a加氧酶)的基因,负责控制叶绿素大卟啉环的降解,而该基因具有加速细胞死亡的功能。PAO能将脱镁基叶绿酸a(Pheide a)降解为不稳定的红色叶绿素代谢产物(RCC)后最终形成无色的初生荧光叶绿素代谢产物(pFCC),是叶绿素降解途径中脱绿代谢的关键步骤。PAO酶作用于叶绿素降解的方式较灵活,如持绿蛋白SGR可通过影响PAO酶的活性使植物表现为滞绿或黄化。PAO编码基因缺失会产生滞绿突变体,而PAO基因的表达与衰老密切相关。在植株衰老和伤害时PAO基因表达水平上调,在叶片衰老后期,PAO活性达到最高;在衰老的叶片中,抑制PAO的活性,将导致脱镁叶绿酸a的积累和叶绿素降解的抑制;在滞绿突变体的叶片衰老过程中PAO活性非常低。因此通常认为编码该酶的基因突变是滞绿突变体保持绿色的原因之一。
SGR/SGRL基因的鉴别是近年来叶绿素降解调控研究中的一个里程碑。高等植物的滞绿基因SGR家族主要存在2种进化分支,包括SGR亚家族和SGRL亚家族。2个亚家族的成员在单子叶及双子叶植物中均存在,但在双子叶植物和单子叶植物类群中,SGR/SGRL亚家族所包括的同源基因数目不同。双子叶植物拟南芥中已发现3个SGR同源基因, 分别为SGR1(At4g22920)、SGR2(At4g11910)和SGRL(At1g44000)。滞绿基因SGR的功能与叶绿素降解调控有关,它可能通过激发NYC、PPH 、PAO、RCCR等多个叶绿素降解酶与捕光复合物II(LHCII)相互作用,形成SGR-CCE-LH-CII复合体,促使叶绿素分子从LHCII上解离,并构成一个有助于叶绿素快速降解的“代谢通道”。SGR1和SGR2还可以形成同源或异源二聚体,SGRL也可以与SGR1、SGR2形成同源或异源二聚体,这种二聚体结构可能在一定程度上能够调节SGRL基因的活性。SGR2基因在叶绿素降解过程中与SGR1起拮抗作用,可能是SGR1和SGR2形成异源二聚体时, 削弱了SGR1与CCEs互作的能力。SGR基因在拟南芥叶片衰老中的功能如图3所示。
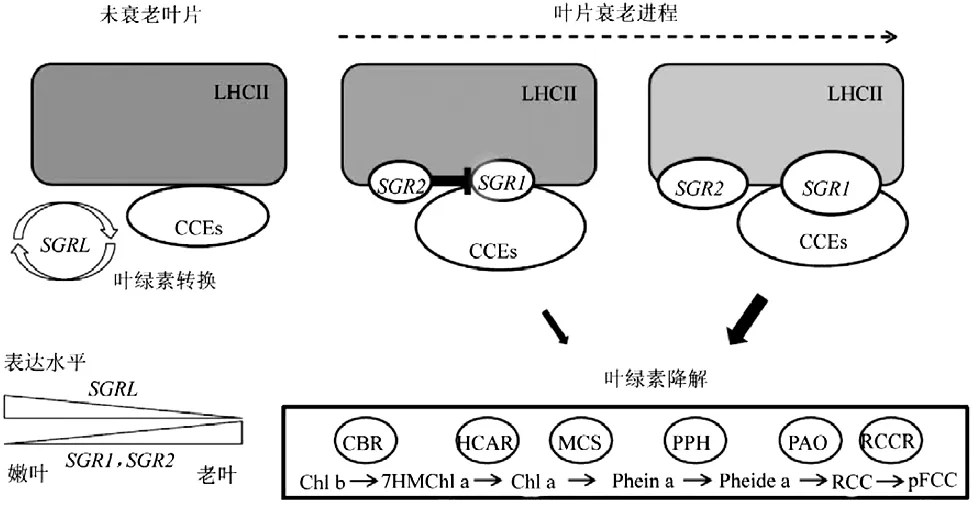
图3 SGR基因在拟南芥叶片衰老中的功能
除了持绿蛋白SGR,一些激活因子(如ATAF1)同样可以上调PAO的表达来调节叶绿素的降解。Ghandchi等[6]通过对几组拟南芥基因组和生物信息学实验进行重新分析发现植物ATAF1等转录因子在温暖条件、叶片衰老、干旱等条件胁迫下会因触发植物应对这些逆境的响应进而通过上调PAO表达调控叶绿素降解。这些转录因子形成一个调控网络,共同行使其调控功能,影响植物叶绿素的降解(如图4所示)。
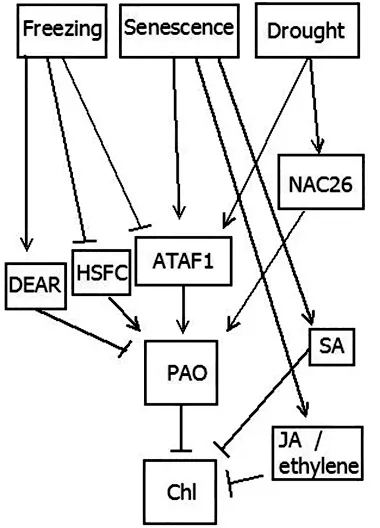
图4 叶绿素降解调控关系
3 叶绿素代谢途径关键基因
叶绿素代谢途径关键酶及其编码基因详见表1。

表1 叶绿素代谢关键酶及其编码基因
4 展望
目前,叶绿素生物合成及降解途径已较为清晰,其中关键酶及编码基因已有许多报道,但仍然存在许多问题仍未解决,比如有研究首次发现在成熟香蕉皮中检测到被高度修饰的荧光叶绿素代谢物( hFCCs)[7],紧接着在香蕉叶和白鹤芋叶中也发现了hFCCs[8],这就意味着在pFCC之后可能存在其他中间产物,或者在pFCC之后叶绿素降解途径可能开始有了新的分支,那么,就植物体在不同条件下的叶绿素代谢而言,是否伴随有其他途径,有待进一步证实;其次,涉及基因的功能和作用机理也尚未完全清晰,近年来涉及叶绿素代谢关键基因的研究主要集中在一些突变体中,对于功能验证方面报道较少;最后,对于叶绿素降解调控的研究,多集中于SGR和LHCP II-叶绿素复合体,有关调控的分子信号,降解产物与关键酶之间的相互作用等尚不清楚,值得深入探究。

