膜解剖在直肠癌手术中的应用
闫治波 戴勇
Heald等[1]提出的全直肠系膜切除术(total mesorectal excision,TME)显著降低了中低位直肠癌的局部复发率,毫无悬念的成为中低位直肠癌手术治疗的基本方法。30年来,随着腹腔镜技术、3D腹腔镜,特别是达芬奇机器人在结直肠外科的应用,以及各种手术器械、切割止血平台的发展,提供了干净、无血、高度清晰且放大的手术视野,让手术者更加清楚地观察到腹盆腔筋膜的解剖层次与结构,结合尸体解剖和术中的观察,逐步提出了膜解剖的概念与相关的手术操作技巧,再将视野拓展到从胚胎发育角度认识膜的形成、演变及与周边组织器官存在的间隙或层面,逐步建立了系统的膜解剖理论模型。
一、膜解剖理论体系
当前,膜解剖理论模型存在不同的理论体系,比较著名的有日本篠原尚等[2]和Mike[3]的筋膜解剖(interfascial anatomy)理论,爱尔兰Coffey等[4]提出的系膜解剖(mesenteric anatomy)理论,以及我国龚建平[5]和池畔等[6]支持的膜解剖(membrane anatomy)理论。
篠原尚在1994年从系膜胚胎学起源的角度对传统外科术式进行了解读,主要包括腹膜与筋膜的概念、胚胎发育中的胃旋转及肠旋转、Gerota筋膜与Toldt筋膜的形成等理论;Mike[3]在2012年从结直肠癌临床手术实践方面强调了基于筋膜解剖的技巧。2017年Coffey等[4]通过发表在《胃肠病学和肝病学》一篇评述中,提出系膜解剖理论核心观点:肠系膜、Tolt筋膜及腹膜反折是连续的,而结直肠手术的核心是腹膜反折切开和系膜筋膜平面的分离。2015年龚建平[5]提出的膜解剖理论,以及池畔等[6]建立的膜解剖理论体系,借鉴了国外的相关经验,也通过临床手术、尸体解剖等手段提出了新的观点,如“第五转移、第三根治、系膜床、膜桥”等一系列学说也引起学术界的讨论。孙凌宇等[7]认为,各个膜解剖理论从不同角度阐释膜的结构和功能,互为补充,我们应以“兼收并蓄”态度对待它们,求同存异,从宏观手术指导思想与微观解剖方面高质量的完成手术。
膜解剖的精准应用可以显著提高TME标本的优良率,保证直肠系膜的完整性,降低术中出血、做到微出血甚至零出血,且自主神经保护良好,降低术后性功能障碍、排尿困难的发生率[8-10]。同时我们应该认识到,膜解剖根本目的不仅仅是为了追求手术的微出血或者零出血,还因所谓的“膜”可以通过组织屏障局限肿瘤细胞的转移播散,错误的膜解剖手术会导致肿瘤细胞的“第五转移”,也就是“癌泄露”。防止癌泄露,提高手术彻底根治性、改善预后,是膜解剖手术的根本追求之一[11]。
龚建平[5]在2015年提出的外科膜解剖概念强调“广义的系膜与系膜床的解剖”,而“广义的系膜”是指筋膜和浆膜,信封样包绕着器官及其血管,悬挂于体后壁,无论其形状如何、无论其游离与否。简言之就是器官、血管及重要的泌尿生殖神经被膜的封套所包裹。针对于直肠系膜就是指结肠系膜中腹膜和腹膜下筋膜呈Ω形由两个侧方及后方包裹直肠,而肾前筋膜则向下拓展为骶前筋膜和盆壁筋膜。
以膜解剖指导手术首先应该认识到,广义的系膜与系膜床之间可以有4层膜和5个层面,而且膜的融合具有5层夹心结构,即脂肪、腹膜下筋膜、融合筋膜、腹膜下筋膜和脂肪,这其中是以融合筋膜为中心的。而寻找正确的膜间隙,往往需要遵循两个理论:第一个指两膜相对(bi-junction),左腹膜后间隙是由前方的上段直肠固有筋膜及后方肾前筋膜向左拓展而形成,直肠后间隙及腹膜反折以下的直肠周围间隙是由前方的中下段直肠系膜与后方自肾前筋膜延续过来的骶前筋膜组成,而自主神经系统分别被肾前筋膜及骶前筋膜所覆盖;国内韩方海等人提出“隔膜见管”的概念,也就是泌尿生殖浅筋膜后方可显现输尿管及生殖血管(图1)。要进入两片膜之间的间隙,需要利用助手合理的牵拉,显露腹腔内的天然褶皱,比如直肠旁沟、腹膜反折等处打开另一层膜,也就是“膜桥”,而膜桥则指被腹膜覆盖的两片膜的开口处,也就是第二个理论“三三相交(tri-junction)”,打开膜桥,利用超声刀的切割及空洞化效应,进入膜间隙,则实现了结直肠外科手术的膜解剖的手术(图2)。

图1 左腹膜后间隙
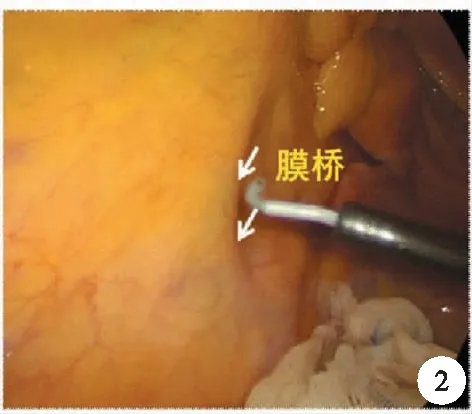
图2 膜桥的打开处
二、膜解剖指导下的直肠游离
在中低位直肠癌的手术过程中,我们一般遵循骶骨岬直肠旁沟处切开膜桥,先行中央入路,进入后方间隙、前方间隙,然后侧方间隙入路习惯。
1.直肠后方游离与膜解剖的关系:实际上,直肠后方的游离是以S4前方为界,此处分为上方的直肠后间隙及下方的肛提肌上间隙,直肠后间隙是指直肠系膜固有筋膜与腹下神经前筋膜(骶前筋膜的前叶)之间的间隙(图3),其与肛提肌上间隙的界限在直肠骶骨筋膜,也就是Waldeyer筋膜,是由盆壁筋膜脏壁层在骶骨前增厚而形成,Waldeyer筋膜起到固定直肠和进一步隔绝腹腔的作用,术中离断直肠骶骨筋膜后别有洞天,可再次进入银发丝状的结构,也称为神圣平面(holy plane),此处的直肠被融合的直肠固有筋膜及骶前筋膜前叶所覆盖,其后方为骶前筋膜后叶(图4)。其中疏松的结缔组织也就是所谓的融合筋膜,而融合筋膜有种表现形式,除了无血管的结缔组织外,还有如Toldt筋膜样的融合筋膜。
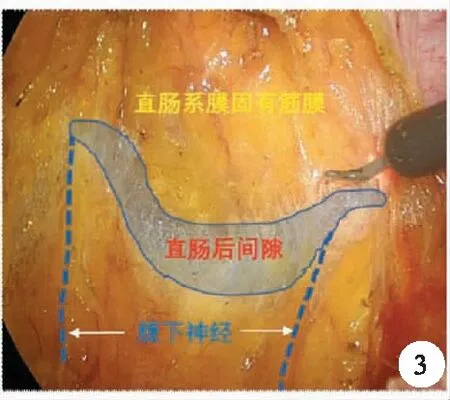
图3 直肠后间隙
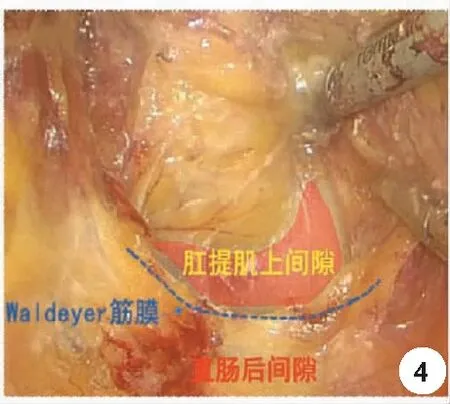
图4 肛提肌上间隙
2.直肠前方游离:直肠前方的游离关键在于对邓氏筋膜(Denonvilliers筋膜)的膜解剖及分层的认识,而随着组织学及解剖学的进展,邓氏筋膜的认识也越来越复杂。1836年,Charles Denonvilliers首先描述了邓氏筋膜,邓氏筋膜组织结构属于纤维层,男性中可以将直肠和膀胱与精囊分开,在女性中可将直肠和宫颈与阴道分开。因此,又称为直肠生殖隔,可以将直肠前方间隙分为后方的直肠前间隙(邓氏筋膜后间隙)前方的前列腺后间隙(邓氏筋膜前间隙),直肠前间隙比前列腺后间隙大,其中结缔组织也更疏松,前列腺后间隙中分布血管和进入前列腺的神经支,不易游离,邓氏筋膜在女性中比较菲薄,且出现率只有20%~30%[12]。因此,本文主要指男性中邓氏筋膜的膜解剖关系。
有人认为,邓氏筋膜很有可能是腹膜融合和间充质细胞受压之后共同形成的[13]。虽然缺乏解剖学及术中证据,但在组织学染色邓氏筋膜属于多层结构。也有人认为邓氏筋膜解剖学上应属于多层结构[14],比如国内池畔等[6]认为,其包括邓氏筋膜前叶及邓氏筋膜后叶,而实际上后叶也就是直肠固有筋膜,这是符合解剖学认知的。
主流的手术入路仍沿用池畔等的方法,在腹膜反折上1.0 cm处切开腹膜,进入前列腺后间隙,分离邓氏筋膜与精囊腺之间的空间,然后在距离接近完全暴露精囊腺处切断邓氏筋膜,进入直肠前间隙,如此可以保证TME的要求,又很好地保护该区域邓氏筋膜前叶前外侧的血管神经束(图5、图6)。
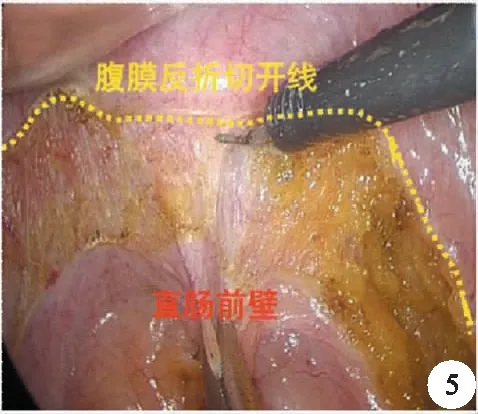
图5 腹膜反折的切开线
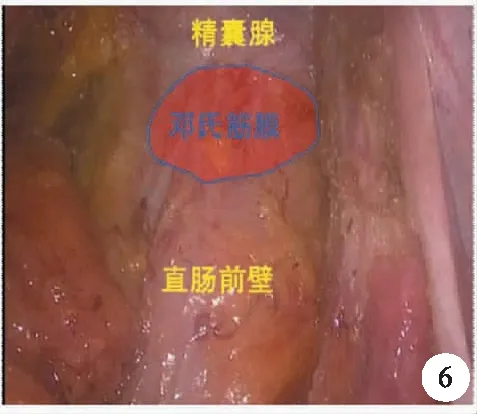
图6 直肠前壁的游离
然而,卫洪波等认为,邓氏筋膜前间隙狭小与前列腺融合,且存在前列腺神经支及血管走行,术中切开邓氏筋膜与精囊腺的附着点,很容易导致出血及造成神经损伤,既然邓氏筋膜后方与直肠之间存在疏松的网状结构,手术更应从邓氏筋膜后叶与前叶之间进行,其通过生理学及组织学研究确认,邓氏筋膜与盆腔的植物神经功能密切相关[15]。我们认为,对于前壁或者局部分期较晚的肿瘤,累及邓氏筋膜或者侵及直肠固有筋膜,术前放化疗导致局部组织水肿、瘢痕,间隙不清,为根治性目的,切除邓氏筋膜是必须的。肿瘤与直肠前壁及邓氏筋膜无明显关系时,尽量保留邓氏筋膜,更好地保护精囊腺、前列腺及其内走行的血管神经束。
3.直肠侧方游离:相对于直肠前后方游离,侧方游离属于直肠癌手术的难点,在充分游离前后间隙后,发现直肠侧方缺乏明显的间隙,且致密难以分离,这是因为直肠侧韧带的存在,直肠侧韧带有来自盆丛神经的直肠支可以穿过骶前筋膜及相邻的直肠固有筋膜,其内也可能有直肠中动脉的存在。直肠侧韧带像一座桥一样将直肠前后方两个独立的间隙连接起来,术中可以发现这属于相对粗糙的脂肪样组织,因其内包含血管、神经组织,有学者认为以“直肠侧蒂”来称呼更为合适(图7)[13]。操作中注意保持一定的张力,紧贴直肠固有筋膜进行游离,避免盆丛的损伤,因其内走行的直肠中动脉多为分支走行,直径较细,可以用超声刀直接凝闭。
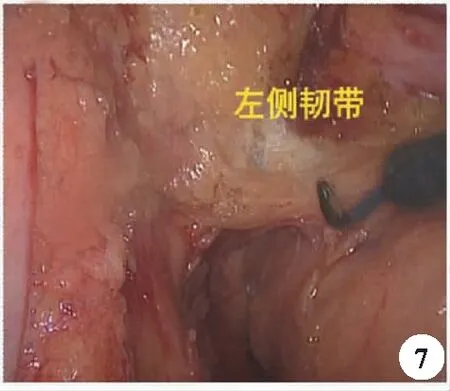
图7 直肠左侧韧带
4.直肠末端游离:遵循后-前-侧方的顺序进行游离至盆底后,此处到达后壁的解剖标志为Hiatal韧带,离断Hiatal韧带则到达肛提肌裂孔边缘,肛提肌裂孔被直肠固有筋膜、肛提肌表面筋膜及前方的Denonvilliers筋膜融合所封闭。此处是直肠系膜及直肠固有筋膜的消失之处,也就是TME的终点线,为保证切缘可能需要继续游离肛提肌裂孔(图8)。
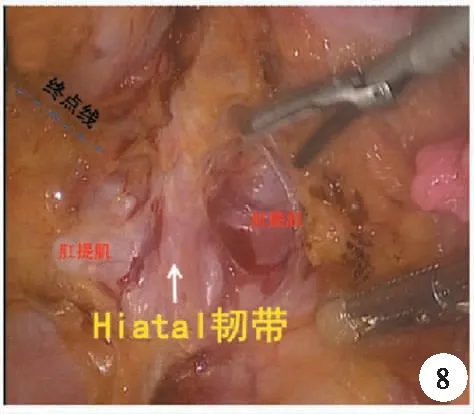
图8 Hiatal韧带
三、总结
膜解剖在直肠癌手术中应用意义巨大,在直肠癌手术中要始终牢记筋膜的解剖及盆腔自主神经束的保护。目前,存在直肠膜解剖的理论虽然尚未统一,我们应兼容并蓄的态度去应用,只要术中坚持膜解剖的核心理念及原则不变,注意保持足够的操作张力,合理应用操作器械及技巧,就能从一台复杂枯燥的手术中解脱,从膜间隙中寻找并感受精准手术带来的快乐,并能避免血管神经的副损伤的发生,实现无血手术,最终变成一种具有艺术性的操作流程,也防止了癌泄露。

