基于网络药理学与分子对接技术预测艾叶抗动脉粥样硬化的分子机制
何树苗,陈元堃,曾 奥,贺思晴,李春梅,林树真,卢 群*
(1.广东药科大学 生命科学与生物制药学院,广东 广州 510006;2.广东金妮宝科技发展有限公司,广东 广州 511475)
动脉粥样硬化(Atherosclerosis,AS)是一种脂质驱动的动脉内膜炎症性疾病,其促炎和消炎机制的平衡决定了最终的临床结果。目前,AS形成机制学说众多,但炎症始终贯穿疾病发生、发展并决定其最终转归[1],AS抗炎治疗可限制动物模型斑块进展[2],有效改善患者预后[3]。
艾叶是菊科植物艾草的干燥叶,在临床上的应用范围极广。中医认为,艾叶性温,味辛、苦,归肝经、脾经和肾经,具有散寒止痛、温经止血、镇咳平喘、杀虫止痒及安胎的作用[4]。现代药理学研究结果显示,艾叶还具有抗炎和调节心血管系统功能的作用[5],但在古方中未有体现。已有研究发现,艾叶能降低IL-6、ILlβ、TNF-α炎症因子的表达和分泌以及巨噬细胞NO的释放量[6],抑制炎症反应和改善氧化应激;艾叶多酚通过抑制NO的产生、诱导型一氧化氮合酶的合成、炎症因子表达以及丝裂原活化蛋白激酶的磷酸化来抑制巨噬细胞的活化[7];艾叶挥发油以及提取物对小鼠[8]、斑马鱼[9]的炎症均有明显抑制作用,提示艾叶可能具有抗AS的疗效,而其具体作用成分和机制尚未完全明确。因此,本研究利用网络药理学和分子对接的方法探讨艾叶抗动脉粥样硬化的活性成分及其作用机制,为下一步的药理研究提供基础。研究思路流程见图1。
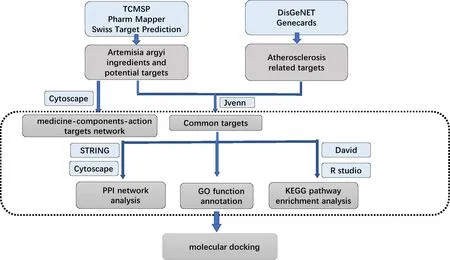
图1 研究思路流程图Figure 1 Flow chart of research
1 材料与方法
1.1 艾叶化学成分及其靶点挖掘与归属
中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com/tcmsp.php,Version 2.3)是一个针对中草药系统药理学的研究平台,整合了多种中草药及其组成成分、成分结构、靶标与疾病间的关系等数据[10]。本研究从中药系统药理学数据库TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)查找艾叶化学成分,根据口服生物利用度(oral bioavailability,OB)和类药性(drug like index,DL)筛选出符合条件的活性成分及其对应靶点,将OB ≥30%和DL ≥0.18设为筛选条件,获取艾叶的活性成分用于后续研究[11]。Swiss Target Predication 平台(http://www.swisstargetprediction.ch/)是常用的预测中药成分或者小分子化合物潜在靶点的数据库,能基于所提交的2D化合物或者3D结构与已知的配体组合,从而预测中药成分或小分子化合物的生物活性靶点[12]。本研究由Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)获取各有效成分的2D 化学结构式,保存为SDF 格式文件,导入Swiss Target Predication预测靶点,以“probability >0.1”为筛选条件,最终得到艾叶化学成分的潜在靶点。
1.2 疾病靶点预测
Genecards数据库(https://www.genecards.org/)涵盖了多个数据库的基因信息数据,可以实现靶点-疾病交互信息匹配,获取大量的靶点信息。本研究利用Genecards 数据库查询动脉粥样硬化相关靶点信息,选取Relevance score >20 的靶点。DisGeNET 数据库(http://www.disgenet.org/web/DisGeNET/menu,Version 5.0)是包含与人类疾病相关的基因和变体的重要数据平台之一[13]。本研究在DisGeNET 数据库内以“atherosclerosis”为关键词,设定物种为人、Scores >0.3,获取疾病靶点。为保证靶点的可靠性,将两个数据库所得靶点取交集,最终得到疾病的潜在靶点。
1.3 中药化学成分-作用靶点网络构建
将中药、有效化学成分及其对应的作用靶点信息与相互关系导入Cytoscape(v3.7.1),构建中药化学成分-作用靶点网络。
1.4 蛋白互作网络构建和关键靶点筛选
Jvenn(http://jvenn.toulouse.inra.fr/)是一个高效灵活、可实现在线合成Veen 图的工具。本研究将获取的成分靶点与疾病靶点导入以汇集两者的共同靶点,确定艾叶作用于动脉粥样硬化的可能靶点。STRING 数据库(https://string-db.org/,Version 10.5)是一种包含已知和预测的蛋白质-蛋白质相互作用的数据库,收集了大量的蛋白相互作用数据。本研究将上述步骤筛选出的共同靶点导入STRING平台以确定其网络互作关系,应用Cytoscape构建靶点-蛋白互作网络,并应用MCODE插件分析核心基因。
1.5 通路富集分析
生物学信息注释数据库(DAVID,https://david.ncifcrf.gov/,Version6.8)能为大量的基因或蛋白提供系统、综合的生物功能注释信息,并找出最显著富集的生物学注释。本研究将筛选出来的共同靶点导入DAVID数据库,结合R studio 进行艾叶对动脉粥样硬化的潜在作用靶点的GO功能注释和KEGG 通路富集分析,设定阈值P<0.05,按照涉及的靶点数目多少进行排序,筛选排名靠前的生物过程或通路做气泡图,最后结合KEGG数据库绘制关键通路机制图。
1.6 主要活性成分与核心靶点的分子对接验证
本研究通过分析蛋白互作网络,筛选出AS与艾叶共有且度值最高的两个靶蛋白分别与药物中与之作用的同样度值最高的两个活性成分进行分子对接验证。应用ChemOffice软件构建活性成分的3D结构,保存为*mol2 格式,使其能量最小化。由PDB 数据(https://www.rcsb.org/)获取关键蛋白的*PDB 格式3D 结构,运用Discovery Studio 4.5软件对蛋白质进行去水、加氢等操作,利用AutoDock 软件将活性成分及靶蛋白转换为*pdbqt格式,最后运行Vina进行对接。如果结合能小于0 kJ/mol,说明配体与受体可以自发结合。
2 结果与分析
2.1 艾叶化学成分及其潜在靶点
本研究基于TCMSP数据库及文献获得艾叶有效化学成分,并以口服利用度及类药性指数从中筛选得到9个成分,详见表1。将由Pubchem 数据库获取的各有效成分化学结构导入Swiss Target Predication平台预测靶点,以“probability >0.1”为筛选条件,汇总去重,共得到274个艾叶化学成分的潜在靶点。

表1 主要的艾叶有效化学成分Table 1 Effective chemical constituents from Folium Artemisia argyi
2.2 中药化学成分-作用靶点网络
将2.1 所得的艾叶化学成分及靶点关系导入Cytoscape 构建中药化学成分-作用靶点网络,结果见图2。其中,(2R)-5,7-二羟基-2-(4-羟基苯基)苯并吡喃-4-酮、油酸乙酯、β-谷甾醇、豆甾醇和槲皮素作用靶点较多。

图2 中药-成分-作用靶点网络Figure 2 Network of herbal medicine-components-action targets
2.3 艾叶抗AS靶点获取及PPI 蛋白互作网络构建分析
通过Jveen取成分靶点与疾病靶点的交集,得到艾叶作用于动脉粥样硬化的120个可能靶点。将筛选出的共同靶点导入STRING 平台,设置相互作用阈值>0.9,确定其网络互作关系,结果见图3。网络包含120个节点,259条边。节点表示艾叶抗AS的潜在作用靶点,边表示潜在作用靶点间的相互作用关系,代表蛋白质之间的结合关系,即共同促进某生物功能进行,不同颜色的边表示不同的作用方式。将数据导入Cytoscape中进行可视化分析,并应用MCODE插件分析核心基因,关键蛋白互作网络如图4所示。根据度值将节点分为不同的大小,节点越大表明其度值越高。颜色表示结合分数的高低,由红色至黄色再至蓝色,靶点的结合分数逐渐升高。
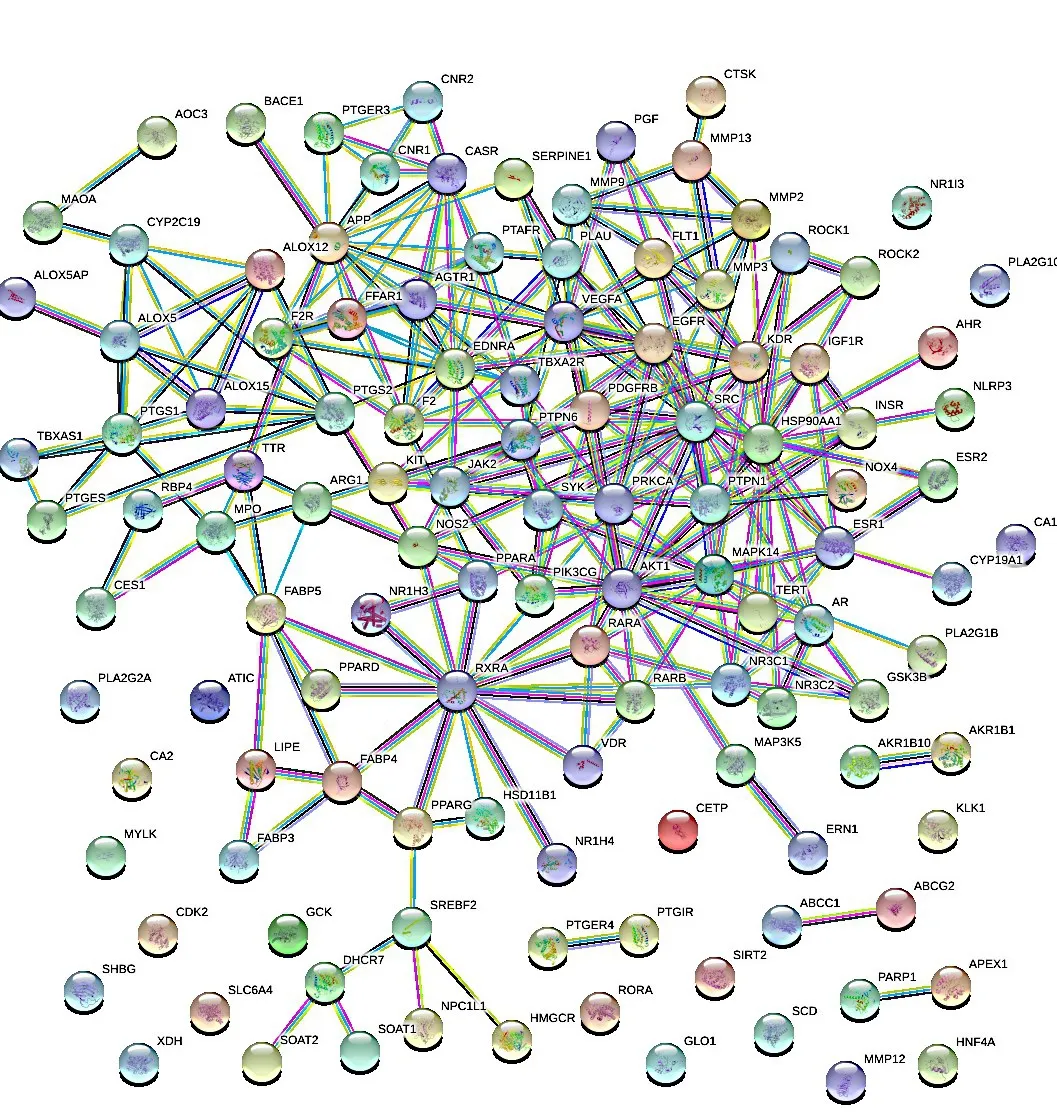
图3 共同靶点蛋白互作信息Figure 3 Interaction information of common target protein
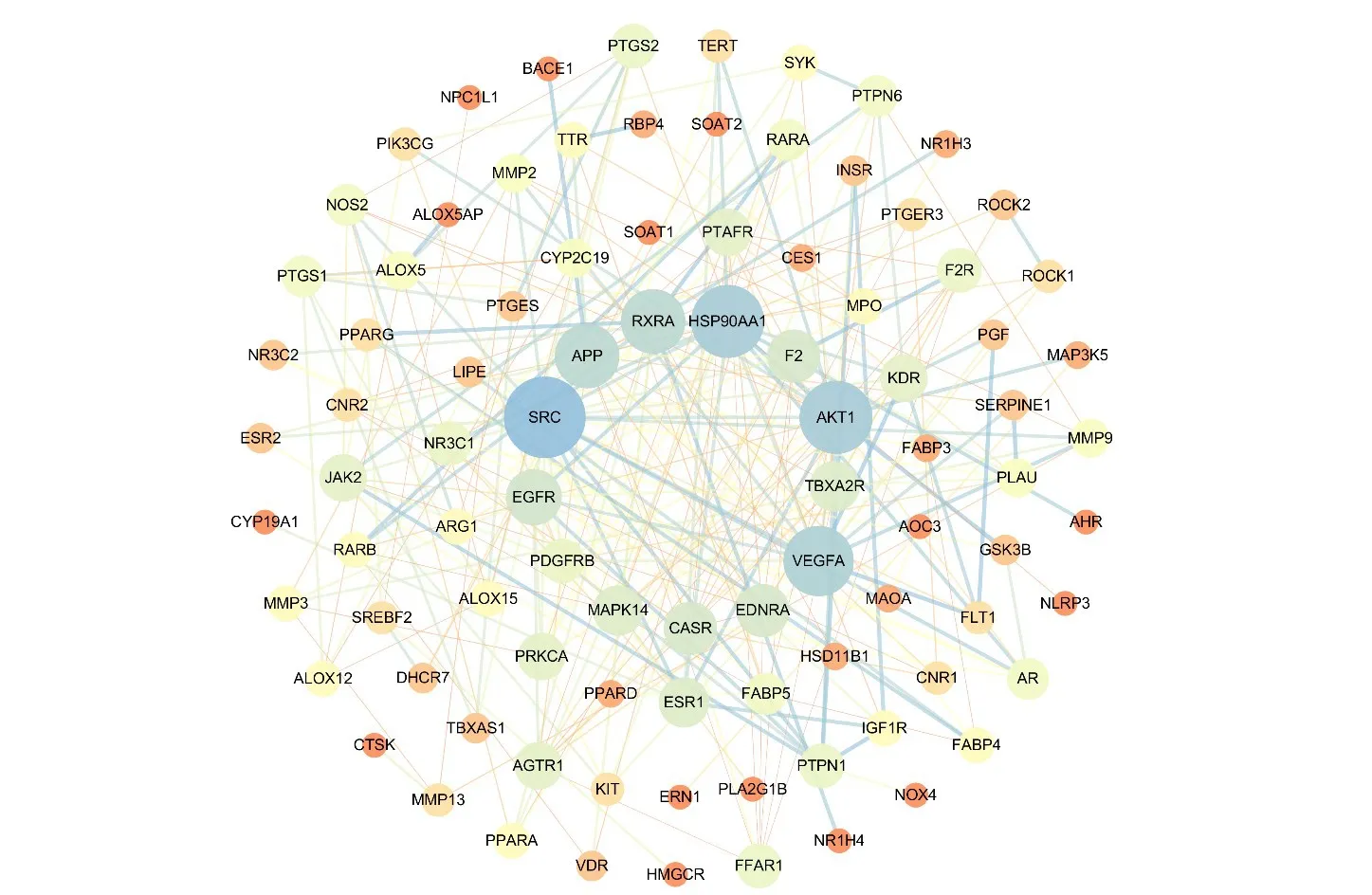
图4 关键共同靶点蛋白互作网络Figure 4 Interaction network of common target protein
2.4 GO功能注释和KEGG通路富集分析
利用DAVID 数据库对艾叶抗动脉粥样硬化作用靶点进行GO 功能注释和KEGG 通路分析,设定阈值P<0.05,筛选排名靠前的生物过程和信号通路。利用R studio构建高级气泡图,并在KEGG数据库中对关键通路进行分析,结果见图5和图6。
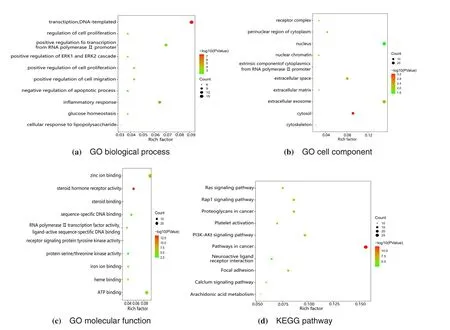
图5 差异表达基因富集分析Figure 5 Enrichment analysis of DEGs
经计算,排名前5位的关键靶点分别为原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase Src,SRC)、RAC-α 丝氨酸/苏氨酸蛋白激酶(RAC-α serine/threonine protein kinase,AKT1)、血管内皮生长因子A(Vascular endothelial growth factor A,VEGFA)、热休克蛋白HSP 90-alpha(Heat shock protein HSP 90-alpha,HSP90AA1)、视黄酸受体-alpha(retinoic acid receptor RXR-alpha,RXRA)。结果显示,艾叶治疗动脉粥样硬化的蛋白主要通过调节核酸转录、炎症反应及细胞增殖、迁移、凋亡等生物学过程发挥作用;在细胞构成方面主要与细胞核、胞外小体与胞液有关;在分子功能方面主要涉及锌离子结合、ATP结合以及类固醇激素受体激活等。KEGG通路注释分析结果显示,潜在靶点涉及37条相关信息通路,提示癌症通路、PIK3-Akt信号通路、Rapl信号通路、RAS信号通路等与艾叶抗动脉粥样硬化密切相关。对富集靶点最多的癌症通路进行详细注释,结果见图7,通路中艾叶抗AS可能涉及的靶点用粉色标记。
2.5 艾叶主要活性成分作用于SRC、HSP90AA1、RARX的分子对接验证
通过对“中药-成分-作用靶点网络”的分析及查阅文献可知,槲皮素与β-谷甾醇是艾叶作用于AS的主要活性成分。SRC、HSP90AA1、RARX不仅是疾病的靶点,也同样出现在最终所得的PPI蛋白互作网络之中且度值较高。一般认为配体与受体结合的构象越稳定结合能越低,发生相互作用的可能性越大。分子对接结果显示,槲皮素和β-谷甾醇分别与SRC、HSP90AA1、RARX 分子对接的结合能均远远小于0 kJ/mol,表明其相互之间具有较好的结合活性(表3、图7、图8),槲皮素和β-谷甾醇作为抗AS药物具有一定可行性。
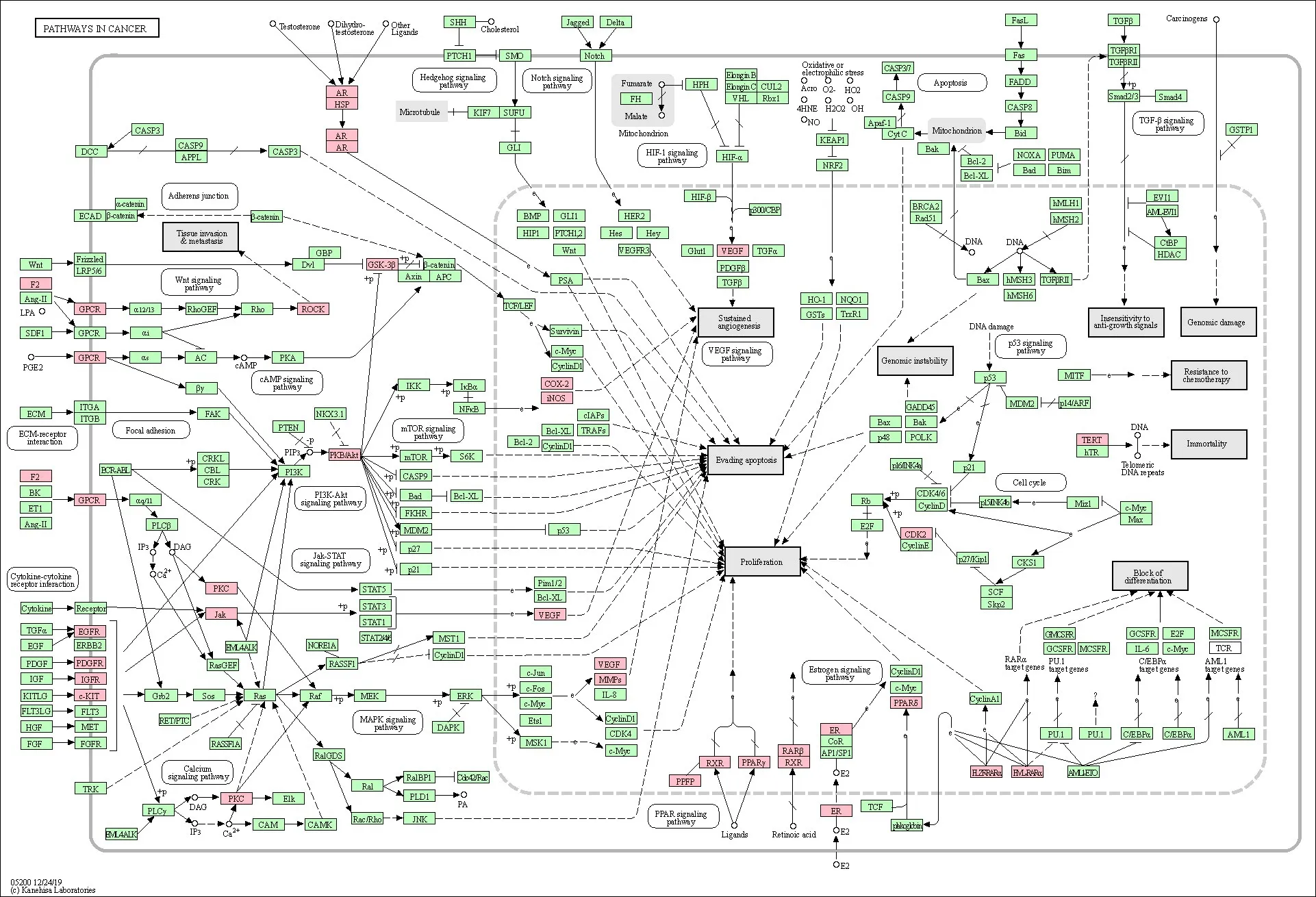
图6 癌症通路图解Figure 6 Detailed diagram of cancer pathway
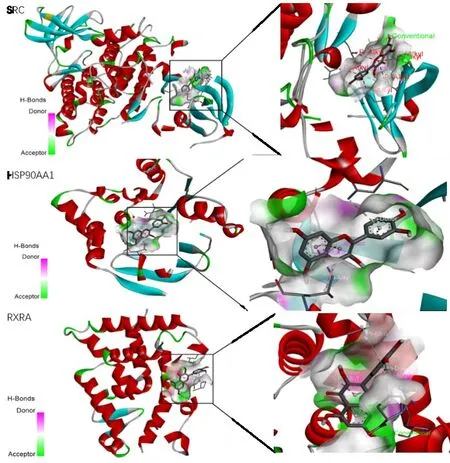
图7 槲皮素与关键蛋白分子对接示意图Figure 7 Molecular docking of quercetin and key proteins
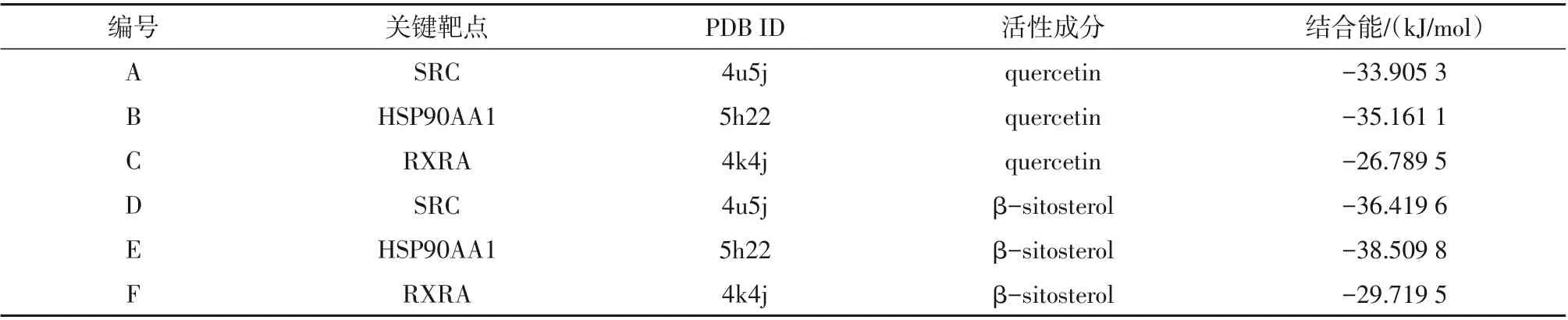
表3 关键靶点与槲皮素和β-谷甾醇的结合能Table 3 Binding energy of core targets with quercetin and β-sitosterol
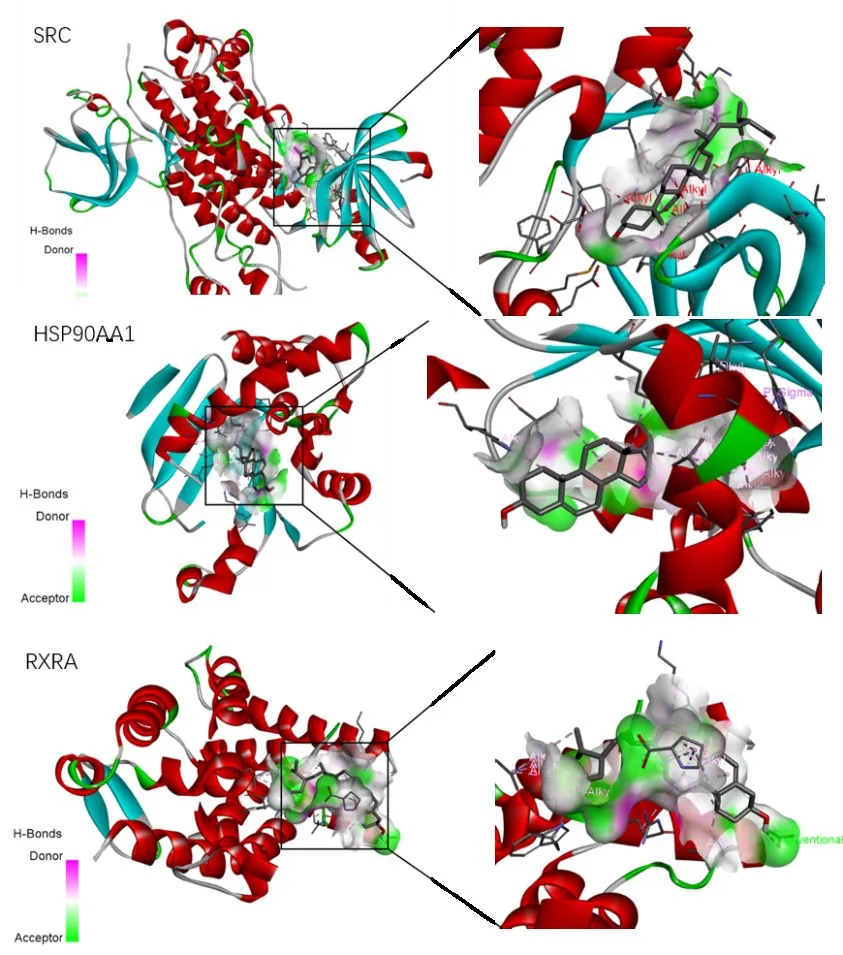
图8 β-谷甾醇与关键蛋白分子对接示意图Figure 8 Molecular docking of β-sitosterol and key proteins
3 讨论
本研究经过筛选获得槲皮素、β-谷甾醇、豆甾醇等9个艾叶活性成分,将成分靶点与疾病靶点相匹配获得艾叶治疗动脉粥样硬化的120个关键靶点。靶点蛋白互作网络分析结果显示,结合活性较好的关键靶点有AKT1、HSP90AA1、VEGFA、SRC、RXRA 等。AKT1 是一种丝氨酸/苏氨酸蛋白激酶,能调节内皮细胞和血管平滑肌细胞(vascular smooth muscle cells,VSMCs)功能,VSMCs 中缺少AKT1 的表达会引起斑块易损性特征,包括纤维帽变薄和核心区域坏死[14,15]。HSP90蛋白家族在动脉粥样硬化斑块中过表达,并与炎症发生有关,HSP90 抑制剂降低HSP90AA1 的表达,其特异性抑制作用可促进Nrf2 的激活,抑制NF-κB 在斑块中表达[16],通过抑制VSMCs的迁移增殖来减缓AS斑块的形成,从而显著减少病变。实验证明给予HSP90抑制剂后,高胆固醇饮食刺激的LDLR(-/-)小鼠VSMCs的迁移减少[17],氧化应激和炎症因子水平降低,AS斑块的稳定性增高。VEGFA是与血管生成有关的重要生长因子,可参与VEGF、PI3K/Akt信号通路,能促进巨噬细胞浸润、泡沫细胞形成以及内皮细胞增殖分化和血管新生[18],增加斑块的易损性[19],ApoE(-/-)小鼠中VEGFA的表达有助于AS的发展[20]。SRC是活跃于细胞接触粘附连接及缝隙连接部位的一类衔接蛋白,通过磷酸化底物将特异蛋白定位于黏附结构上,从而参与黏着连接信号通路[21],介导细胞迁移与血管形成[22],在AS斑块形成及稳定过程中起到关键作用。有研究证明SRC通过破坏黏附连接的完整性和促进单核细胞的转运,参与AS病变的发展[23]。RXRA激动剂可降低促炎分子的表达和血管壁炎症细胞的浸润情况,抑制动脉粥样硬化损伤的形成[24]。
富集分析和靶点归属分析结果表明,艾叶抗AS机制涉及核酸转录、炎症反应、细胞增殖迁移及凋亡等多个生物过程,有信号分子、转录因子、受体、酶和酶调节剂等多种物质参与。KEGG 通路注释分析结果显示,活性成分的靶点显著富集于PPAR、MAPK、Wnt、VEGF等癌症通路,PIK3-Akt信号通路,Rapl信号通路、RAS信号通路等。在动脉粥样硬化发病机制中至关重要的VSMCs增殖迁移及凋亡过程与癌症中癌细胞的发展有相似之处。有研究证实,选择性抑制PIK3-Akt信号通路能诱导巨噬细胞自噬,减少斑块巨噬细胞的浸润,抑制炎症反应从而稳定AS 易损斑块[25]。PIK3-Akt 能直接或间接地影响抑癌基因的表达从而调控细胞存活[26],细胞膜上PI3K的生成帮助激活Akt的信号因子PIP3,被激活的Akt可通过磷酸化参与凋亡、蛋白质合成与代谢和细胞周期调控。高血压、毒素及氧化作用等内外环境因素损伤动脉内膜后,导致单核细胞招募、粘附和侵入动脉内膜[27]。Rap1是RAS超家族成员中与细胞黏附相关的一类蛋白,具有独特的触发细胞极化、增强细胞运动性的能力,有助于与抗原呈递细胞和血管内皮细胞的粘附相互作用[28]。Ras与GTP蛋白结合被活化后能激活MAPK 级联反应,进入细胞核参与其它激酶或转录因子的磷酸化修饰,诱导与细胞周期进程或其他细胞过程有关的基因转录。单核细胞侵入动脉内膜后分化成巨噬细胞,并开始吸收脂质形成泡沫细胞。研究发现,MAPK级联反应可促进泡沫细胞的形成[29],多数情况下不单独调节细胞功能,而是与其他信号通路(如PI3K/Akt/mTor、Wnt/b-catenin通路)相互作用,调节动脉粥样硬化进程中炎症发生、细胞黏附等过程。

