血清糖晚期基化终末产物及可溶性晚期糖基化终末产物受体水平与急性脑梗死后出血性转化的相关性
田 伟 李友元 成 威
1)许昌市人民医院,河南 许昌461000 2)中南大学湘雅二医院,湖南 长沙461000 3)湘潭市中心医院,湖南 湘潭411100
急性脑梗死(acute cerebral infarction,ACI)是老年人死亡的主要原因,发病机制复杂且未完全阐明,病理基础主要是动脉粥样硬化,血小板活化及纤维系统失衡也可能是脑梗死发生的影响因素[1]。出血转化(hemorrhagic transformation,HT)是ACI 常见并发症,包括自然发生及药物治疗后发生的出血。研究显示,ACI后HT的机制复杂,受到多种因素共同影响,如年龄、高血压及高血糖、栓子向下游移动等[2-3]。但在实际干预过程中发现,上述常见的影响因素评估HT的价值不高,仍需探寻其他有效指标对ACI后HT进行准确评估。晚期糖基化终末产物(advanced glycation end products,AGEs)是过量糖和蛋白质结合产物,在血管壁沉积后可作用在内皮细胞外基质,刺激胶原蛋白,增加血管通透性,可能导致血管舒张功能障碍[4-5]。研究显示,AGEs对血管内皮具有一定损伤作用,可增加血小板聚集,进而对动脉粥样硬化起到一定作用[6],故推测AGEs与ACI发生、发展有一定联系。可溶性晚期糖基化终末产物受体(soluble receptor for advanced glycation end products,sRAGE)是晚期糖基化终末产物产物受体(receptor for advanced glycation end products,RAGE)的可溶性异构体,二者相互竞争结合配体,对多种疾病状态有一定保护作用[7-8]。本研究主要观察ACI 患者的血清AGEs、sRAGE水平及HT发生情况,主要分析各指标水平与HT的相关性,进而为ACIHT的早期风险预测及治疗提供基础。
1 资料与方法
1.1 一般资料选取2018-01—2019-12许昌市人民医院收治的91例ACI患者为研究对象,所有患者入院后根据病情接受个性化治疗。91例患者中男48例,女43例;年龄54 ~74(62.13±5.86)岁;体重指数(body mass index,BMI)17.8~25.1(22.58±2.16)kg/m2;脑梗死面积11~28(20.10±6.09)cm3;收缩压118 ~159(137.85±5.44)mmHg,舒张压72 ~99(85.85±6.32)mmHg;其中合并高血压38 例,糖尿病19 例,血脂异常12 例。本次研究经院医学伦理委员会批准。
1.2 入选标准
1.2.1 纳入标准:①所有患者符合《脑血管疾病诊断与治疗临床指南》[9]中ACI诊断标准,且经CT检查确诊;②患者、家属知情同意本研究,并签署知情同意书;③患者均为初次发病,且在发病72 h 内入院;④患者依从性较好,可配合完成本次研究;⑤精神、认知功能均正常者;⑥脑部CT检查显示无脑出血且无神经功能缺损对应的低密度区。
1.2.2 排除标准:①合并颅内动脉瘤动静脉畸形、颅内肿瘤蛛网膜下隙出血者;②近6个月内有脑血管病史,但无明显肢体瘫痪的腔隙性梗死者;③合并重要脏器病变者;④伴血液系统、免疫系统疾病者;⑤合并恶性肿瘤者。
1.3 方法
1.3.1 治疗方法:患者入院后应用甘露醇降低颅内压,预防脑水肿;保持呼吸道通畅,适当给予抗生素处理,预防感染;注射低分子肝素防止肺栓塞形成;根据血压情况慎重使用降压药;根据情况给予营养支持、溶栓治疗,并给予常规抗血小板聚集、抗凝及保护剂等干预。
1.3.2 ACI 后HT 判定及分组:患者发病24 h 内或经入院治疗后复查头部CT、MRI,出现出血型脑梗死或脑实质出血,主要表现为脑梗死边缘小点状出血、梗死区内片状出血、血肿及占位效应,即可判定[10]。将出现上述情况的ACI 患者纳入转化组,未出现上述情况的患者纳入未转化组。
1.3.3 检测血清AGEs、sRAGE 水平:分别于患者治疗前后采集空腹外周肘静脉血3 ~4 mL,于室温下放置60 min左右,后以3 000 r/min转速离心10 ~15 min,分离血清后将其置于 20 ℃冰箱中冷冻备用。采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血清AGEs、sRAGE 水平。试剂盒均购自北京永辉生物科技有限公司,各项操作均严格按照试剂盒说明书进行。
1.4 统计学方法采用SPSS 20.0统计学软件,计数资料以率(%)表示,组间比较采用χ2检验;计量资料均经正态性检验,符合正态分布采用均数标准差(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;血清AGEs、sRAGE水平的相关性采用一般线性双变量Pearson 直线相关检验;采用Logistic 回归分析检验血清AGEs、sRAGE水平对ACI后HT的影响;绘制受试者工作曲线(ROC)并计算曲线下面积(AUC),检验各指标水平预测ACI 后HT 的价值,AUC值>0.9表示诊断性能较高,0.71 ~0.90表示有一定诊断性,0.5 ~0.7 表示诊断性能较差,以P<0.05为差异有统计学意义。
2 结果
2.1 ACI 患者治疗前后血清AGEs、sRAGE 水平比较患者入院经治疗后血清AGEs 水平较治疗前下降,sRAGE水平较治疗前升高(P<0.05)。见表1。
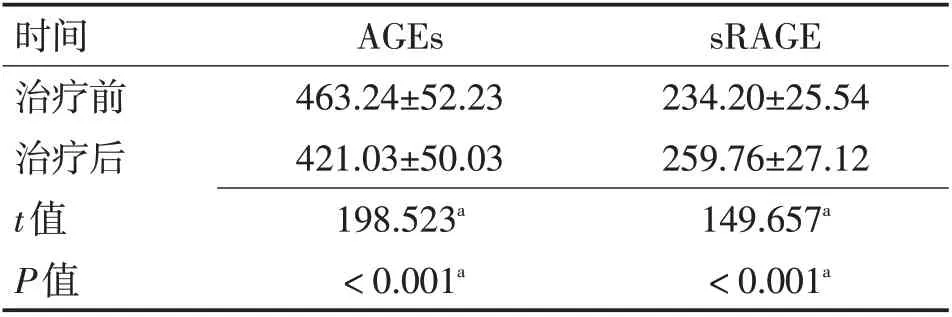
表1 ACI患者治疗前后血清AGEs、sRAGE水平比较 (ng/L,x±s)Table 1 Comparison of serum AGEs and sRAGE levels in ACI patients before and after treatment (ng/L,x±s)
2.2 HT 发生情况91例患者中30例患者发生ACI后HT,发生率32.97%(30/91)。
2.3 2 组患者治疗前血清AGEs、sRAGE 水平比较转化组患者血清AGEs 水平高于未转化组,sRAGE水平低于未转化组(P<0.05)。见表2。

表2 2组患者治疗前血清AGEs、sRAGE水平比较 (ng/L,x±s)Table 2 Comparison of serum AGEs and sRAGE levels in the two groups before treatment (ng/L,x±s)
2.4 血清AGEs、sRAGE水平的相关性分析经双变量Pearson直线相关性检验显示,ACI患者血清AGEs与sRAGE呈负相关(r= 0.300,P<0.05)。见图1。

图1 ACI患者血清AGEs与sRAGE相关性散点图Figure 1 Scatter diagram of the correlation between serum AGEs and sRAGE in ACI patients
2.5 血清AGEs、sRAGE 水平对ACI 后HT 影响的Logistic 回归分析将ACI 后HT 作为因变量(1=发生HT,0=未发生HT),将血清AGEs、sRAGE 作为协变量,进行Logistic 回归分析,结果显示血清AGEs过表达、sRAGE 低表达均是ACI 后HT 的影响因素(OR>1,P<0.05)。见表3。
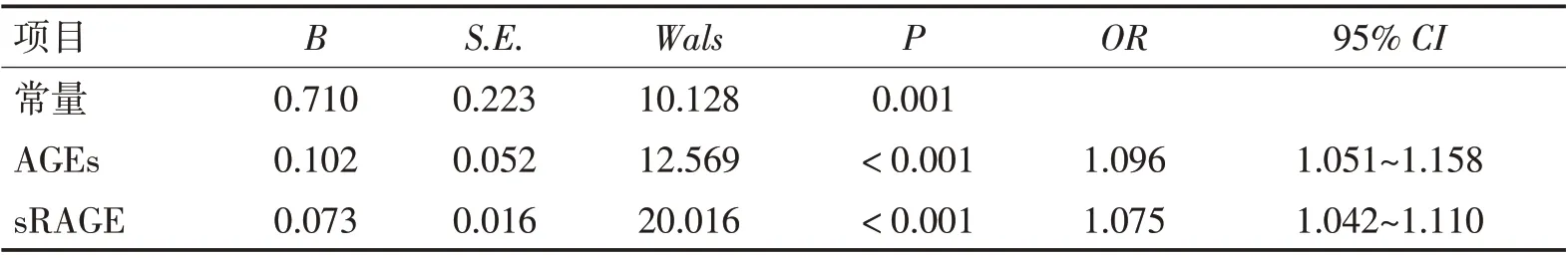
表3 血清AGEs、sRAGE水平对ACI后HT影响的Logistic回归分析Table 3 Logistic regression analysis of the effects of serum AGEs and sRAGE levels on HT after ACI
2.6 治疗前血清AGEs、sRAGE 水平预测ACI 后HT 价值的ROC 分析绘制ROC 曲线显示,治疗前血清AGEs、sRAGE 水平用于预测ACI 后HT 的曲线下面积分别为0.858、0.857,均>0.85,有一定预测价值。见表4、图2~3。
3 讨论
ACI 后HT 是脑梗死后发生的脑内出血,研究显示发生率为10%~43%,溶栓治疗后发生HT 率提高2 ~3 倍,严重影响患者预后[11]。既往研究显示,HT可能与老年、大血管破裂、白细胞渗入等因素有关,但因出血后血液对脑组织具有一定破坏性,难以鉴定HT 的具体机制,常会增加鉴别及诊断难度[12-13]。随着研究不断深入,炎症反应所产生的免疫因子被证实在ACI后HT中发挥重要作用,炎症因子可能直接或间接导致HT,但该结论尚未证实[14],可见探寻其他有效指标准确预测ACI 后HT 风险,利于早期预防、诊断及治疗。
AGEs是由体内葡萄糖、果糖等还原糖与氨基酸相结合,经脂质氧化、非酶催化反应生成的稳定终末产物,在血管壁沉积后可导致血管舒张功能障碍[15]。研究证实AGEs主要通过两个途径发挥作用,其一是通过直接修饰并改变蛋白质、脂质及核酸等结构,二是通过与特异性受体相互结合使机体发生病理性改变,后者发挥作用更为重要[16-17]。AGEs 可增加内皮细胞中氧自由基生成,进而增加蛋白激素酶C 的水平,可导致血管舒张功能发生障碍,同时增加血栓形成风险[18]。AGEs 不仅可多途径减少内皮细胞的合成,导致凝血及纤溶平衡失调,促使血小板聚集及活化,还可一定程度抑制内皮细胞凝血酶蛋白的表达[19-20]。AGEs 与RAGE 结合后,可增加炎性因子释放,促进血管收缩内皮素21 的表达,进一步降低血管收缩功能;此外,AGEs对血管内皮细胞造成损伤后,内膜下结构暴露在血液中,促进血栓形成,致管腔狭窄,进而加速血栓形成[21-22]。正常情况下AGEs 常作为清除机体衰老组织的信号,在病理状态下可能会导致组织细胞结构异常,引起病理变化[23-24]。研究显示,AGEs 主要通过氧化应激、提高RAGE 表达、促进脂蛋白氧化等加速动脉粥样硬化的形成[25],推测AGEs水平与ACI的发生、发展具有一定联系,但目前关于AGEs 与ACI 后HT 的关系研究甚少。本研究显示,ACI 患者治疗后血清AGEs 水平较治疗前有所下降,且转化组患者血清AGEs 水平高于未转化组,提示ACI 后HT 可能与血清AGEs 过表达有关;进一步Logistic回归分析显示,血清AGEs过表达可能是ACI后HT 发生的影响因素,提示AGEs 表达与ACI 后HT有关;绘制ROC曲线发现治疗前血清AGEs水平用于预测ACI 后HT 的曲线下面积为0.858,预测价值高,推测AGEs 可能是预测脑梗死后HT 风险的重要指标。

表4 治疗前血清AGEs、sRAGE水平用于预测ACI后HT的价值Table 4 Serum AGEs and sRAGE levels before treatment are used to predict the value of HT after ACI
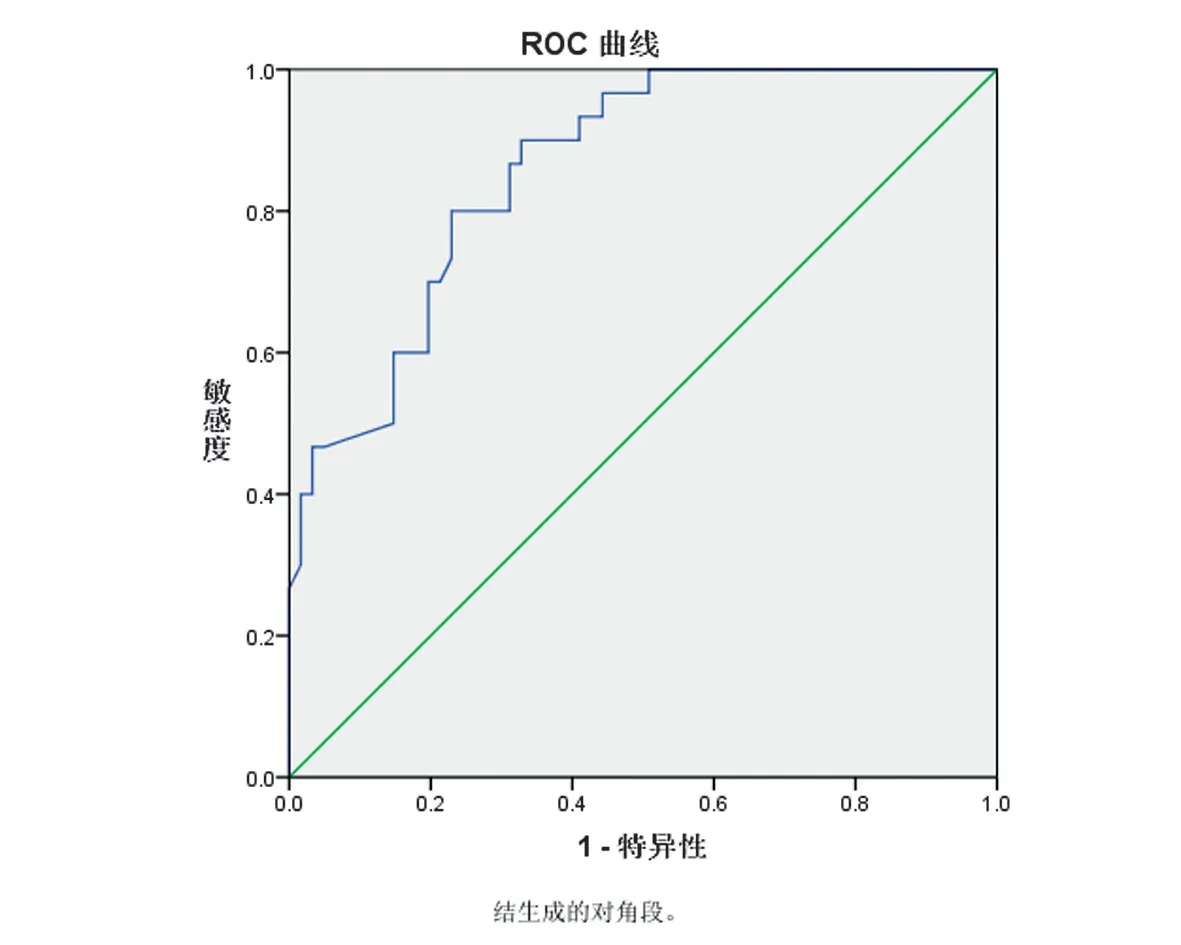
图2 血清AGEs用于预测ACI后HT的ROC曲线Figure 2 ROC curve of serum AGEs used to predict HT after ACI

图3 血清sRAGE用于预测ACI后HT的ROC曲线Figure 3 ROC curve of serum sRAGE used to predict HT after ACI
除观察AGEs 指标外,本研究还探讨了sRAGE水平与ACI 后HT 的关系。sRAGE 是RAGE 与基质金属蛋白酶剪切细胞膜表面RAGE 释放入血液中游离RAGE 的总称,在高龄、高糖情况下,该血清指标水平显著升高[26]。2014 年一项研究显示,sRAGE 可抑制RAGE 与配体相互结合引起的生理学效应,进而一定程度上保护机体心血管系统。sRAGE还可通过与AGEs 中和,抑制AGEs 与细胞内外蛋白交联所引起的血管内皮损伤。此外,sRAGE 还可通过抑制RAGE 与配体结合,进而抑制RAGE 生物学效应,具有保护机体心肌细胞,维持血管内皮细胞功能的稳定,延缓动脉粥样硬化发展过程[27]。正因ACI 的病理基础为动脉粥样硬化,推测sRAGE 在脑梗死疾病的发生、发展过程具有重要作用。但目前此类研究较少,尤其是与ACI后HT关系的研究更少。本研究显示,ACI 患者治疗后血清sRAGE 水平较治疗前有所升高,且转化组患者血清sRAGE 水平低于未转化组,提示ACI 后HT 可能与血清sRAGE 低表达有关;进一步Logistic回归分析显示,血清sRAGE低表达可能是HT 发生的影响因素,提示血清sRAGE 水平与ACI 后HT 具有内在联系;绘制ROC 曲线发现,治疗前血清sRAGE 水平用于预测ACI 后HT 的曲线下面积为0.857,预测价值高,可将其作为预测脑梗死后HT高风险的重要指标。但其具体机制尚不可知,且无较多循证学理论作为依据,加之本研究样本量小,研究结果可能存在一定偏颇;此外,本研究对血清AGEs、sRAGE 水平之间的相关性进行分析发现二者呈负相关,提示血清AGEs水平升高或下降可能会对sRAGE水平造成一定影响,但具体机制尚不清楚,二者是否会相互作用、相互影响,共同参与ACI 后HT尚不明确,仍需未来展开大样本、多中心的研究加以验证。

