超声微波协同提取红薯叶多酚及其抗氧化活性研究
崔艳平,聂 玮,岳凤丽,肖环环,孙庆泽,郭启振,张淦淇,孙广茹
(1.山东农业工程学院食品科学与工程学院,山东济南 250100;2.山东现代学院,山东济南 250100)
红薯叶是红薯茎上的叶子,营养价值非常高,对人体有很好的保健作用。红薯叶中富含多种营养物质,如多酚、蛋白质、维生素等[1-3],具有抗肿瘤、抗菌、提高免疫力、抗氧化等作用[4-6]。当前已将红薯叶应用于药品和食品加工等方面。在红薯叶的综合利用方面起主要作用的是其中的功能活性成分,如多酚等。目前,国内外科研人员对植物多酚的研究越来越多,但是将红薯叶作为原料提取多酚的研究则较少,且红薯叶多酚的提取率较低,难以满足红薯叶在药品和食品加工等方面的综合开发和利用。随着科技的发展,在植物多酚提取方面出现了很多新兴技术,如超声波、微波、生物酶解等,当前在红薯叶多酚提取方面已经应用的有超声波辅助提取、微波辅助提取和动态高压微射流(DHPM)等技术,超声辅助提取时间通常为24~40 min,微波辅助提取时间通常为10~25 min,提取时间均较长,会损害多酚中的一些不饱和成分。
超声微波协同提取技术是近年来发展较快的一种辅助提取技术[7-8],耗时短,通常为8~15 min,减少了多酚类物质的损失。目前应用超声微波协同提取技术提取红薯叶多酚的相关报道较少。本研究利用超声微波协同提取技术提取红薯叶中的多酚物质,并采用响应面法对超声微波协同提取红薯叶多酚的工艺条件进行优化,探究红薯叶中多酚物质的抗氧化活性,为红薯叶多酚的科学研究和应用提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜红薯叶,品种为‘福薯’,产自山东泰安。
无水乙醇、无水碳酸钠、福林酚试剂、没食子酸、DPPH(1,1-二苯基-2-苦肼基)、VC(抗坏血酸)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、过硫酸钾(K2S2O8),均为分析纯,购自上海沃凯生物技术有限公司。
CW130 粉碎机,上海天祥健台制药工程师机械有限公司;KH-6HMTN 微波农产品干燥杀菌装置,山东科弘微波节能有限公司;XO-SM00 超声波微波组合系统,中国南京先欧仪器制造股份有限公司;TGL-16M台式高速冷冻离心机,湖南省长沙湘仪离心机仪器有限公司;V5000 型可见分光光度计,上海元析仪器有限公司;LE104E/02 电子天平,梅特勒-托利多仪器(中国上海)有限公司。
1.2 方法
1.2.1 红薯叶多酚的提取
将新鲜红薯叶在400 W 条件下微波干燥10~15 min,置于超微粉碎机中低温粉碎20 min,粉碎后过300 目的筛,得红薯叶粉末。称取2.00 g 红薯叶粉末放入提取瓶中,按一定的料液比加入浓度为60%的无水乙醇溶液,搅拌均匀,按照一定的超声功率、超声时间、微波功率、微波时间提取红薯叶多酚物质。将提取液放入离心管中,配平后,放入离心机以4 000 r/min 离心15 min,取上清液,即得到多酚提取液。
1.2.2 红薯叶多酚含量的测定
准确称取0.001 g 没食子酸标准品,用蒸馏水溶解定容至100 mL,此溶液中没食子酸含量为10 μg/mL。再精密吸取0、1、2、3、4、5、6 mL 溶液到10 mL 比色管中,加入0.5 mL 福林酚,充分摇匀,静止1 min,加入1 mL、7.5%Na2CO3溶液(7.5 g 无水碳酸钠定容于100 mL 容量瓶中),定容至10 mL 比色管中,在避光条件下,在40 ℃水浴中静置1 h,以蒸馏水为参照,在760 nm 处测定吸光度值。以没食子酸标准溶液的浓度为横坐标,以样品的吸光度值为纵坐标,制作标准曲线[9]。
红薯叶多酚测定采用福林酚法。多酚将提取液稀释5 倍,向10 mL 比色管中加入稀释好的提取液1 mL,再加入0.5 mL 福林酚试剂,振荡1 min 后,加入1 mL、7.5%Na2CO3溶液,黑暗条件下放置1 h。以蒸馏水为空白对照,测量其在760 nm 下的吸光度值。通过标准曲线得到红薯叶中多酚的浓度,并按公式(1)计算多酚提取率。

式中,E为红薯叶多酚提取率,%;C为待测液中多酚的浓度,μg/mL;A 为稀释倍数,50;V为提取液的总体积,mL;m为称取的红薯叶粉末的质量,g。
1.2.3 单因素试验
设置料液比(1∶25、1∶30、1∶35、1∶40、1∶45)、超声时间(5、10、15、20、25 min)、超声功率(100、200、300、400、500 W)、微波功率(150、250、350、450、550 W)和微波时间(1、2、3、4、5 min)为单因素条件,研究不同因素对红薯叶多酚提取率的影响。
1.2.4 响应面优化试验设计
以单因素试验结果为前提,以料液比、微波功率和微波时间作为主要的自变量,红薯叶多酚的提取率作为响应值,进行三因素三水平的响应面试验,响应面试验因素水平设计见表1。
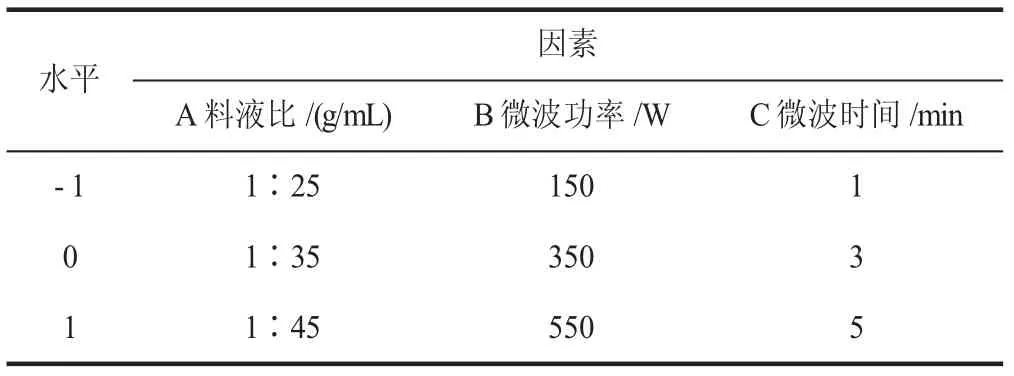
表1 响应面试验因素水平表Table 1 Factors and levels table of response surface experiment
1.2.5 抗氧化试验
(1)DPPH 自由基清除能力的测定
参考崔錾等[10]的方法,设置溶液浓度梯度,分别配制浓度为0.01、0.02、0.03、0.04、0.05 g/mL 的红薯叶多酚溶液和0.2 mmol/L 的DPPH 乙醇溶液。在10 mL 试管中分别加入2 mL 不同浓度的红薯叶多酚溶液和2 mL 的DPPH 乙醇溶液。摇匀后,暗反应30 min。在70%乙醇的参照下,设置波长为517 nm,测定吸光度值。同时用VC做对照,按照公式(2)计算其DPPH 自由基的清除率。
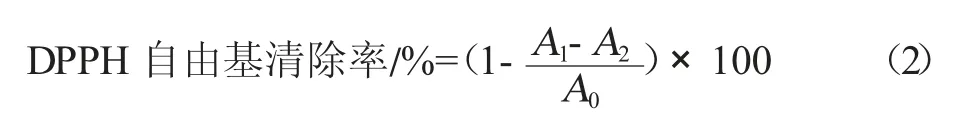
式中,A0为DPPH 溶液与无水乙醇的吸光值;A1为DPPH 溶液与不同浓度的样品溶液的吸光值;A2为不同浓度的样品溶液与无水乙醇的吸光值。
(2)ABTS 自由基清除能力的测定
参考马慧等[11]的方法,用移液枪取0.2 mL、2.6 mmol/L的K2S2O8溶液和相同体积的7.4 mmol/L 的ABTS 溶液混合,无光即黑暗条件下放置12 h,浓缩40~50 倍,在波长为734 nm 下测定其吸光度值,若该值保持在0.7±0.02,则表明ABTS 工作液配置完成。吸取3.2 mL 的工作液和0.8 mL 不同浓度下的红薯叶多酚溶液混合,振摇10 s 使其充分混匀,上述样品静置6 min 后,在734 nm 波长下测定其吸光度值。与此同时,用VC 做对照,按照公式(3)计算其ABTS 自由基的清除率。

式中,A0表示3.2 mL 工作液+0.8 mL 95%乙醇的吸光值;A表示3.2 mL 工作液+0.8 mL 样品溶液的吸光值。
1.3 数据处理
采用Excel 2010 进行数据统计,作图运用Origin 8.5,响应面优化设计应用Design-Expert V8.0.6.1 统计软件进行。
2 结果与分析
2.1 标准曲线的线性回归关系
由1.2.2 得到线性回归方程为y=0.007 1x+0.020 9(R2=0.999 7),可知具有良好的线性关系。
2.2 红薯叶多酚提取的单因素试验
2.2.1 料液比对红薯叶中多酚提取率的影响
由图1(见下页)可知,随着料液比的增加,红薯叶多酚的提取率先升高后降低,当料液比为1∶35 时,提取率最大,为3.48%。当料液比小于1∶35 时,红薯叶多酚的提取率变低,说明溶液增多,使多酚浓度降低,导致超声微波提取效率降低。而当料液比大于1∶35 时,提取剂与物料之间的接触面积随着溶剂的增多而变大[12],增加了红薯叶多酚的提取率。因此,料液比选择1∶35。
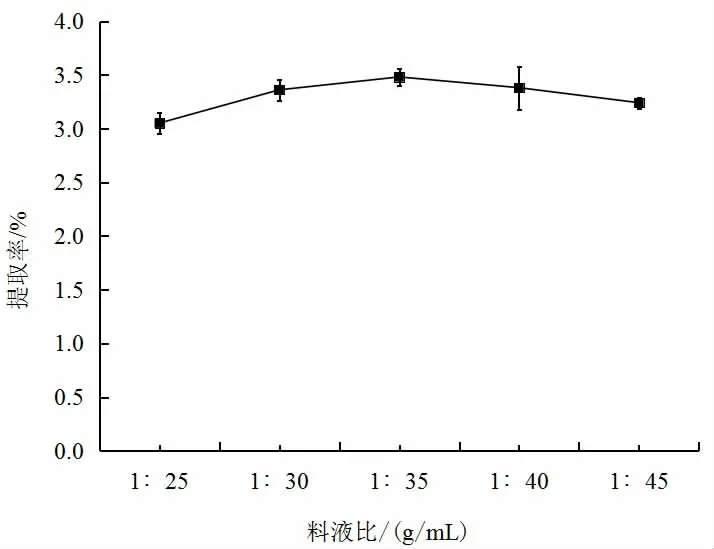
图1 红薯叶多酚提取率受料液比的影响Fig.1 Effect of solid-liquid ratio on the extraction yield of polyphenols from sweet potato leaves
2.2.2 超声时间对红薯叶多酚提取率的影响
由图2 可知,当超声时间小于10 min 时,红薯叶多酚提取率随超声时间的增加而增加,当超声时间为10min时,达到最大值,为3.59%;再增加超声时间,提取率降低,可能是超声时间过长,对多酚造成了一定程度的损害;之后逐渐平缓,是因为此时物料内部的多酚物质可能已经被提取完全。因此,超声时间选择10 min。

图2 超声时间对红薯叶多酚提取率的影响Fig.2 Effect of ultrasonic time on the extraction yield of polyphenols from sweet potato leaves
2.2.3 超声功率对红薯叶多酚提取率的影响
由图3 可知,超声功率小于300 W 时,红薯叶多酚的提取率随超声功率的增加而逐渐增大,提取率最大为3.58%,此时超声功率为300 W。而当超声功率大于300 W时,红薯叶多酚的提取率逐渐下降。提取率先增加后降低的原因可能是开始提取率随功率增大而增大,当超声功率过大时,会对多酚造成一定的损害,使提取率降低,当多酚被提取完全时,提取率趋于平缓。因此,超声功率300 W 为红薯叶多酚提取的最适条件。
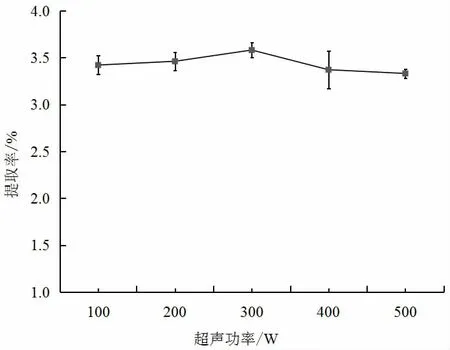
图3 超声功率对红薯叶多酚提取率的影响Fig.3 Effect of ultrasonic power on the extraction yield of polyphenols from sweet potato leaves
2.2.4 微波功率对红薯叶多酚提取率的影响
由图4 可知,当微波功率小于350 W 时,红薯叶多酚提取率随微波功率的增加而增大。提取率最大为3.55%,此时微波功率为350 W。再增加微波功率,红薯叶多酚提取率反而减小。提取率先增后降的原因可能是开始提取率随微波功率增大而增大,当微波功率过大时,会对多酚造成一定的损害,使得提取率降低,当多酚被提取完全时,提取率趋于平缓。因此,微波功率350 W 为红薯叶多酚提取的最适条件。
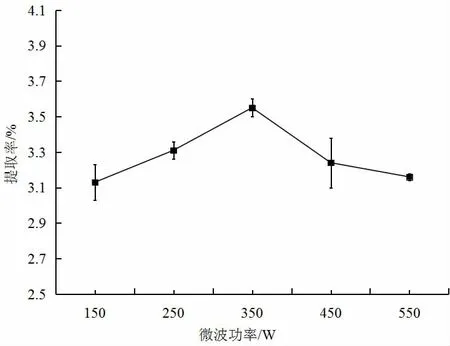
图4 微波功率对红薯叶多酚提取率的影响Fig.4 Effect of microwave power on the extraction yield of polyphenols from sweet potato leaves
2.2.5 微波时间对红薯叶多酚提取率的影响
由图5 可知,随着微波时间的逐渐增加,红薯叶多酚的提取率逐渐增大,当微波时间为2 min 时,红薯叶多酚提取率最大,为3.44%;此后随着时间的增加,红薯叶多酚提取率降低,可能是随着提取时间的延长,空气中的氧气氧化了红薯叶中的多酚物质,导致红薯叶多酚提取率下降;而多酚提取率又升高可能是由于体系中的温度升高使分子运动加快,多酚浸出量增加;再次降低是微波时间过长对多酚造成了一定程度的损害,降低了提取率。因此,微波时间2min 为最适合红薯叶多酚提取的条件。
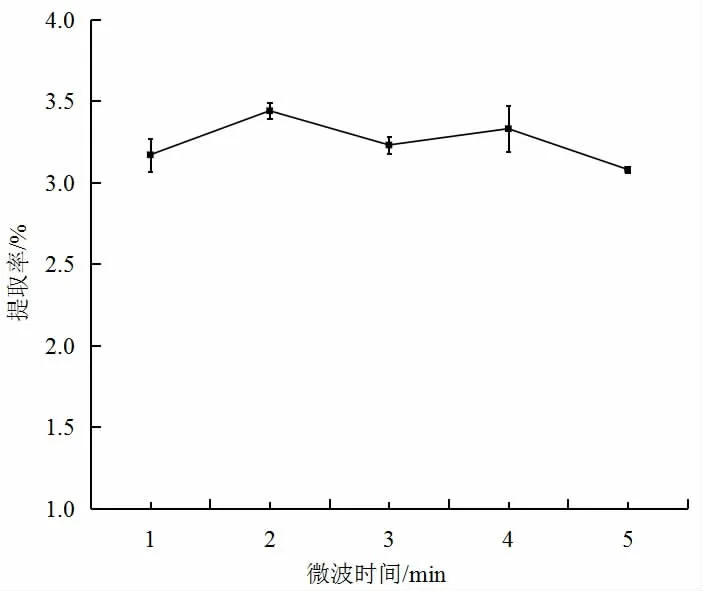
图5 微波时间对红薯叶多酚提取率的影响Fig.5 Effect of microwave time on the extraction yield of polyphenols from sweet potato leaves
2.3 响应面试验结果与分析
2.3.1 响应面试验结果
通过Box-Behnken 试验设计原理,以红薯叶多酚提取率(Y)为响应值,选择料液比(A)、微波功率(B)、微波时间(C)为影响因素,得出试验结果如表2。
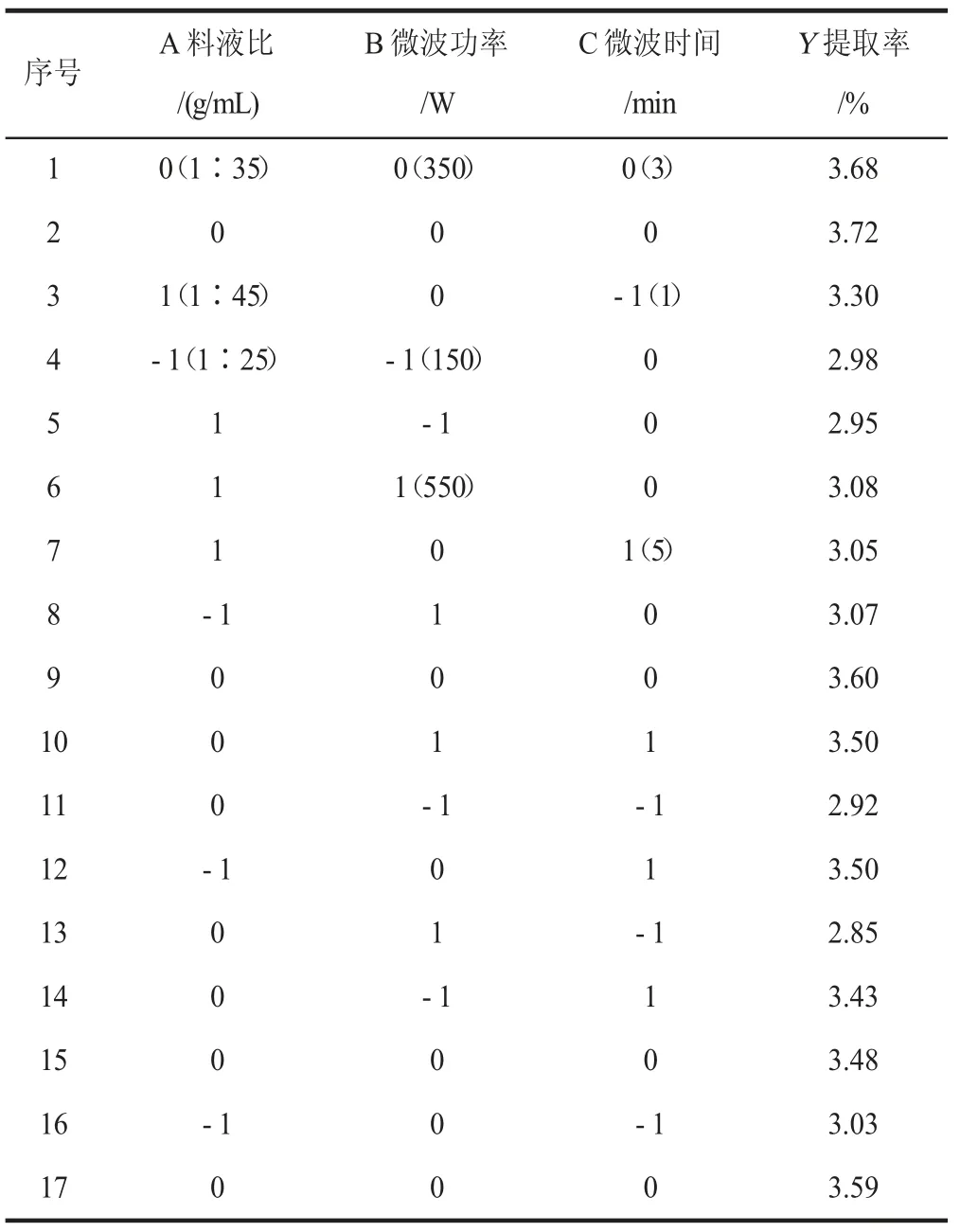
表2 响应面试验结果Table 2 Test results of response surface
对表2 的各组数据进行多元回归分析,得到拟合方程为Y=3.61-0.025A+0.028B+0.17C+0.01AB-0.18AC+0.035BC-0.27A2-0.32B2-0.12C2。
2.3.2 方差分析结果
由表3 可知,模型的F=6.420,相应的P=0.011 4<0.05,表明该模型显著。校正决定系数R2=0.891 9>0.80,表明模型有很好拟合性,模型的调整Radj=0.752 9,表明该模型能够解释75.29%的响应值的变化,可用于对超声微波协同提取法提取红薯叶多酚的工艺过程进行初步分析和预测。失拟项的P=0.085 9>0.05,表明不显著,没有失拟因素存在,因此对试验结果可以用该回归方程进行分析[13-14]。

表3 方差分析Table 3 Analysis of variance
一次项C、交互项AC 对红薯叶多酚提取率影响显著,二次项A2、B2对红薯叶多酚的提取率影响极显著,其余影响不显著。通过比较F值的大小,得出影响响应值的顺序为C>B>A,即微波时间>微波功率>料液。
2.4 红薯叶多酚提取的响应面分析及最佳条件验证
据Box-Behnke 8.0 软件,研究料液比、微波功率和微波时间对红薯叶多酚提取率的影响,结果如图6~8。

图6 红薯叶多酚提取率受AB 影响的响应曲面图Fig.6 Response surface diagram of polyphenols extraction rate of sweet potato leaves affected by AB
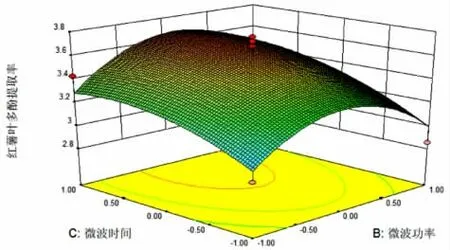
图7 红薯叶多酚提取率受BC 影响的响应曲面图Fig.7 Response surface diagram of the extraction rate of polyphenols from sweet potato leaves affected by BC

图8 红薯叶多酚提取率受AC 影响的响应曲面图Fig.8 Response surface diagram of polyphenols extraction rate of sweet potato leaves affected by AC
从图中可以看出,响应值随试验因素变化均先升高后降低,并在试验水平范围内出现一个最高点,即为红薯叶多酚提取率的较高点。通过响应面模型分析得到,红薯叶多酚最适提取条件为料液比1∶31.21,微波功率368.54 W,微波时间5.04 min,在此条件下红薯叶多酚提取率为3.71%。
为了提高试验的方便性,保持其他条件不变,调整料液比为1∶32、微波功率为368 W、微波时间为5 min,做3 次平行试验,测得红薯叶多酚提取率的平均值为3.70%,与响应面设计预测得出的红薯叶多酚提取率相差不大,再次证明了模型的可行性。
2.5 抗氧化结果
由图9 可知,当样品质量浓度从0.01 mg/mL 增加至0.02 mg/mL 时,红薯叶多酚对DPPH 自由基的清除率随样品质量浓度的提高从51.93%增加至78.80%,之后缓慢增加。红薯叶多酚对DPPH 自由基的清除率始终低于VC对DPPH 自由基的清除率,并且两者的变化趋势相近。
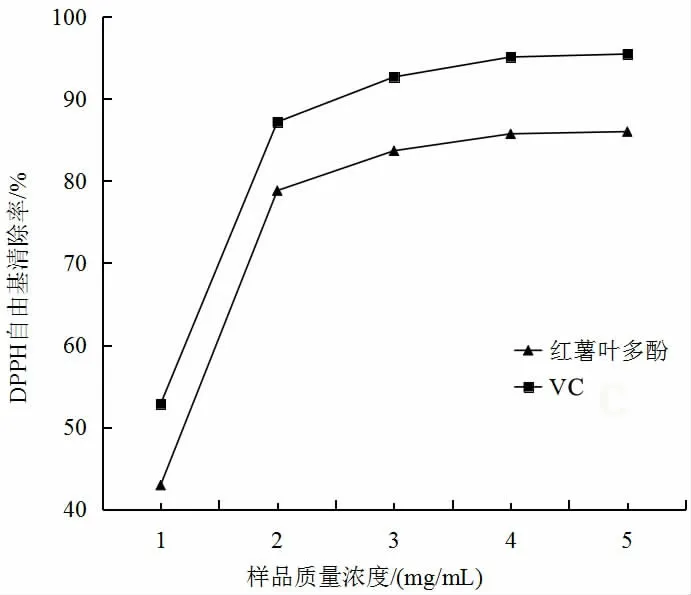
图9 不同样品质量浓度对DPPH 自由基清除率的影响Fig.9 Influence of different sample mass concentrations on DPPH free radical scavenging rate
由图10 曲线的走向可以看出,红薯叶多酚对ABTS自由基的清除能力随样品质量浓度增加而增大,但始终低于VC对ABTS自由基的清除率。当浓度为0.016 mg/mL时,红薯叶多酚和VC 的最大清除率分别达到92.76%和99.62%。通过试验分析得出,红薯叶多酚清除DPPH 自由基和ABTS 自由基的IC50值分别为0.000 3 mg/mL 与0.006 7 mg/mL。当某种物质具有一定的抗氧化作用时,该物质清除自由基的IC50小于10 mg/mL[15]。该结果表明,红薯叶多酚对DPPH 自由基和ABTS 自由基的清除有一定的作用。
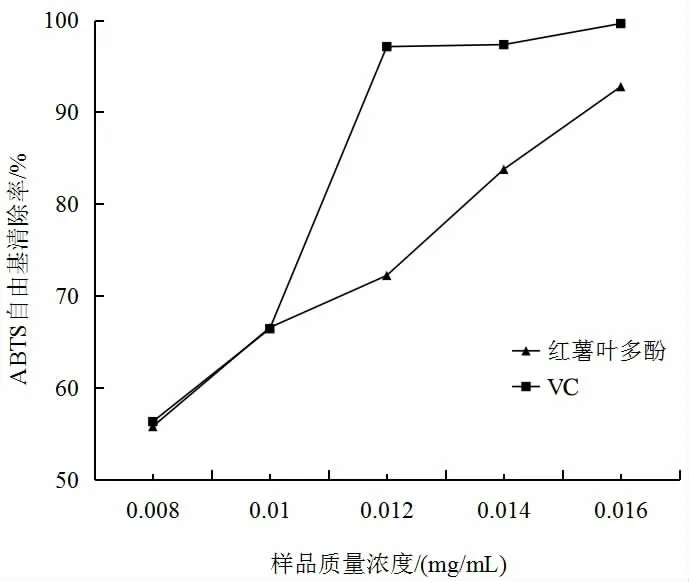
图10 红薯叶多酚对ABTS 自由基清除率的影响Fig.10 Effects of polyphenols in sweet potato leaves on ABTS free radical scavenging rate
3 结论
通过单因素试验及响应面的优化设计,得到料液比1∶32(g/mL)、超声时间10 min、超声功率300 W、微波功率368 W、微波时间5 min 为超声微波协同提取红薯叶多酚的最佳提取条件,提取率达到3.71%。通过对红薯叶多酚抗氧化能力的测定,测得红薯叶多酚清除DPPH 自由基和ABTS 自由基的IC50值均小于10 mg/mL,表明红薯叶多酚可以作为天然抗氧化剂的来源。

