不同澄清剂对葡萄小麦复合酒品质的影响
李英蕊,马玉蓉,赵 玲,吴佳珍,李 洋,刘丽媛,张瑛莉,南立军,4*
(1.楚雄师范学院资源环境与化学学院,云南楚雄 675000;2.吐鲁番林果业技术推广服务中心,新疆吐鲁番 838000;3.新疆西域明珠葡萄酒业有限公司,新疆石河子 832000;4.云南省高校葡萄与葡萄酒工程技术研究中心,云南楚雄 675000)
葡萄和小麦混合酿造的新型复合酒,可以实现优势互补,酿造出既具有水果风味,又具有粮食风味的复合酒。由于原料质地和成分的差异,因此,复合酒的酿酒工艺不同于水果酒,也不同于粮食酒,从而导致了酒的风味差异,也引起了酒的不稳定。目前鲜食葡萄和小麦产量高,来源广泛,各有优势,具有开发混合酒的潜质。但原料中的蛋白质、果胶与多酚长时间共存会产生混浊胶体,乃至沉淀[1];酒中含有悬浮状的酵母、细菌,凝聚的蛋白质、单宁以及浆果组织等物质;同时酒中残存的微生物代谢胶体物质,破坏酒的胶体平衡,引起雾浊、浑浊或沉淀等,对复合酒的稳定性产生潜在危害。因此有必要进行澄清处理。
目前酒类常用的澄清剂有果胶酶、皂土、明胶、壳聚糖、硅藻土等。果胶酶能将果肉组织中的果胶质分解为半乳糖醛酸和果胶酸,降低其黏度,增强澄清效果,但是容易降低酒的颜色,主要用于果蔬汁、果酒的澄清。皂土是由天然膨润土精制而成的无机矿物凝胶,也称膨润土,是一种具有吸附作用的天然黏土,能够吸附蛋白质形成絮状沉淀,也能吸附铁离子,降低铁破败病的发生,但是在吸附蛋白质和铁的过程中,同时也会吸附花色苷和酚类,降低酒的颜色和口感[2]。明胶带有一定电荷,与多酚、单宁、果胶和蛋白质等聚合成大分子物质,被过滤除去,从而澄清酒,但是影响了酒的收敛感。壳聚糖又称脱乙酰甲壳素,具有优良的絮凝性能,对蛋白质、果胶、多酚都有一定的作用,且产品风味、营养成分基本不受影响,生物稳定性良好,被广泛应用于澄清工艺中。研究表明,壳聚糖在汁液澄清中能够促进固液分离,显著提高汁液的透光率。以上澄清剂均是用于水果酒的澄清,应用于水果和粮食酿造的复合酒的澄清未见报道。因此,本研究以红提葡萄和白皮小麦为实验材料酿造葡萄小麦复合酒,并以果胶酶、壳聚糖和皂土为澄清剂,通过单因素试验优化复合酒的最佳澄清剂种类及其使用浓度,为水果与粮食混合酒的澄清提供参考。
1 材料与方法
1.1 材料
红提葡萄,产自云南滨川。白皮小麦,产自楚雄市。
皂土,山东潍坊研究所;96%脱乙酰度的壳聚糖,麦克林生物科技有限公司;活性5 万U/g 的果胶酶,上海康禧食品饮业有限公司;酿酒小曲,安琪酵母股份有限公司;安琪酿酒酵母,安琪酵母股份有限公司;所有试剂均为食品级,市售。
1.2 试剂
磷酸氢二钠,福晨(天津)化学试剂有限公司;盐酸,四川金山制药有限公司;氯化钾,天津市致远化学试剂有限公司;柠檬酸,天津市登峰化学试剂厂。
1.3 仪器与设备
电子天平Sop QUINITIX224-1CN,赛多利斯科学仪器(北京)有限公司;紫外可见分光光度计UV-5500,上海元析仪器有限公司;酸度计PB-10,赛多利斯科学仪器(北京)有限公司;分析天平TG328A,上海精科仪器厂;浊度计SGZ-10001,上海悦丰仪表有限公司。
1.4 葡萄小麦复合酒制作工艺
1.4.1 葡萄小麦复合酒A 工艺(所酿的酒简称复合酒A)
(1)将筛选出来的优质葡萄人工除梗、破碎,立即放入发酵罐。将发酵罐放在恒温水浴锅中,温度控制在25℃,浸渍3 d,得到葡萄醪。(2)小麦称质量后,装在干净的桶中,用40~50 ℃的温水浸泡6 h 后,放掉泡粮水,干发1~2 h,再用清水冲去酸水。将泡好沥干的小麦放入蒸锅内,蒸15~17 min。在蒸锅中加入热水,使水位高于粮面,水温控制在67~70 ℃,保温25~30 min。敞盖检查,小麦裂口率应在85%左右,熟透心率约90%,之后放出闷粮水;将闷粮后的小麦再次放入蒸锅,盖好锅盖,大火复蒸60~80 min,敞蒸10 min,滤去多余的水;将蒸好的小麦熟粮转至通风处摊凉后,开始下酿酒小曲。用曲总量为原料的0.4%~0.6%。分3 次下曲,每次下曲量占总曲量的30%左右。糖化48 h。(3)将葡萄醪和糖化48 h 小麦按质量比2∶1(g/g)的比例装入发酵罐,加入酵母0.2 g/L,启动发酵,发酵温度为28 ℃时,红提葡萄和小麦一起混合发酵,发酵5 d 后醪液分离,自流汁继续发酵,直至发酵停止。
1.4.2 葡萄小麦复合酒B 工艺(所酿的酒简称复合酒B)
(1)葡萄发酵酒:将筛选出来的优质葡萄人工除梗、破碎,立即放入发酵罐,加入0.2 g/L 的酵母,启动酒精发酵,发酵温度控制在20~25 ℃,发酵期间检测温度和比重的变化,直至比重接近1.000 时,分离出自流酒。(2)小麦糖化:同1.4.1(2)。(3)发酵完成的葡萄酒与糖化48 h的小麦混合发酵。
1.5 澄清试验设计
试验于2019—2020 年在楚雄师范学院葡萄与葡萄酒工艺实验室进行。本试验采用皂土、壳聚糖和果胶酶三种澄清剂对葡萄小麦复合酒A、B 进行澄清试验。
1.5.1 皂土澄清试验
参考苏玥等[3]的方法,略作修改。取皂土10 g,用50 ℃热水溶解后,用蒸馏水定容至100 mL,搅拌均匀避免结块,浸泡24 h,使其充分吸水膨胀后搅拌均匀,配制成100 g/L 的皂土溶液。取12 个50 mL 的比色管,分别标记6 个A 和6 个B,并将每个比色管中依次加入0、0.40、0.45、0.50、0.55、0.60 mL 的100 g/L 皂土溶液。将50 mL复合酒A 和复合酒B 分别加入对应的比色管中,充分搅拌均匀,静置12 h,分离酒脚,测定浊度和透光率,筛选出最佳皂土使用量。
1.5.2 壳聚糖澄清试验
壳聚糖溶液的配制参考李晓红等[4]的方法,略作修改。称取0.05 g 柠檬酸,加入8.95 mL 去离子水,并加热溶解,再加入1 g 壳聚糖,边加热边搅拌,配制成100 g/L的壳聚糖溶液,浸泡10 h 以上,搅拌均匀备用。取12 个50 mL 的比色管,分别标记6 个A 和6 个B,并将每个比色管中依次加入0、0.60、0.75、0.90、1.05、1.20 mL 的100 g/L壳聚糖溶液。将50 mL 复合酒A 和复合酒B 分别加入对应的比色管中,搅拌均匀,静置12 h,分离酒脚,测定浊度和透光率,筛选出最佳壳聚糖使用量。
1.5.3 酶法澄清试验
复合酒A:取6 支50 mL 比色管,每个比色管里加入50 mL 复合酒A,分别按比例加入0、20、25、30、35、40 mg/L果胶酶,用玻璃棒缓缓搅拌,果胶酶溶解后,在室温条件下酶解5 h,取上清液测定浊度、透光率,确定果胶酶的最佳用量。
复合酒B:取6 支50 mL 比色管,每个比色管里加入50 mL 复合酒B,其余步骤同上。
1.6 不同澄清剂试验
采用单因素试验筛选出的复合酒A 和复合酒B 的最佳果胶酶用量、最佳壳聚糖用量、最佳皂土用量分别处理复合酒A、B,12 h 后测定花色苷、色度和透光率,并与处理前的花色苷、色度和透光率进行对比,得到复合酒A、B 的最佳澄清方式。
1.7 测定指标及方法
1.7.1 色度
(1)制备磷酸氢二钠缓冲溶液
准确称取7.12 g 磷酸氢二钠定容至200 mL,配制成0.2 mol/L 磷酸氢二钠(A 液)。称取4.2 g 柠檬酸定容至200 mL,配制成0.2 mol/L 柠檬酸(B 液)。将上述200 mL A 液和200 mL B 液混合成AB 混合液400 mL,制备成0.1 mol/L 磷酸氢二钠缓冲液,并用pH 计直接测定该混合液pH 值,同时调整其pH 与待测样品复合酒A 和复合酒B 的pH 值相同。
(2)色度的计算
用大肚吸管吸取2 mL 待测样品于25 mL 比色管中,再用与样液相同pH 值的缓冲液稀释至25 mL。将待测样品在比色槽中放置15 min,此后观察比色皿中是否有气泡,若有气泡需驱赶后再开始比色。用1 cm 比色皿在波长420、520、620 nm 处分别测吸光值,以蒸馏水做空白。根据波长420、520、620 nm 处的吸光值按式(1)计算色度。

1.7.2 花色苷含量
采用pH 示差法[5]。取1.0 mL 样品,按1∶30(mL/mL)的料液比加入70%乙醇,用超声波辅助提取25 min 后过滤,得到花色苷提取液。准确称量0.930 g 氯化钾,加蒸馏水约480 mL,用盐酸和酸度计调整pH 至1.0,再用蒸馏水定容至500 mL,配制成pH 1.0 缓冲液。准确称量16.405 g 无水醋酸钠,加蒸馏水约480 mL,用盐酸和酸度计调整pH 至4.5,再用蒸馏水定容至500 mL,配制成pH 4.5 的缓冲液。用pH 1.0、pH 4.5 的缓冲液,分别将1 mL样液稀释定容至10 mL,放在暗处,平衡15 min。用光路直径为1 cm 的比色皿用可见分光光度计在波长510、700 nm 处分别测定吸光度,以蒸馏水做空白对照。按式(2)计算吸光度之差(A),按式(3)计算花色苷浓度(C)。
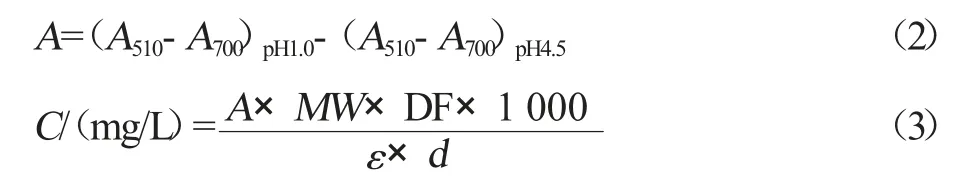
式中,(A510-A700)pH1.0为加pH 1.0 缓冲液的样液在510 nm 和700 nm 波长下的吸光值之差;(A510-A700)pH4.5为加pH 4.5 缓冲液的样液在510 nm 和700 nm 波长下的吸光值之差;MW=449.2(矢车菊-3-葡萄糖苷的分子量,mg/mol);DF=样液稀释的倍数;ε=26 900,矢车菊-3-葡萄糖苷的摩尔消光系数,mol-1;d为比色皿的光路直径,为1 cm。
1.7.3 透光率
移取10 mL 样品,加水定容至100 mL,摇匀,待用。将上述试液注入10 mm 比色皿中,于波长700 nm 处测定其透光率。
1.8 统计分析
所有数据采用Microsoft Excel 2010 软件进行统计和分析。显著水平为0.05,极显著水平为0.01,试验结果以平均值±标准差的形式表示。
2 结果与分析
2.1 不同皂土用量对复合酒A 的澄清效果
皂土处理复合酒A 12 h 后的试验结果如表1 所示。与对照相比,皂土用量为0.9、1.2、0.8、1.0、1.1 g/L(按照透光率的高低排列)对复合酒A 透光率的影响均显著,但透光率均比对照低,分析原因可能是皂土在沉淀酒中的蛋白类物质的同时,也沉淀了其它物质,降低了酒液的澄清度[6]。与对照相比,1.2、0.9、1.1、1.0、0.8 g/L(按照浊度的高低排列)皂土对复合酒A 浊度的影响也存在显著性。但是综合透光率、浊度和感官特性,0.8 g/L 的皂土用量效果最佳,该浓度皂土处理的复合酒A 的浊度为106.3 NTU,透光率为19.6%,具有青草味、草本味、谷物味及果香。因此,选用0.8 g/L 的皂土进行后续不同澄清剂的对比试验。

表1 不同皂土用量对葡萄小麦复合酒A 透光率、浊度和感官品尝的影响Table 1 Effects of bentonite dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine A
2.2 不同皂土用量对复合酒B 的澄清效果
如表2(见下页)所示,皂土处理对复合酒B 透光率和浊度的影响显著。与对照相比,皂土处理复合酒B 的透光率由高到低依次为0.9、1.2、1.0、08、1.1 g/L;皂土处理复合酒B 的浊度由高到低依次为1.0、0.8、0.9、1.1、1.2 g/L。相比之下,添加1.2 g/L 皂土时,浊度最低,透光率较高,酒样品尝时,还出现了热带水果的香气。因此选择皂土添加量为1.2 g/L 进行后续的不同澄清剂对比试验。

表2 不同皂土用量对葡萄小麦复合酒B 透光率、浊度和感官特性的影响Table 2 Effects of bentonite dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine B
2.3 不同壳聚糖用量对复合酒A 的澄清效果
如表3(见下页)所示,壳聚糖处理对复合酒A 透光率和浊度的影响均具有显著性。壳聚糖用量在1.5 g/L 时的透光率与2.1g/L时的相当,并且相对于对照显著增加,同时1.5 g/L 壳聚糖处理的样品浊度也降低到了最低点(221.2 NTU),通过感官品尝,尽管1.5 g/L 的壳聚糖处理的样品浊度最低,却产生了浓重的干稻草味,掩盖了谷物的香气;壳聚糖用量在2.1 g/L 时,透光率达到最大值,为26.3%,尽管浊度为240.9 NTU,但是谷物味和果味融合的恰到好处。壳聚糖用量在2.4 g/L 时,样品的透光率达到最低值,浊度为第二高,且出现了严重的硫味,因此2.4 g/L 壳聚糖是最不合适的。前人研究也发现,壳聚糖加入量过多,会导致壳聚糖将样液中的微粒全部包裹起来,从而失去在微粒之间的架桥作用,同时,胶体表面也会发生二次吸附,使微粒处于稳定状态,不利于样品的澄清,会使样液的黏度和浊度升高,这样壳聚糖对样液有效成分的吸附也会增加,易对样液的风味造成不利影响[7]。因此,试验中2.1 g/L 的壳聚糖对复合酒A 的澄清效果最佳。
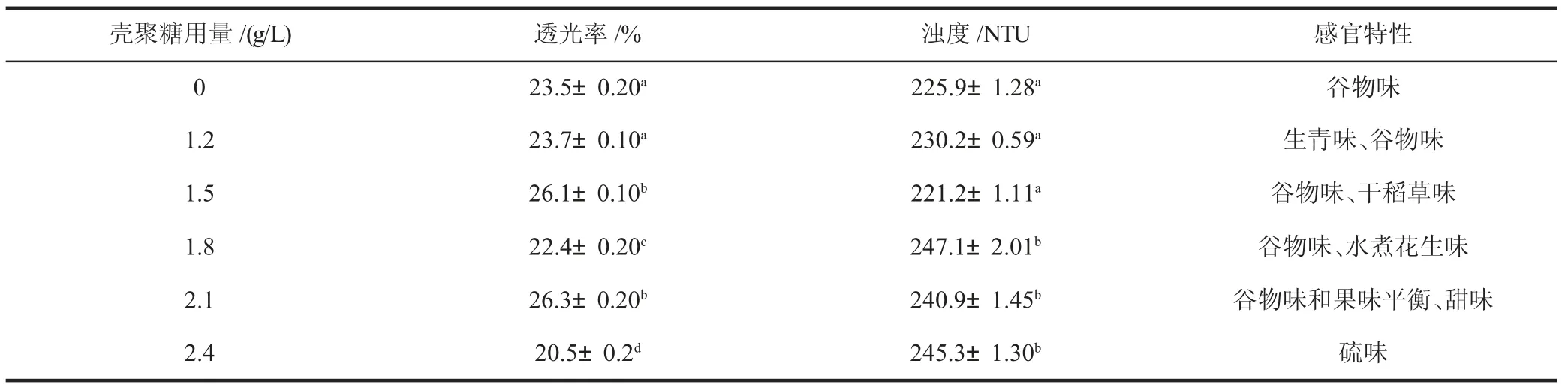
表3 壳聚糖用量对葡萄小麦复合酒A 透光率、浊度和感官特性的影响Table 3 Effect of chitosan dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine A
2.4 不同壳聚糖用量对复合酒B 的澄清效果
壳聚糖具有生物降解性、吸附性和吸湿性等特性,可以絮凝酒中的胶体、螯合金属离子和吸附有机酸类物质,从而提高酒的澄清度和稳定性,改善酒的口感,并且对酒的色度、主要成分影响不大[8]。壳聚糖用量对葡萄小麦复合酒B 透光率、浊度和感官品尝的影响如表4 所示。添加壳聚糖可以不同程度地提高复合酒B 的透光率,同时可以降低浊度(2.1 g/L 的除外)。就透光率而言,壳聚糖处理对复合酒B 的影响具有显著性。壳聚糖添加量为1.2 g/L 时,复合酒B 的透光率达最大,为53.0%,尽管有菠萝味,但同时出现了令人不愉悦的酸味;1.5 g/L 壳聚糖处理的复合酒B 也同样出现了令人不愉悦的酸味;1.8 g/L 壳聚糖处理的复合酒B 尽管透光率比对照高,但是浊度也比较高,而且产生沉淀并伴有燥辣感;当壳聚糖用量为2.1、2.4 g/L 时,透光率依次为45.8%和43.2%,但是2.1 g/L 壳聚糖处理的复合酒B 的浊度最高(13.98NTU),并且出现了硫味,而2.4 g/L 壳聚糖处理的复合酒B 的浊度最小,气味清新,含有热带水果的香气。综上分析,2.4 g/L 为壳聚糖澄清复合酒B 的最佳用量。

表4 壳聚糖用量对葡萄小麦复合酒B 透光率、浊度和感官特性的影响Table 4 Effect of chitosan dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine B
2.5 不同果胶酶用量对复合酒A 的澄清效果
如表5 所示,随着果胶酶添加量的增加,透光率逐渐增加,但30 mg/L 时,透光率出现了最低值(18.4%),此后再加大果胶酶用量,透光率又逐渐升高,在40 mg/L 时透光率达到最大值(22.0%)。果胶酶处理的浊度都较对照原酒高,这是由于随着果胶酶用量的增加,果汁中的酶蛋白含量也随之增加,从而导致果汁浊度增加[9]。果胶酶处理对复合酒A透光率的影响具有显著性,尽管在30 mg/L果胶酶处理的样品中透光率最低,但是再增加果胶用量时总体上呈现上升趋势,表明果胶酶用量的提高会增加复合酒A 的透光率。同样,果胶酶处理对复合酒A 浊度的影响具有显著性。20 mg/L 处理过的复合酒浊度和40 mg/L 的差别不大,略高于对照,但感官品尝时20 mg/L果胶酶处理的复合酒A 产生的酒精味较浓,掩盖了谷物味,40 mg/L 果胶酶处理复合酒A 产生了谷物味和酒精味平衡,有苹果味和焦糖味,透光率也是最高。25 mg/L 果胶酶处理的复合酒A 浊度相对较高,并且有不成熟的青草味,30 mg/L 果胶酶处理的复合酒A 浊度接近对照,但是略有不愉悦的硫味;35 mg/L 果胶酶处理的复合酒A尽管透光率高于对照,但是浊度最高,为262.6 NTU,并且有硫味,这是因为发酵时SO2还原为H2S、硫醇等,使酒中引入这种恶性气味[10]。综合考虑,对40 mg/L 的果胶酶复合酒A 的澄清效果最佳。
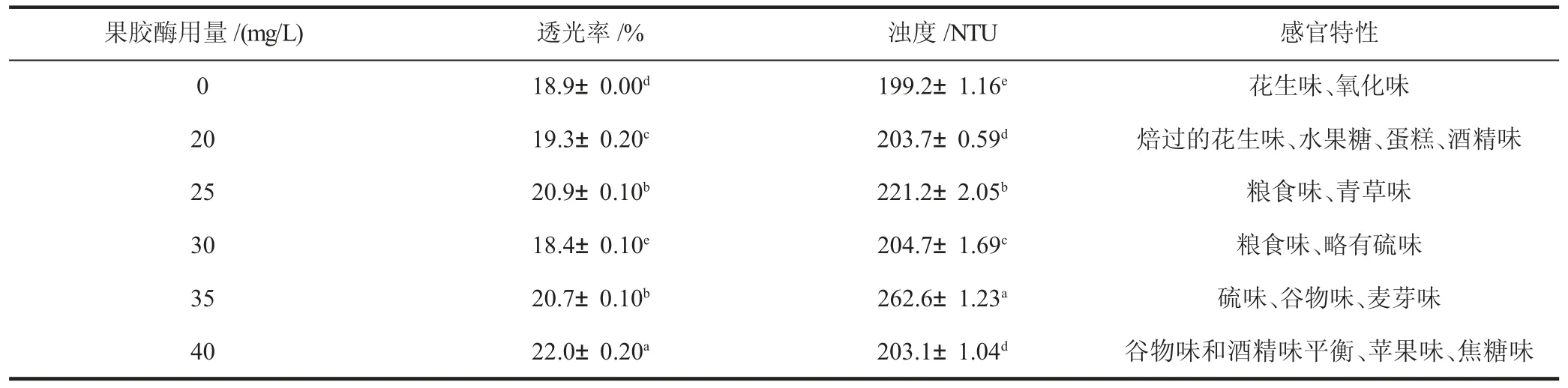
表5 果胶酶用量对葡萄小麦复合酒A 透光率、浊度和感官特性的影响Table 5 Effect of pectinase dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine A
2.6 不同果胶酶用量对复合酒B 的澄清效果
果胶酶用量对葡萄小麦复合酒B 透光率、浊度和感官品质的影响见表6(见下页)。就透光率而言,果胶酶处理对复合酒B 的影响具有显著性;就浊度而言,果胶酶处理对复合酒B 的影响同样具有显著性。随着果胶酶添加量的增加,透光率先增大后轻微减小,总体呈现上升趋势;浊度逐渐减小,最后在40 mg/L 果胶酶处理的复合酒中有轻微的增大;果胶酶添加量为30 mg/L 时,透光率最大,为61.4%,浊度也最小,为3.62 NTU。用30 mg/L 和35 mg/L 果胶酶处理复合酒,透光率相差较小,仅相差了1.2%,浊度也相差不大,但通过感官品尝分析,30 mg/L 果胶酶处理的复合酒B 有果香味,而35 mg/L 果胶酶处理的有橡胶味及一些不愉悦的气味,这种气味是由硫化物引起的。果胶酶添加量过多时,会使果汁产生混浊现象,造成透光率下降,浊度增加,并且还会增加澄清成本[11]。30 mg/L 果胶酶处理的复合酒B 中透光率达到了最高值,浊度最低,且具有果香味。因此,采用果胶酶澄清复合酒B时,果胶酶最佳用量为30 mg/L。
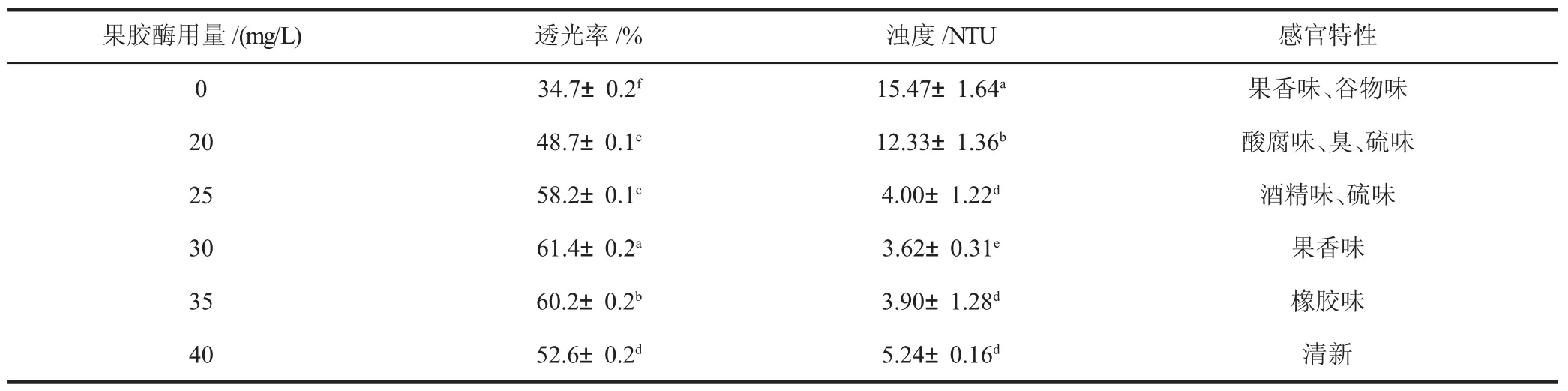
表6 果胶酶用量对葡萄小麦复合酒B 透光率、浊度和感官特性的影响Table 6 Effect of pectinase dosage on light transmittance,turbidity and sensory quality of grape-wheat compound wine B
2.7 复合酒A 的最佳澄清方式
在上述试验的基础上,选取40 mg/L 果胶酶、0.8 g/L皂土和2.1 g/L 壳聚糖溶液分别处理复合酒A,在澄清前和澄清12 h 后分别测定各样品的花色苷、透光率和色度,结果如表7 所示。
由表7 可知,就透光率而言,40 mg/L 果胶酶、0.8 g/L皂土和2.1 g/L 壳聚糖对复合酒A 的花色苷、透光率和色度的影响均具有显著性。用40 mg/L 果胶酶处理复合酒A,12 h 后复合酒的透光率从澄清前的18.4%上升到了26.8%,色度从澄清前的9.8 下降到了7.7,花色苷含量从澄清前的153.5 mg/L 下降到146.3 mg/L。因此,与处理前相比,经40 mg/L 果胶酶澄清处理后的复合酒A 的透光率明显提高,但是花色苷和色度明显下降。0.8 g/L 皂土澄清复合酒A 的效果不太明显,但是花色苷和色度的降低很明显,花色苷从153.5 mg/降低到了125.2 mg/L,色度从9.8 降低到了6.6,且对复合酒A 的品质有一定的影响,带来了一些令人不愉悦的气味(表1)。用2.1 g/L 壳聚糖溶液处理复合酒A,花色苷含量从澄清前的153.5 mg/L降低至107.9 mg/L,其透光率从澄清前的23.5%上升到了30.1%,色度从澄清前的9.8 下降至8.0,花色苷的大量损失,降低了酒的风味。综合来看,花色苷的残留量依次为146.3 mg/L(40 mg/L 果胶酶处理)、125.2 mg/L(0.8 g/L 皂土处理)和107.9 mg/L(2.1 g/L 壳聚糖处理),透光率和色度均是果胶酶处理的样品排第二,因此,用量为40 mg/L的果胶酶最适合复合酒A 的澄清。

表7 不同澄清剂对复合酒A 的影响Table 7 Effect of different clarifiers on complex wine A
2.8 复合酒B 的最佳澄清方式
在上述试验的基础上,选取30 mg/L 果胶酶、1.2 g/L皂土和2.4 g/L 壳聚糖溶液分别处理复合酒B,在澄清前和澄清12 h 后分别测定各样品的花色苷、透光率和色度,结果如表8 所示。
由表8 可知,就透光率而言,1.2 g/L 皂土、30 mg/L 果胶酶和2.4 g/L 壳聚糖对复合酒B 的影响均具有显著性;同样,1.2 g/L 的皂土、30 mg/L 的果胶酶和2.4 g/L 的壳聚糖对复合酒B 花色苷和色度的影响也具有显著性。30 mg/L 果胶酶处理复合酒12 h 以后,复合酒B 的透光率从34.7%上升到了63.6%,色度从7.4 下降到了3.5,花色苷从7.4 mg/L 下降到5.3 mg/L。用果胶酶澄清复合酒具有效率高、效果好的优点,对复合酒中悬浮物的沉降有极大的促进作用。可见,果胶酶有助于葡萄与小麦中天然成分的提取,对复合酒的色泽和香气有极大的促进作用。

表8 不同澄清剂对复合酒B 的影响Table 8 Effect of different clarifiers on complex wine B
花色苷稳定性受pH 值、温度、添加剂、光照等因素的影响[12]。用1.2 g/L 皂土对复合酒B 澄清,12 h 后,花色苷含量从7.4 mg/L 降低至1.7 mg/L,降低明显;透光率由35.2%上升至46.10%;色度由7.4 降到5.0,且肉眼可看出,复合酒浊度明显降低。但使用皂土沉淀酒中的蛋白类物质的同时,也沉淀了其它物质[13]。
壳聚糖作为澄清剂,具有澄清时间短、操作简单、成本低、澄清效果好等优点[12]。用2.4 g/L 壳聚糖溶液处理复合酒B,12 h 后测定各指标。其透光率从30.5%上升至54.2%,花色苷含量从7.4 mg/L 下降到1.2 mg/L,色度从7.4 下降的3.9。当在复合酒B 中加入壳聚糖时,除了澄清作用以外,由于壳聚糖与聚酚类化合物的亲合作用,可以使酒由最初的淡黄色变为金黄色,提高了酒的外观品质,但是花色苷降低太多,对酒的风味有不利的影响。
综合来看,30 mg/L 的果胶酶对花色苷的降低最少,透光率最高,最适合复合酒B 的澄清。
3 结论
在单因素试验的基础上,选取40 mg/L 果胶酶、0.8 g/L皂土和2.1 g/L 壳聚糖溶液分别处理复合酒A,结果发现,40 mg/L 果胶酶相对于其它两种材料而言,澄清效果更好,处理复合酒A 的透光率为26.8%,色度为7.7,花色苷含量为146.3 mg/L。综合考虑,复合酒A 的最佳澄清方式为40 mg/L 的果胶酶。
在单因素实验的基础上,选取30 mg/L 果胶酶、1.2 g/L 皂土和2.4 g/L 壳聚糖溶液分别处理复合酒B,结果发现,30 mg/L 果胶酶相对于其它两种材料而言,澄清效果更好,处理后复合酒B 的透光率为63.6%,色度为3.5,花色苷含量为5.3 mg/L。综合考虑,复合酒B 的最佳澄清方式为30 mg/L 的果胶酶。

