兴安杜鹃叶抗红色毛癣菌活性成分的筛选
严 培, 杨朝君, 穆怡含, 高 平, 邓小宽
(四川大学生命科学学院 生物资源与生态环境教育部重点实验室, 成都 610065)
1 引 言
浅部真菌病是由寄生在皮肤及肢体外的真菌感染而起的,此类皮肤病较顽固,不易根治,全世界约有20%~25%的人口受到影响,其中皮肤癣菌为主要的致病菌,而红色毛癣菌 (Trichophytonrubrum)占皮肤癣菌的60%以上[1]. 目前临床上多使用烯丙胺基和唑类抗真菌药物,病原菌对该类药物的耐药性已逐渐增强[2],因此研究寻找新型抗菌药物便极为迫切. 中草药来源广泛,含抗真菌的化学成分多,不易产生耐药性且毒副作用小,是探索新型抗真菌药物的途径之一[3]. 兴安杜鹃叶(满山红)是我国用于治疗支气管炎及哮喘的常用中药材,近些年的研究表明,兴安杜鹃叶具有抑菌作用,其生物碱类和黄酮类物质对多种细菌具有体外抑制作用[4-5],但并未系统分析其具体成分,且对于兴安杜鹃叶抑制皮肤癣菌的研究目前还未见报道. 本实验室前期预实验表明,兴安杜鹃叶对红色毛癣菌具有很好地体外抑制作用. 因此,本实验通过液-液萃取法获取兴安杜鹃叶的不同萃取相,并结合对红色毛癣菌的抑制活性研究,明确活性物质主要分布部位. 采用硅胶柱层析、MCI柱层析、C18柱层析及高压制备色谱柱层析等方法分离有效部位,获取单体化合物并鉴定,结合抑菌活性确定具体活性成分,以期为开发新型抗真菌药物奠定基础.
2.1 材 料
2.1.1 实验材料 兴安杜鹃叶购于成都市荷花池中药材市场,由高平教授经生药学鉴别本品为杜鹃花科杜鹃花属植物兴安杜鹃RhododendrondauricumL.;盐酸小檗碱、杜鹃素、萹蓄苷、槲皮素标品(成都植标化纯生物有限公司);氟康唑(上海麦克林生化科技有限公司).
红色毛癣菌(T.rubrum,ATCC 28188)、近平滑念珠菌(ATCC 22019)由四川大学生命科学学院生物资源与生态环境教育部重点实验室提供.
2.1.2 试 剂 所用试剂均为色谱纯或分析纯(成都科龙化工试剂厂); SDA培养基、PDA培养基、RPMI 1640培养基(北京威森特科技发展有限公司).
2.1.3 仪 器 小型粉碎机(铂欧五金厂);R201D真空旋转蒸发仪(巩义英峪高科仪器厂);SW-CJ-1D型单人净化工作台(苏州净化设备有限公司);电热恒温培养箱(北京中兴伟业仪器有限公司);手提式不锈钢压力蒸汽灭菌锅(上海申安医疗器械厂);光学显微镜(上海巴托仪器厂);血球计数板(南通海锐实验器材有限公司);LC3000高效液相色谱仪(UV3000紫外检测器、P3000高压输液泵,北京创新通恒科技有限公司);Sepax Sapphire C18色谱柱(250 mm×4.6 mm,5 μm);MCI GEL(上海厦美生化科技发展有限公司);制备色谱柱(YMC-C18-10 μm); MicrOTOF QⅡ、Bruker Avance Ⅱ-400/600 MHz spectrometer(德国Bruker公司).
2.2 方 法
2.2.1 化学成分的提取 取兴安杜鹃叶粉末5 kg,加甲醇溶液渗漉提取,减压浓缩渗漉液得粗提物浸膏(Crude extract,CT)770 g. 将CT用适量热水分散,依次加入石油醚(Petroleum ether,PE)、乙酸乙酯(Ethyl acetate,EA)和正丁醇(Butyl alcohol,BA)萃取,每相萃取三次,合并每相萃取液,减压浓缩得PE(231 g)、EA(203 g)、BA(101 g)、W(279 g)四段萃取物浸膏,用二甲亚砜配置成50 mg·mL-1的药液,打孔法测定抑菌活性.
2.2.2 活性物质的分离 根据抑菌活性筛选结果,将EA萃取物浸膏用适量甲醇溶解,加入硅胶拌匀,湿法上柱,干法上样. 用石油醚、乙酸乙酯、甲醇、冰醋酸配制成不同极性大小的洗脱剂,由小到大梯度洗脱,收集洗脱液,经TLC检测后合并相同组分,减压浓缩得到Fr.1(10 g)、Fr.2(9 g)、Fr.3(24 g)、Fr.4(9 g)、Fr.5(12 g)、Fr.6(30 g)、Fr.7(37 g)、Fr.8(20 g)、Fr.9(15 g)、Fr.10(22 g)共10个活性段浸膏,Fr.3浓缩后结出晶体,石油醚反复重结晶后得到化合物1(4.7 g). 抑菌活性测定结果显示Fr.6、Fr.7、Fr.8、Fr.9四个活性段效果最好,将四段分别用少量二甲亚砜溶解后,过MCI柱脱色素,80%甲醇洗脱,收集洗脱液,减压浓缩. 其中Fr.9浓缩后析出晶体,反复重结晶后得到化合物16(421 mg),母液经HPLC检测后未发现其他含量较多成分,不再分离. Fr.6过C18柱,40%-60%甲醇溶液梯度洗脱,得到化合物2(850 mg)和Fr.6-1、Fr.6-2组分;Fr.6-1继续过C18柱,10%~15%甲醇溶液梯度洗脱,得到化合物3(19 mg)、4(48 mg)、5(54 mg);Fr.6-2未能分出较纯的化合物单体. Fr.7经C18柱,20%~80%甲醇溶液梯度洗脱,得到Fr.7-1、Fr.7-2、Fr.7-3、Fr.7-4四个组分,其中,经HPLC检测,Fr.7-3组分为化合物2;Fr.7-1继续过C18柱,5%~10%甲醇溶液梯度洗脱,得到化合物6(507 mg)、10(18 mg)、11(22 mg);Fr.7-2经高压制备色谱柱,5%~15%甲醇溶液梯度洗脱,得到化合物7(19 mg);Fr.7-4经高压制备色谱柱,得到化合物8(10 mg)、9(14 mg). Fr.8经C18柱,20%~80%甲醇溶液梯度洗脱,得到Fr.8-1、Fr.8-2、Fr.8-3三个组分,其中,从Fr.8-1中未能分离出纯度高的化合物;Fr.8-2经高压制备色谱柱,5%~20%甲醇溶液梯度洗脱,得到化合物12(33 mg)、13(567 mg);Fr.8-3经高压制备色谱柱,得到化合物14(19 mg)、15(21 mg). 将化合物1~16用二甲亚砜配置成10 mg·mL-1的药液,打孔法测定抑菌活性.
2.2.3 结构鉴定 根据化合物1~16的MS、NMR、HPLC结果,结合相关文献解析化合物结构.
2.2.4 菌悬液的制备 挑取红色毛癣菌菌丝于PDA培养基上,在28 ℃条件下活化培养7~14 d,用生理盐水洗下孢子,血球计数板计数后,用生理盐水稀释配置成浓度为5×106~10×106CFU·mL-1的菌悬液用于打孔法测定;用RPMI-1640培养基稀释成相同浓度用于最小抑菌浓度测定.
2.2.5 抑菌活性测定(打孔法) 吸取100 μL菌悬液于SDA培养基上,涂布均匀,用直径为 0.6 cm打孔器打孔,挑掉孔内培养基,向孔中添加100 μL药液,各药液设置三个重复,二甲亚砜作为空白对照,将接种好的培养基置于28 ℃下培养7 d,观察红色毛癣菌生长情况,用十字交叉法测量抑菌圈直径,使用软件IBM SPSS Statistics 23和GraphPad Prism8.0比较各药液的抑菌活性高低,分析各组数据间的显著性关系并绘图.
2.2.6 最小抑菌浓度(MIC80)测定 参考美国临床和实验室标准化研究所 ( CLSI) 2008 年推荐的 《产孢丝状真菌的液基稀释法抗真菌药物敏感性试验方案》 ( M38-A2) 进行测定[6]. 将化合物2、6、7先用二甲亚砜溶解,再用RPMI-1640培养基倍比稀释成2倍终浓度,终浓度由高到低依次为10、5、2.5、1.25、0.625、0.312 5、0.156 25、0.078 125 mg·mL-1,分别添加至无菌96孔板的第1~3列,第4列添加同样梯度浓度的盐酸小檗碱为阳性对照,第5列添加含二甲亚砜的RPMI-1640培养基为生长对照. 在每孔中添加100 μL菌悬液,混匀后放置于28 ℃恒温培养箱中孵育7~14 d,读取结果. 结果需由2人肉眼判断,与生长对照孔对比,将菌液略模糊(生长抑制≥80%)的最小浓度记为该化合物的最小抑菌浓度(MIC80). 质控菌株为近平滑念珠菌(ATCC 22019),质控药物为氟康唑.
2.2.7 最小杀菌浓度(MBC)测定 从上述浓度高于MIC80的96孔板里吸取100 μL于SDA培养基中,涂布均匀,放置于28 ℃恒温培养箱中培养7 d,观察有无菌落生长,取无菌落生长的最小浓度记为该化合物的最小杀菌浓度(MBC).
3 结果与分析
3.1 兴安杜鹃叶不同萃取相对红色毛癣菌的抑制活性
采用打孔法测定兴安杜鹃叶不同萃取相对红色毛癣菌的抑菌圈直径,结果如图1A所示,与空白对照组(CK)相比,除W相没有抑制活性外,其余三相均对红色毛癣菌有一定抑制活性. 打孔法测得抑菌圈直径越大,表明抑制活性越强,将抑菌圈直径进行显著性分析得到图1B,EA相的抑制活性显著高于PE相和BA相;与CT相比,EA相的抑制活性也显著高于CT,而PE相和BA相均显著低于CT. 因此,兴安杜鹃叶中的抑菌活性物质主要集中在EA相,将EA相作为样品进行后续实验.

图1 兴安杜鹃叶不同萃取相对红色毛癣菌的抑菌结果
3.2 结构鉴定
从EA相的Fr.6~ Fr.9中分离得到16个化合物,经鉴定为:
化合物1:白色粉末.ESI-MS at m/z:369.11[M-H]-,NMR数据与文献[7]基本一致,故鉴定该化合物为Daurichromenic acid,分子式为C23H30O4.
化合物2:淡黄色晶体.HPLC检测结果显示该化合物出峰时间与杜鹃素标品一致,且混合进样显示为同一物质,故鉴定该化合物为杜鹃素(farrerol),分子式为C17H16O5.
化合物3:白色结晶.ESI-MS at m/z:167.15[M-H]-,NMR数据与文献[8]基本一致,故鉴定该化合物为香荚兰酸(vanillic acid),分子式为C8H8O4.
化合物4:浅黄色粉末.ESI-MS at m/z:303.25[M-H]-,NMR数据与文献[9]基本一致,故鉴定该化合物为二氢槲皮素(taxifolin),分子式为C15H12O7.
化合物5:白色粉末.ESI-MS at m/z:136.95[M-H]-,NMR数据与文献[10]基本一致,故鉴定该化合物为对羟基苯甲酸(p-hydroxybenzoic acid),分子式为C7H6O3.
化合物6:白色针状结晶.ESI-MS at m/z:163.00[M+H]+,160.88[M-H]-,NMR数据与文献[11]基本一致,故鉴定该化合物为伞形花内酯(umbelliferone),分子式为C9H6O3.
化合物7:浅棕色针晶.ESI-MS at m/z:193.08[M+H]+,190.95[M-H]-,NMR数据与文献[12]基本一致,故鉴定该化合物为去甲丁香色原酮(2-Methyl-5,7-dihydroxychromone),分子式为C10H8O4.
化合物8:白色粉末.ESI-MS at m/z:471.7[M-H]-,NMR数据与文献[13]基本一致,故鉴定该化合物为山楂酸(Maslinic acid),分子式为C30H48O4.
化合物9:白色粉末.ESI-MS at m/z:471.8[M-H]-,NMR数据与文献[14]基本一致,故鉴定该化合物为科罗索酸(corosolic acid),分子式为C30H48O4.
化合物10:黄色固体.HPLC检测结果显示该化合物出峰时间与萹蓄苷标品一致,且混合进样显示为同一物质,故鉴定该化合物为萹蓄苷(avicularin),分子式为C20H18O11.
化合物11:白色结晶.ESI-MS at m/z:197.18[M-H]-,NMR数据与文献[15]基本一致,故鉴定该化合物为丁香酸(syringic acid),分子式为C9H10O5.
化合物12:淡黄色针状结晶.ESI-MS at m/z:285.24[M-H]-,NMR数据与文献[16]基本一致,故鉴定该化合物为山奈酚(kaempferol),分子式为C15H10O6.
化合物13:黄色粉末.HPLC检测结果显示该化合物出峰时间与槲皮素标品一致,且混合进样显示为同一物质,故鉴定该化合物为槲皮素(quercetin),分子式为C15H10O7.
化合物14:白色结晶.ESI-MS at m/z:455.69[M-H]-,NMR数据与文献[17]基本一致,故鉴定该化合物为熊果酸(ursolic acid),分子式为C30H48O3.
化合物15:白色结晶.ESI-MS at m/z:455.71[M-H]-,NMR数据与文献[17]基本一致,故鉴定该化合物为齐墩果酸(oleanolic acid),分子式为C30H48O3.
化合物16:黄色粉末.ESI-MS at m/z:435.12[M+H]+,432.93[M-H]-,NMR数据与文献[17]基本一致,故鉴定该化合物为槲皮素-3-O-β-D-呋喃木糖苷(Quercetin -3-O-β-D-xylofuranoside),分子式为C20H18O11.
3.3 单体化合物对红色毛癣菌的抑菌活性
采用打孔法测定单体化合物对红色毛癣菌的抑制活性,结果如图2所示. 与CK相比,杜鹃素、伞形花内酯等7个单体化合物均对红色毛癣菌有一定抑制活性,将这7个单体化合物的抑菌圈直径和EA相进行显著性分析比较,结果见图3. 杜鹃素、伞形花内酯和去甲丁香色原酮的抑菌活性均显著高于EA相,表明兴安杜鹃叶中对红色毛癣菌有抑制活性的单体化合物主要为杜鹃素、伞形花内酯、去甲丁香色原酮,其中伞形花内酯的抑菌活性最强.

图2 单体化合物对红色毛癣菌的抑菌结果Fig.2 The bacteriostasis results of monomer compounds to T.rubrum
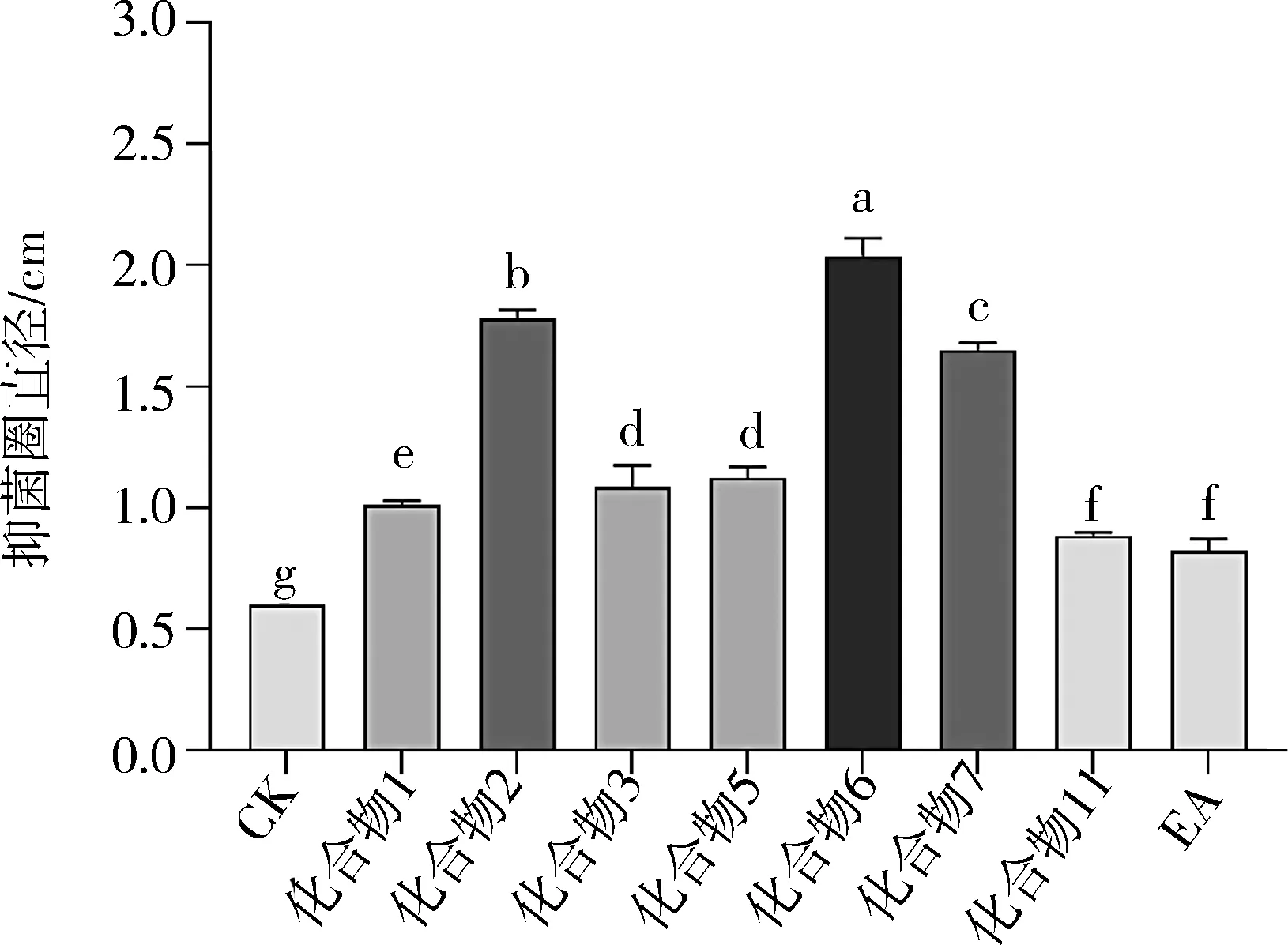
图3 单体化合物对红色毛癣菌的抑菌圈直径比较
a~g indicates there have significant difference(P<0.05)between the groups.
3.4 单体化合物MIC80和MBC结果
通过M38-A2法测定3个主要活性物质对红色毛癣菌的最小抑菌浓度和最小杀菌浓度,并与盐酸小檗碱比较,结果见表1.

表1 主要活性物质对红色毛癣菌的MIC80值和MBC值
杜鹃素、伞形花内酯和去甲丁香色原酮对红色毛癣菌的MIC80值分别为0.312 5、0.156 25、0.312 5 mg·mL-1,MBC值分别为1.25、1.25、5 mg·mL-1;阳性对照盐酸小檗碱的MIC80值为0.156 25 mg·mL-1,MBC值为5 mg·mL-1. 故此,伞形花内酯的抑菌活性与盐酸小檗碱相当,而杜鹃素和伞形花内酯的杀菌活性均强于盐酸小檗碱.
4 讨 论
打孔法和CLSI M38-A2方案是检测药液体外抑制产孢丝状真菌的常用方法. 对于色素含量较多,用M38-A方案不便于直接观察菌丝生长情况的药液,用打孔法可直观比较结果,操作便捷,且与滤纸片法、牛津杯法相比,打孔法具有可定量药液,重复性好,成本低廉的优点. 因此,本实验采用打孔法比较实验过程中各药液的抑菌活性. 但打孔法只能比较本实验中各药液间的抑菌活性,而M38-A2方案是一个测定丝状真菌对不同药液敏感性的标准化程序,可使不同实验室测定的各药液抗真菌活性结果具有可比性或可重复性[18]. 因此,采用M38-A2方案测定本实验得到的主要活性物质对红色毛癣菌的MIC80值.
本实验从兴安杜鹃叶的乙酸乙酯萃取物中分离鉴定出16个化合物,其中,化合物7~9为首次从该植物中分离得到,此结果拓宽了对兴安杜鹃叶物质基础的认识. 抑菌活性测定结果表明,化合物1~3、5~7、11均对红色毛癣菌有一定抑制活性,其中,化合物2、6、7的抑制活性最好,此研究结果发现了兴安杜鹃叶中多种成分的抗皮肤癣菌活性,并明确其主要活性物质为杜鹃素、伞形花内酯和去甲丁香色原酮. 红色毛癣菌是最常见的皮肤癣菌,从天然药用植物中筛选抗皮肤癣菌成分受到研究者的广泛重视. 在对药用植物抗菌成分的筛选研究中,桑枝中筛选出的氧化白藜芦醇对红色毛癣菌的MIC为0.5 mg·mL-1[19],植物中广泛存在的芳樟醇对红色毛癣菌的MIC为0.32 mg·mL-1[1];而在药用植物有效部位对红色毛癣菌的抑制活性研究中,黄连的正丁醇萃取物比其他溶剂萃取物抑制效果更强,其MIC为0.125~0.25 mg·mL-1[20],香鳞毛蕨中间苯三酚类物质对红色毛癣菌的MIC为0.312 5~5 mg·mL-1[21];除此之外,凤仙花、马齿苋[22]、水翁皮[23]、苦参、土荆皮和白癣皮[24]等多种药用植物粗提物对抗红色毛癣菌的MIC在1.509~62.5 mg·mL-1之间. 本实验结果显示,兴安杜鹃叶中杜鹃素、伞形花内酯和去甲丁香色原酮对红色毛癣菌的MIC80为0.156 25~0.312 5 mg·mL-1,与其他的植物成分相比,以上物质抑制活性较强.
本实验仅对乙酸乙酯萃取物中抑菌活性最显著的Fr.6~Fr.9的物质进行了分离和筛选,对抑菌活性稍弱的石油醚萃取物、正丁醇萃取物及乙酸乙酯萃取物中其他活性段的成分未有研究,其中是否含有其他活性成分还有待进一步探讨. 同时,对活性成分抗红色毛癣菌的作用机理也需更深入的研究.

