miR-623靶向DNM2调控非小细胞肺癌细胞A549的凋亡研究
许峰 刘闻 陈宇 方汉林 左剑辉
安徽医科大学第一附属医院普胸外科,合肥230022
作为世界上最常见的恶性肿瘤之一,肺癌已成为世界范围内与癌症相关的第一大死亡原因[1]。小细胞肺癌占20%,非小细胞肺癌占80%[2]。大约85%~90%的肺癌死亡是由非小细胞肺癌引起的,其分子机制是复杂和异质性的[3]。近年来,非小细胞肺癌的治疗进展迅速,使人们对其病理机制、肿瘤转移的分子机制、治疗和预后有了进一步的认识,诊断和治疗的改进也大大延长了肺癌患者的生存期。然而非小细胞肺癌的新分子治疗选择靶点的识别仍然十分有限,需要对肺癌发生、发展过程中涉及的异常基因表达进行精确的分子表征,这可能在未来提高临床疗效。了解非小细胞肺癌发生、发展的机制可能会对临床实践产生重大影响。
微小RNA(microRNAs,miRNAs)是一类丰富的非编码18~25核苷酸小RNA,与特异性靶m RNA的3'-UTR结合,通过诱导翻译抑制或m RNA降解来抑制基因表达。miRNAs参与多种生物学过程,如细胞周期进展、增殖、生长和凋亡。特殊miRNAs的异常表达是包括非小细胞肺癌在内的许多人类肿瘤类型的标志,它们既可以作为癌基因,也可以作为肿瘤抑制因子。例如,miRNA-143在肺癌细胞中表达被强烈下调,导致c-MYC、NUDT1、OCT4和EGFR表达升高,肿瘤细胞生长、转移和迁移增加[4]。相比之下,miRNA-21在包括非小细胞肺癌在内的不同癌症中过表达,导致PTEN抑制,细胞生长和侵袭增加[5-6]。因此,miRNAs可以作为肺癌诊断、预后和治疗的潜在有用的生物标志物。Nigita等[7]发现非小细胞肺癌中多种miRNA失调,包括miR-623,但miR-623对非小细胞肺癌的调控机制还需要进一步的研究。细胞凋亡在大多数多细胞生物的发育过程和组织稳态中起重要作用;在许多疾病状态的发病机制和进展过程中,细胞凋亡的异常已经被证实。在非小细胞肺癌中,细胞凋亡的平衡被打破。然而,miR-623是否与凋亡相关仍未探明。基于此,本研究使用A549作为研究对象,旨在探讨miR-623调控非小细胞肺癌细胞A549凋亡的潜在分子机制。
1 材料与方法
1.1 材料 非小细胞肺癌细胞A549购自深圳益百顺科技有限公司(货号:A549)。用合成的寡核苷酸和pCMV载体构建pGCV-DNM2表达质粒(pCMV-DNM2)。Lipo2000购自北京斯科科技有限公司(货号:11668027-0.75)。miR-623过表达、miR-623抑制、siDNM2和siGFAP均由北京擎科生物科技有限公司合成。RPMI-1640培养基购自北京普益华科技有限公司(货号:R8005-10X1L)。pmir-glo utr1质粒购自广州基旦生物科技有限公司(货号:JG190917001M)。GAPDH抗体购自广州左克生物科技发展有限公司(货号:WB2197)。DNM2抗体购自广州文睿科学仪器有限公司(货号:DF12953)。胎牛血清购自广州左克生物科技发展有限公司(货号:HQ30071)。TRIzol试剂购自广州齐云生物技术有限公司(货号:B610409-25 ml)。HiScriptqRTSuper Mix购自南京诺唯赞生物科技有限公司(货号:R122-01)。Cham Q SYBR qPCR Master Mix购自广州捷威斯生物科技有限公司(货号:Q331-02)。RIPA总蛋白裂解液购自广州捷威斯生物科技有限公司(货号:RBG2007-1)。Annexin V-PE凋亡检测试剂盒购自北京华夏远洋科技有限公司(货号:C1065)。
1.2 方法
1.2.1 细胞培养与转染 人非小细胞肺癌A549细胞培养在RPMI-1640中,并且补充10%胎牛血清、100 U/ml青霉素和100 mg/L链霉素。非小细胞肺癌A549细胞在湿润的含5%二氧化碳的37℃培养箱中培养。使用Lipofectamine 2000进行转染,将pGCV-DNM2、阴性对照载体、miR-623过表达、miR-623抑制、siDNM2和siGFP分别与Lipofectamine 2000混合后,在室温下放置15 min后,缓慢滴入A549细胞中,转染6 h后更换新鲜的完全培养基。
1.2.2 免疫印迹 使用RIPA缓冲液从非小细胞肺癌A549细胞中提取总细胞蛋白,然后在4℃的条件下12 000 r/min离心20 min,离心半径15 cm。随后收集上清液。使用二辛可宁酸蛋白质测定试剂盒测量这些蛋白质样品的浓度。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶中分离蛋白质样品(每个泳道30μg),然后转移到硝酸纤维素膜上。用5%脱脂牛奶封闭后,将膜与DNM2(稀释比为1∶2 000)或GAPDH(稀释比为1∶5 000)第一抗体在4℃下孵育过夜。第2天,将膜与耦联了辣根过氧化物酶的相应抗小鼠或抗兔IgG二抗在室温下孵育1 h。蛋白质条带使用Western Bright ECL试剂盒(相同体积的A液和B液混合后缓缓滴在硝酸纤维素膜上),然后使用ChemiDocTMXRS+系统进行可视化。
1.2.3 RNA抽取与实时荧光定量PCR 用TRIzol试剂提取来自于非小细胞肺癌A549的总RNA。使用HiScriptqRTSuper Mix从2μg总RNA中进行互补脱氧核糖核酸的反向转录。qRTPCR采用Cham Q SYBR qPCR Master Mix试剂盒进行。GAPDH作为内部对照。反应在96孔平板上进行:95℃孵育10 min,40个循环(95℃孵育15 s,60℃孵育1 min),所有反应重复3次。反应后,使用固定阈值设置确定循环阈值(cycle threshold,CT)数据,并从重复3次PCR中确定平均CT。采用对比CT法将每种情况与对照组进行比较。miRNAs的相对水平使用U6小核RNA归一化。使用2-ΔCT公式计算miRNA的相对表达水平,ΔCT=(CT miRNA-CT GAPDH)。
1.2.4 细胞凋亡水平的检测 根据制造商的说明,使用Annexin V-PE凋亡检测试剂盒对不同处理的
细胞进行凋亡分析。简而言之,经过不同处理后,收集在6孔板上生长的漂浮非小细胞肺癌A549细胞和胰蛋白酶分离的细胞,并用冷的1×PBS洗涤。然后将细胞沉淀物用结合缓冲液重悬,并根据试剂盒方案用Annexin-V染色。荧光显微镜观察。将实验组中凋亡细胞的百分比与对照转染组进行比较。所有样品一式三份测量。
1.2.5 荧光素酶报告实验 使用miRDB在线预测miR-623潜在的靶基因,初步鉴定出目标基因为DNM2。从人非小细胞肺癌A549的cDNA文库中扩增出DNM2 3'-UTR的野生型序列。miR-623结合位点的突变是通过快速突变试剂盒定点突变引入的,将碱基c突变为g。PCR产物被克隆到pmir-glo utr1质粒上。通过双荧光素酶报告基因试剂盒进行荧光素酶活性的检测。
1.3 统计学分析 采用SPSS 19.0进行分析。所有数据均以±s表示。组间比较采用单因素方差分析和t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-623对非小细胞肺癌细胞A549的凋亡水平的影响 非小细胞肺癌细胞A549的凋亡水平为(21.2±6.5)%,使用miR-623过表达组过表达miR-623后,发现非小细胞肺癌细胞A549的凋亡水平为(8.3±1.8)%,下降至原来的39.2%(t=3.313,P<0.05);抑制miR-623后,发现非小细胞肺癌细胞A549的凋亡水平为(70.6±8.9)%,上升至原来的3.3倍(t=7.764,P<0.05)。
2.2 miR-623与DNM2的相关性 通过miRDB在线分析,发现miR-623潜在靶向TRIM44、FOXN2、PTPRD、KLF3、DNM2、EPHB6、APEM2、BIRC2、PHF6和FBN2。过表达miR-623后,发现与对照组相比,非小细胞肺癌细胞A549中DNM2的表达水平下降至原来的35.0%(t=5.418,P<0.05),而TRIM44、FOXN2、PTPRD、KLF3、EPHB6、APEM2、BIRC2、PHF6和FBN2的表达水平均无显著变化(P值均>0.05),见表1。抑制miR-623后,发现与对照组相比,非小细胞肺癌细胞A549中DNM2的表达水平上升至原来的1.47倍(t=2.898,P<0.05),而TRIM44、FOXN2、PTPRD、KLF3、EPHB6、APEM2、BIRC2、PHF6和FBN2的表达水平均无显著变化(P值均>0.05),见表2。通过荧光素酶报告实验发现miR-623靶向DNM2的3'端非编码区,见图1。
表1 过表达miR-623后2组相关基因的相对表达水平(±s)
基因 对照组相对表达水平miR-623过表达组相对表达水平 t值 P值TRIM44 1.05±0.30 1.01±0.22 0.232 8 0.827 4 FOXN2 0.65±0.12 0.55±0.02 1.424 0 0.227 6 PTPRD 1.49±0.40 1.44±0.32 0.169 1 0.874 0 KLF3 0.95±0.29 0.99±0.30 0.166 0 0.876 2 DNM2 1.42±0.31 0.42±0.10 5.317 1 0.006 0 EPHB6 1.48±0.39 1.44±0.39 0.125 6 0.906 1 AP3M2 0.41±0.10 0.45±0.09 0.515 0 0.633 7 BIRC2 2.09±0.53 2.08±0.52 0.023 3 0.982 5 PHF6 0.49±0.11 0.51±0.10 0.233 0 0.827 2 FBN2 0.29±0.08 0.33±0.05 0.734 4 0.503 4
表2 抑制miR-623后2组相关基因的相对表达水平(±s)
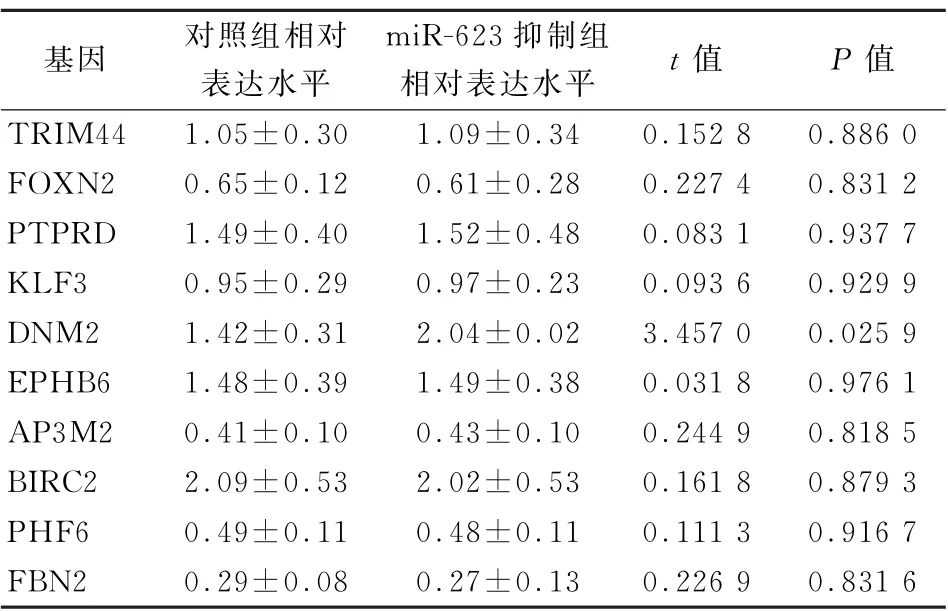
表2 抑制miR-623后2组相关基因的相对表达水平(±s)
基因 对照组相对表达水平miR-623抑制组相对表达水平 t值 P值TRIM44 1.05±0.30 1.09±0.34 0.152 8 0.886 0 FOXN2 0.65±0.12 0.61±0.28 0.227 4 0.831 2 PTPRD 1.49±0.40 1.52±0.48 0.083 1 0.937 7 KLF3 0.95±0.29 0.97±0.23 0.093 6 0.929 9 DNM2 1.42±0.31 2.04±0.02 3.457 0 0.025 9 EPHB6 1.48±0.39 1.49±0.38 0.031 8 0.976 1 AP3M2 0.41±0.10 0.43±0.10 0.244 9 0.818 5 BIRC2 2.09±0.53 2.02±0.53 0.161 8 0.879 3 PHF6 0.49±0.11 0.48±0.11 0.111 3 0.916 7 FBN2 0.29±0.08 0.27±0.13 0.226 9 0.831 6
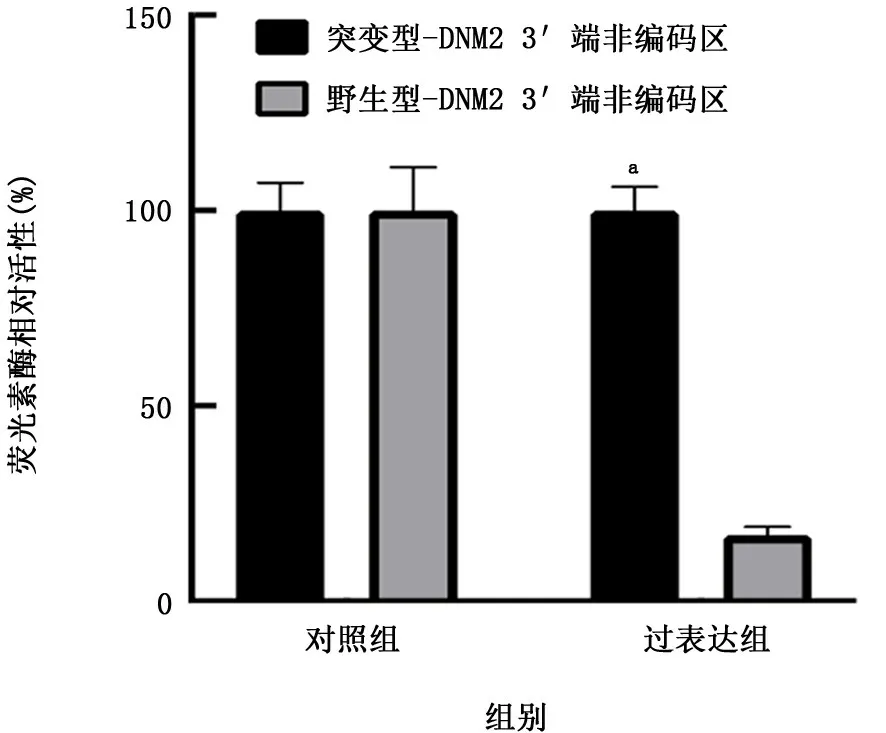
图1 miR-623对野生型或突变型DNM2 3'端非编码区活性的影响
2.3 DNM2对非小细胞肺癌细胞A549的凋亡水平的影响 通过siDNM2敲低DNM2后,发现与对照组比较,非小细胞肺癌细胞A549的凋亡下降至原来的26.7%(t=7.381,P<0.05)(图2)。

图2 敲低DNM2对非小细胞肺癌细胞A549凋亡水平的影响 A:敲低DNM2的表达情况;B:敲低DNM2后非小细胞肺癌细胞A549的凋亡情况
通过DNM2质粒过表达DNM2后,发现与对照组比较,非小细胞肺癌细胞A549的凋亡上升至原来的3.66倍(t=4.113,P<0.05)(图3)。
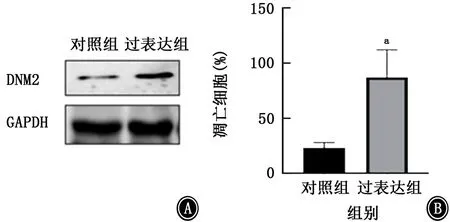
图3 过表达DNM2对非小细胞肺癌细胞A549凋亡水平的影响 A:DNM2质粒过表达后DNM2的表达情况;B:DNM2质粒过表达后非小细胞肺癌细胞A549的凋亡情况
同时敲低miR-623和DNM2,与对照组(同时转染空载体和阴性对照载体)相比,非小细胞肺癌细胞A549的凋亡水平无明显变化(t=0.626,P>0.05),见图4;同时过表达miR-623和DNM2,与对照组(同时转染siGFP和阴性对照载体)相比,非小细胞肺癌细胞A549的凋亡水平无明显变化(t=0.751,P>0.05),见图5。
3 讨论
肺癌是世界范围内最常见的癌症死亡原因之一,严重危害着人类的健康和生命[8-9]。尽管相关治疗取得了快速进展,非小细胞肺癌患者的预后仍然不容乐观[10],肺癌患者的5年生存率较低,与其他癌症相比,肺癌治疗效果有限。这种有限疗效的一个主要原因是肺癌对放疗和/或化疗的固有或获得性耐药。因此,探索新的有效的诊断和治疗靶点是很重要的。为了开发更有效的诊断和治疗技术,迫切需要更好地了解导致非小细胞肺癌癌变的分子生物学改变的遗传改变。有必要从分子水平研究肺癌细胞的抗凋亡作用,阐明肺癌的基本分子机制。因此,探索新的有效的诊断和治疗靶点是很重要的。为了开发更有效的诊断和治疗技术,迫切需要更好地了解导致非小细胞肺癌癌变的分子生物学改变的遗传改变。

图4 抑制miR-623和DNM2对非小细胞肺癌细胞A549凋亡水平的影响
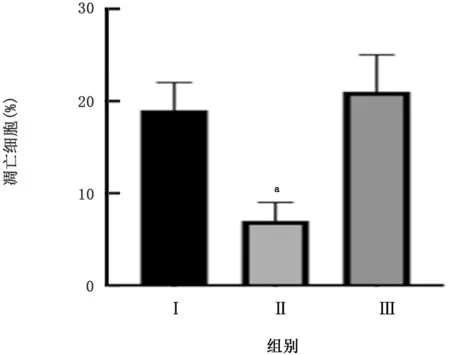
图5 过表达miR-623和DNM2对非小细胞肺癌细胞A549凋亡水平的影响
miRNAs是一类小的非编码RNA(21~25个核苷酸),其在非小细胞肺癌的几乎所有方面发挥作用,如增殖、凋亡、侵袭/转移和血管生成[11-12]。在本研究中,发现miR-623的表达能够抑制非小细胞肺癌细胞A549的凋亡,随后通过miRDB在线分析miR-623的潜在底物m RNA,发现miR-623的潜在靶标——DNM2,并通过实验验证确认了miR-623对非小细胞肺癌细胞A549中DNM2的表达抑制作用,并进一步探明miR-623对DNM2的抑制作用是通过靶向其3'端非编码区来实现的。尽管本研究通过miRDB和荧光素酶报告系统发现miR-623的底物DNM2,然而miR-623是否有其他底物,并且这些底物在非小细胞肺癌的发生、发展中是否发挥生物学功能仍然值得进一步探究。
DNM2是GTP结合蛋白的一个亚家族,在生物过程中介导膜的分裂和融合,如内吞作用、囊泡运输、细胞分裂和细胞器分裂。DNM2在胞吞作用机制中起两种作用:一种是内吞囊泡收缩的早期作用,另一种是内吞囊泡破裂的晚期作用。目前发现DNM2是网格蛋白介导的内吞作用所必需的[13]。除此之外,DNM2还参与了其他细胞过程,如:通过与肌动蛋白结合蛋白相互作用来调控肌动蛋白的组装和重组阻断Na+/H+交换器以促进心肌细胞凋亡[14]。DNM2是一种新的连接蛋白伴侣,通过一种创新的机制模型,DNM2可以控制连接蛋白43缝隙连接斑块的内陷、内吞、循环和降解[15]。此外,DNM2是氧化应激蛋白的新搭档,可能在氧化损伤过程中发挥基础性作用[16]。Fish等[17]报道,DNM2可能主要负责过表达的p53促进的凋亡,DNM2是p53上游信号通路的一部分,可以激活转录因子p53,潜在地触发凋亡。此外,Gao等[18]也发现DNM2能够促进活性氧产生和Ca2+的堆积,最后促进细胞凋亡。
本研究发现DNM2能够促进非小细胞肺癌细胞A549的凋亡,因此激活DNM2可能促进非小细胞肺癌细胞的凋亡。本研究同时发现DNM2的表达受到miR-623的负调控,抑制miR-623能够上调DNM2的表达,从而促进非小细胞肺癌细胞A549的凋亡。因此,miR-623可能是非小细胞肺癌治疗的潜在靶标,靶向miR-623可能成为治疗非小细胞肺癌患者的一种可能的替代方案。
利益冲突 所有作者均声明不存在利益冲突

