花椰菜白色花球变紫代谢物的测定及主成分分析
郎朗 牛国保 单晓政 张小丽 文正华 江汉民 刘莉莉 黄亚杰 肖瑜 张艳玲 姚星伟

摘 要:花椰菜生产中低温、高温、水分或盐分胁迫等常常导致白色花球变紫,严重时甚至完全失去商品价值,给生产造成巨大损失,迄今为止花椰菜白色花球变紫的代谢产物尚不清楚。为了深入解析花椰菜白色花球变紫机制,利用液相色谱串联质谱(LC-MS/MS)方法测定了花椰菜花球变紫前后代谢物。共检测出10种花青素成分,白色花球样本间花青素含量差异不显著,但不同程度变紫花球中花青素含量差异显著,白色与紫色样本之间花青素含量也存在显著差异。主成分分析和因子分析表明,芍药素 O-己糖苷、矢车菊素半乳糖苷和芍药素-3-O-葡萄糖甙氯化物与花球变紫的相关性较强。由此推测花椰菜白色花球变紫很可能与矢车菊合成途径密切相关。
关键词:花椰菜;花球变紫;花青素;主成分分析;因子分析
中图分类号:S635.3 文献标志码:A 文章编号:1673-2871(2021)04-057-05
Abstract: The white cauliflower curds often become purple due to low temperature, high temperature, water or salt stress, which decrease their commercial value seriously and cause huge losses for the field production. The metabolites of purplish curds in white cauliflower are not clear yet. Therefore, LC-MS / MS method was used to determine the metabolites of the purplish curds in white cauliflower. Ten anthocyanins were detected in the experiment, there was no significant difference in anthocyanin content among different white curds, but significant difference among different purplish curds, and there was also significant difference in anthocyanin content between white sample and purplish curds. Principal component analysis and factor analysis showed that paeoniflorin o-hexoside, cyanidin galactoside and paeoniflorin-3-O-glucoside chloride had a great correlation with the purplish curds in white cauliflower. The result indicated that the purplish curds in white cauliflower was closely related to the synthetic pathway of cyanidin. This study provided a reference for further research on the mechanism of purplish cauliflower.
Key words:Cauliflower; Purplish curds; Anthocyanins; Principal component analysis; Factor analysis
花椰菜營养丰富,味道鲜美,同时具有抗癌防癌的保健功能,因此深受广大消费者的喜爱[1]。我国是世界上花椰菜栽培面积和产量最大的国家,2018年我国花椰菜栽培面积54.87万hm2,约占世界栽培总面积的40%[2],花椰菜在我国蔬菜生产中占有重要地位。
花椰菜是为数不多的以花器官为食用部位的蔬菜作物之一,生长发育过程与食用叶片、果实、根等蔬菜作物相比更易受到环境影响。花椰菜生产中如遇到高温、光照[3]、水分胁迫、低温[4]等恶劣环境条件,容易出现花球变紫的现象。花球变紫显著影响花椰菜外观品质和商品价值,大大增加了农民种植风险和花椰菜生产不确定性,严重影响农民种植收益。开展花球变紫机制研究对解决该产业难题具有非常重要的意义。
花椰菜花球变紫与花青素累积密切相关。花青素含量增加是花球变紫的根本原因[5]。RAHIMM M A [6]比较了青花菜紫色和绿色花青素含量,证明紫色下胚轴花青素含量是绿色的15倍。近年来,科学家还利用分子生物学手段验证了ANS、BoMYB2、BoTT8和BoDFR等基因和转录因子与花椰菜花球紫色密切相关[6-8]。
代谢产物是基因表达的最终产物,可以最直接地反映生命现象,因此代谢组学越来越受到科学家的关注[9-10]。迄今为止还没有花椰菜花球变紫代谢产物的相关报道。为此本试验对花球变紫代谢产物进行了分析,希望为解决花椰菜变紫产业难题提供实验数据和参考。
1 材料与方法
1.1 材料
本试验材料为11和PW-161花椰菜纯合自交系,由天津科润农业科技股份有限公司蔬菜研究所提供。11为低温条件下花球易变紫色的花椰菜自交系。PW-161为低温条件下花球不变紫色的花椰菜优良自交系。11株型直立,护球性好,波浪形叶片,叶色浅绿色,花球周正、洁白、高圆,一般配合力高,低温花球变紫明显。PW-161株型半开张,椭圆形叶片,花球紧实,周正、平整,低温花球始终保持洁白不变紫色。2018年8月1日将2份材料同期播种于天津市农业科学院武清创新基地,采用穴盘播种,穴盘规格为50穴,每份材料播种100穴,每穴1~2粒。2018年9月10日待幼苗长到3叶1心时定植于天津市农业科学院武清创新基地日光温室内,株行距50 cm× 50 cm,每份材料每个小区定植30株,小区面积10 m2,定植3个小区,每份材料种植90株。2019年3月10日前后待花球成熟后(花球直径15~20 cm),分别采集材料11深紫色花球组织,11浅紫色花球组织、11未变紫色即白色花球组织以及PW-161纯白花球组织各1.0 g,置于液氮中备用。采用随机区组设计,每个处理设3次重复。
1.2 方法
将备用样本取出,真空冷冻干燥,利用研磨仪(MM400,Retsch)30 Hz 研磨1.5 min至粉末状。称取100 mg粉末,溶解于1.0 mL的70 %(φ)甲醇水溶液中,将样品置于4 ℃冰箱中12 h,期间涡旋3次,提高花青素提取率。之后将样品从冰箱中取出,离心(转速10 000 r·min-1,10 min)后,吸取上清液,用0.22 μm微孔滤膜过滤样品,并保存于进样瓶中,用于液相色谱串联质谱分析(LC-MS/MS)。
数据采集仪器系统主要包括超高效液相色谱(UltraPerformance Liquid Chromatography,UPLC)(Shim-pack UFLC SHIMADZU CBM30A)和串联质谱Tan-dem mass spectrometry MS/MS)(Applied Biosystems 4500 QTRAP)。色谱条件:①色谱柱为Waters ACQUITY UPLC HSST3 C18,1.8 ?m,2.1 mm × 100 mm。②流动相:水相为含0.04%(φ)乙酸的超纯水;有机相为含0.04%乙酸的乙晴。③洗脱梯度:0 min水/乙晴(95∶5 V/V),11.0 min为5∶95 (V/V),12.0 min为5∶95(V/V),12.1 min为95∶5 (V/V),15.0 min为95∶5(V/V)。④流速0.4 mL·min-1;柱温40 ℃,进样量5 μL。质谱条件:电喷雾离子源温度500 ℃,质谱电压5500 V,帘气25 psi(约等于172.38 kPa)。
基于数据 MWDB(metware database)以及代谢物信息公共数据库,对质谱检测的一级谱、二级谱进行定性分析,部分物质定性分析时,去除了同位素信号,含K+、Na+、NH4+的重复信号,以及其他更大分子质量物质的碎片离子重复信号。代谢物结构解析参考了MassBank(http://www.massbank.jp)、KNAPSAcK(http://kanaya.naist.jp/KNApSAcK)、HMDB(http://www.hmdb.ca)(Wishart et al. 2013)、MoTo DB(http://www.ab.wur.nl/moto/)和METLIN(http://metlin.scripps.edu/index.php)等已有质谱公共数据库。代谢物定量是利用三重四级杆质谱的多反应监测模式分析完成。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱峰进行积分校正。
1.3 数据分析
利用Aanlyst1.6.3软件对原始数据进行定性定量分析。利用MultiaQuant软件进行色谱峰积分和校正工作,每个色谱峰面积代表对应物质的相对含量,最后导出所有色谱峰面积积分数据。利用SPSS Statistics 22.0分析软件进行花青素多因素方差分析、主成分分析和因子分析。
2 结果与分析
2.1 花椰菜花球花青素相对含量分析
本次试验共检测到10种已知花青素类代谢物(表1)。
从表2可以看出,除了成分1和成分10在两个白色样本中基本没有被检测到外,其余8种花青素代谢物在所有样本中都被检测到。对不同样本间进行差异显著性分析,表明除了PW-161和11白色样本之间花青素含量没有显著差异外,其他样本之间花青素含量都存在顯著差异(表3)。从上述结果可以看出,白色花球间花青素含量差异不显著,但是在不同程度的变紫花球中花青素含量差异显著,白色样本与紫色样本之间花青素含量差异也显著。
对10种花青素成分进行差异显著性分析,表明除成分5、6和9与其他成分有显著差异外,其他成分之间花青素含量差异不显著(表4)。
2.2 花球变紫花青素代谢物主成分分析
根据特征值>1且累计方差贡献率>80%的原则,提取前两个主成分,第一主成分方差占所有主成分方差的72.28%,第二个主成分方差占所有主成分方差的14.27%,前两个主成分方差累计贡献率达到86.55%。绝大多数变量共同度都在80%以上,证明提取的公因子具有很好地解释各变量的能力(表5)。
2.3 花球变紫花青素代谢物因子分析
对白色和紫色花椰菜花球进行主成分分析方法提取公因子进行因子分析。因子得分模型如下:
F1=0.137X1+0.07X2+0.13X3-0.13X4+0.13X5+0.12X6+0.01X7+0.12X8+0.14X9+0.14X10;
F2=-0.05X1-0.54X2+0.23X3+0.07X4+0.10X5-0.23X6+0.53X7+0.120X8+0.04X9-0.03X10。
从因子得分模型可以看出,F1在成分X1、X9和X10有较大的载荷值,与对应的芍药素O-己糖苷(Peonidin O-hexoside)、矢车菊素半乳糖苷(Cyanidin 3-O-galactoside)和芍药-3-O-葡萄糖甙氯化物(Peonidin 3-O-glucoside chloride)呈正相关,可将F1定义为矢车菊素合成途径因子。F2在X2和X7中有较大的载荷值,与对应的矢车菊素 O-丁香酸(Cyanidin O-syringic acid)呈负相关;与天竺葵素-3-O-葡萄糖苷(Pelargonidin 3-O-beta-D-glucoside)呈正相关。
2.4 花球变紫花青素代谢物主成分得分
利用基迪奥生物科技有限公司云平台PCA在线分析软件绘制PCA得分图。从图1可以看出11紫色花球样本11-4、11-5、11-6聚为一类,11白色花球样本11-7、11-8、11-9聚为一类,纯白花椰菜花球样本PW-161-1、PW-161-2、PW-161-3聚为一类,花球组织紫色最明显的样本11-1、11-3聚为一类。除11-2离群明显外,各处理组间分离程度清晰。
3 讨论与结论
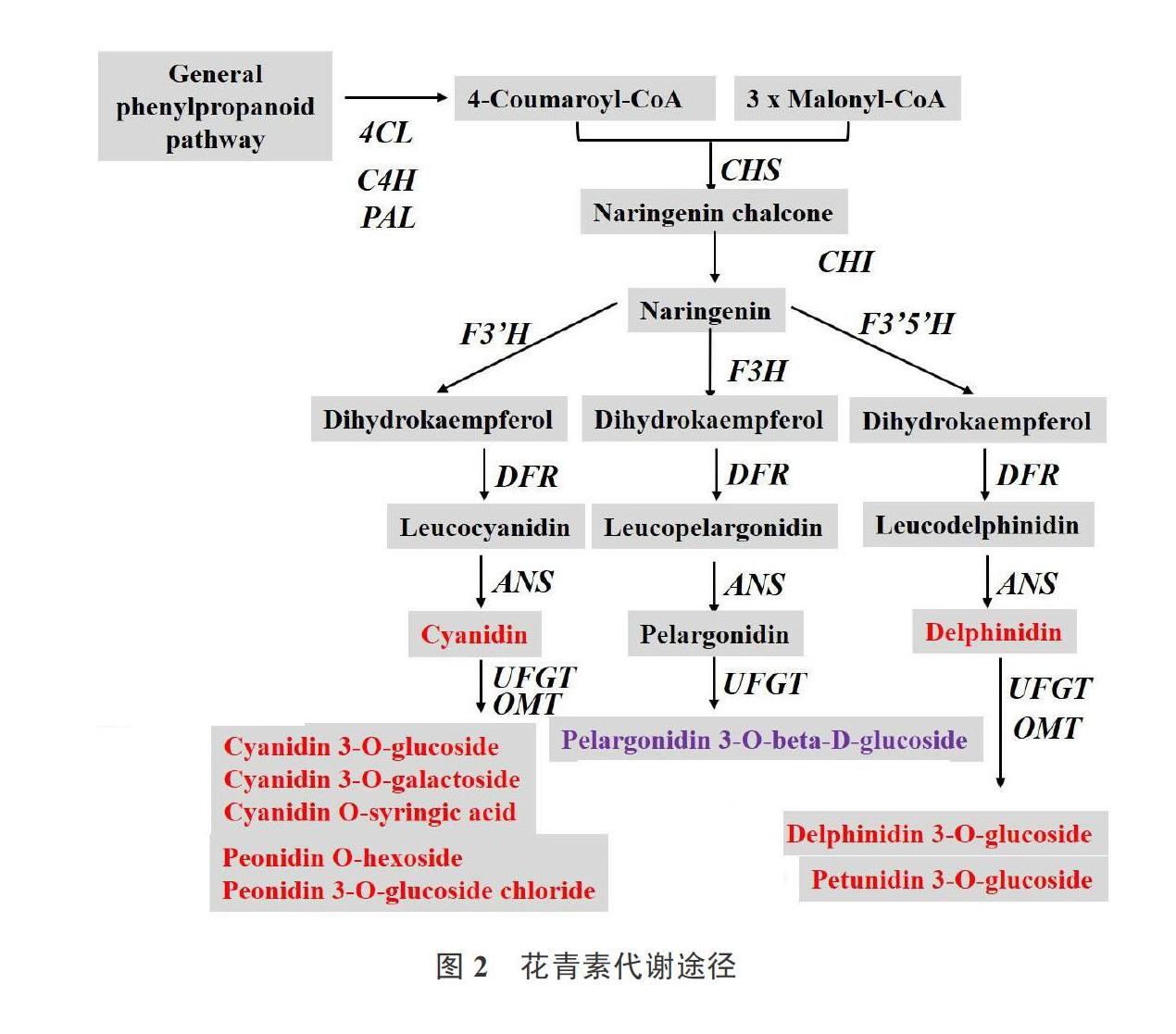
不同种类的色素使植物呈现出五彩斑斓的色彩。迄今为止已知的天然色素有500余种。花青素是一类广泛存在于植物中的重要次生代谢产物,属于类黄酮类化合物。最常见的花青素主要有6种,分别为天竺葵素(pelargonidin)、矢车菊素(cyanidin)、飞燕草素(phinidin)、芍药素(peonidin)、矮牵牛素(petunidin)和锦葵素(malvidin)[10],其中矢车菊素甲基化合成芍药素;飞燕草素甲基化合成矮牵牛素和锦葵素(图2)。花青素生物合成易受温度、光照、水分、盐分等环境因素的影响,使植物器官呈现蓝色、红色和橙色等色彩[11]。本研究通过液相色谱串联质谱分析方法(LC-MS/MS)在花椰菜花球变紫前后的不同处理中检测到矢车菊素、飞燕草色素、芍药素、牵牛花素和天竺葵素5大类花青素,其中芍药素O-己糖苷(Peonidin O-hexoside)、矢车菊素半乳糖苷(Cyanidin 3-O-galactoside)和芍药-3-O-葡萄糖甙氯化物(Peonidin 3-O-glucoside chloride)与花球变紫呈正相关,这3种成分主要与花青素的矢车菊素合成途径相关。Liu[3]分析了青花菜变紫花球中花青素成分,共检测到矢车菊素、飞燕草色素和锦葵素3种花青素,其中矢车菊素半乳糖苷(cyanidin3-O-galactoside)和矢车菊素3-O-葡萄糖(cyanidin-3-O-glucoside)含量最高,这两种花青素参与了矢车菊素合成途径;紫色花椰菜中也是以矢车菊素为主[12-13]。本试验结果表明,矢车菊及其衍生物与花椰菜白色花球变紫具有较强相关性,与前人研究类似。ANS和UFGT基因是无色花青素形成有色花青素的关键基因,逆境胁迫下ANS过表达可以增加植物的花青素含量[14-16]。本试验预测花椰菜花球变紫过程中ANS和UFGT基因起到了关键作用。后续试验计划从转录水平和基因水平对花椰菜花球变紫机制进行深入研究。本研究中第一主成分方差占所有主成分方差的72.28%,因此在评估这12个样本的分类关系时可以主要参考PC1,虽然11-2离群,但与11-1、11-3的差异主要都在PC2这个维度上,第二个主成分方差占所有主成分方差的14.319%,该主成分影响略小,11-2离群对整个试验结果影响不大,处理组间的差异大于组内差异,总体而言12个样本分类效果较好。各处理内表达模式相似,试验重复性较好。
笔者利用液相色谱串联质谱(LC-MS/MS)方法共检测出花椰菜花球变紫前后10种花青素成分,其中6种成分为矢车菊素及其衍生物,并且3种为主成分。由此推测花椰菜白色花球变紫很可能与矢车菊合成途径密切相关。本研究为深入解析花椰菜白色花球变紫机制提供了参考。
参考文献
[1] 刘莉.蔬菜营养学[M].天津:天津大学出版社,2014.
[2] 联合国粮农组织数据库[DB/OL].[2020-10-15].www.fao.org/faostat/en/#home.
[3] LIU C,YAO X Q,LI G Q,et al.Transcriptomic profiling of purple broccoli reveals light-induced anthocyanin biosynthetic signaling and structural genes[J].PeerJ,2020,8:e8870.
[4] YU H F,WANG J SH,SHENG X G,et al.Construction of a high-density genetic map and identification of loci controlling purple sepal trait of flower head in Brassica oleracea L. Litalica[J].BMC Plant Biology,2019,19(1):228-236.
[5] 姚星偉,牛国保,陈存坤.白色花椰菜花球变紫前后花青素含量变化分析[J].中国瓜菜,2020,33(4):60-63.
[6] RAHIMM M A,AFRINK K S,JUNG H J,et al..Molecular analysis of anthocyanin biosynthesis-related genes reveal BoTT8 associated with purple hypocotyl of broccoli(Brassica oleracea var. italica L.)[J].Genome,2019,62(4):253-266.
[7] CHIU L W,ZHOU X J,BURKE S,et al.The purple cauliflower arises from activation of a MYB transcription factor[J].Plant Physiology,2010,154(3):1470-1480.
[8] CHIU L W,LI L.Characterization of the regulatory network of BoMYB2 in controlling anthocyanin biosynthesis in purple cauliflower[J].Planta,2012,236(4):1153-1164.
[9] GUO N,HAN S,ZONG M,et al.Identification and differential expression analysis of anthocyanin biosynthetic genes in leaf color variants of ornamental kale[J].BMC Genomics,2019,20(1):564-581.
[10] CHO K,CHO K S,SOHN H B,et al.Network analysis of the metabolome and transcriptome reveals novel regulation of potato pigmentation[J]. Journal of Experimental Botany,2016,67(5):1519-1533.
[11] MANETAS Y.Why some leaves are anthocyanic and why most anthocyanic leaves are red?[J].Flora,2005,201(3):163-177.
[12] SCALZO R L,GENNA A,BRANCA F,et al. Anthocyanin composition of cauliflower(Brassica oleracea L. var. botrytis)and cabbage (Brassica oleracea L. var. capitata)and its stability in relation to thermal treatment[J].Food Chemistry,2008,107(1):136-144.
[13] SINGH S,KALIA P,MEENA R,et al.Genetics and expression analysis of anthocyanin accumulation in curd portion of sicilian purple to facilitate biofortification of Indian cauliflower[J].Frontiers in Plant Science,2020,10:1766-1779.
[14] 潘曉琴,宋世威.光环境影响植物花青素生物合成研究进展[J].植物学研究,2019,8(2):118-125.
[15] AHMED N,PARK J,JUNG H,et al.Anthocyanin biosynthesis for cold and freezing stress tolerance and desirable color in Brassica rapa[J].Functional & Integrative Genomics,2015,15(4):383-394.
[16] CRIFO T,PETRONE G,CICERO L L,et al.Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J].Journal of Agricultural and Food Chemistry,2012,60(1):476-481.

