饲料添加β-1,3-葡聚糖对凡纳滨对虾生长性能、血清代谢、免疫相关基因表达和抗亚硝酸氮应激能力的影响
赵红霞 陈 冰 * 莫文艳 黄 文 , 黄燕华 曹俊明 *
(1. 广东省农业科学院动物科学研究所, 广州 510640; 2. 农业农村部华南动物营养与饲料重点实验室, 广州 510640;3. 广东省畜禽育种与营养研究重点实验室, 广州 510640; 4. 广州飞禧特生物科技有限公司, 广州 510640)
凡纳滨对虾(Litopenaeus vannamei), 俗称南美白对虾, 具有环境适应性强、生长速度快、养殖周期短和市场需求量大等优点, 是我国养殖范围最广和产量最高的对虾种类[1]。然而, 随着对虾集约化养殖的迅速发展, 养殖水环境恶化和病害频发等诸多问题日益严峻, 严重影响了对虾养殖业的可持续发展。通过在饲料中添加功能性添加剂促进凡纳滨对虾营养物质代谢和免疫抗氧化功能是提高生长和抗病抗应激能力的重要途径[2,3]。β-1,3-葡聚糖作为一种免疫增强剂已广泛应用在水产养殖业中,并取得了显著成效。在饲料中添加β-1,3-葡聚糖能够促进凡纳滨对虾生长性能、提高免疫功能和抗环境应激能力[4]。
免疫刺激剂在生长和免疫反应中发挥重要作用, 但其作用效果与其添加剂量和时间相关。β-葡聚糖的添加剂量以0.1%—1%效果最佳, 高剂量可能降低鱼虾免疫力, 并产生免疫疲劳[5—8]。免疫刺激剂具有较短时间持续作用, 长期添加β-葡聚糖可能导致对虾产生免疫疲劳[9—12]。斑节对虾(Penaeus monodon)摄食含葡聚糖饵料3d即可显著提高酚氧化酶活性、血细胞总数和血细胞对哈维弧菌(Vibrio harveyi)的吞噬活力[10]。β-葡聚糖投喂斑节对虾亲虾24h后其白细胞吞噬活性大大增强, 超氧阴离子产量增加, 这种免疫作用可持续40d[11]。采用0.2%β-葡聚糖投喂凡纳滨对虾40d, 盐度应激24h后对虾酚氧化物酶水平下降, 可能与免疫疲劳有关[12]。长期连续摄食免疫刺激剂可能造成动物生理的应激, 影响生长、营养物质代谢或抗病抗胁迫能力。因此, 本实验观察了持续或间隔投喂β-1,3-葡聚糖84d对长期养殖凡纳滨对虾生长、血清代谢、免疫相关基因表达和抗亚硝酸氮应激能力的影响, 以期为β-1,3-葡聚糖在对虾饲料中的精准使用提供理论依据。
1 材料与方法
1.1 实验饲料
以鱼粉和大豆浓缩蛋白等为主要蛋白源, 鱼油为主要脂肪源, 玉米淀粉为主要糖源配制等氮等能的基础饲料, 饲料配方及化学组成如表 1所示。在基础饲料中添加0.1% β-1,3-葡聚糖(Sigma公司, 纯度>99.0%), 配制1种实验饲料。实验按照不同投喂方式分为4个饲料组, 分别为: (1)对照组(G0): 基础饲料, 持续投喂84d; (2)处理组1(G1): 0.1%β-1,3-葡聚糖饲料, 持续投喂84d; (3)处理组2(G2): 0.1%β-1,3-葡聚糖饲料7d +基础饲料7d, 循环投喂84d。(4)处理组3(G3): 0.1%β-1,3-葡聚糖饲料14d+基础饲料14d, 循环投喂84d。饲料原料过60目筛粉碎, 混合均匀后用SLX-80型挤压机制成直径为1.0 mm的颗粒饲料, 在45℃下烘干。自然冷却后放入密封袋中于–20℃冰箱中保存待用。
1.2 实验虾与饲养管理
养殖实验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统中进行。养殖系统由圆柱形玻璃纤维桶(直径80 cm, 高70 cm)组成, 容水量300 L。实验用凡纳滨对虾先在室外循环水泥池中驯养2周, 期间投喂基础饲料。实验开始前禁食24h, 选取初始体均重为(0.43±0.01) g的凡纳滨对虾幼虾480尾, 随机分为4组, 每组设4个重复,每个重复40尾虾, 分别以不同周期投喂2种饲料, 实验期为12周。实验期间定量投喂, 每日分别在09:00、14:30和20:30分3次投喂, 日投喂量为体重的4%—6%, 根据摄食情况调整投喂量。每天观察虾体健康状况, 记录死亡情况。养殖用水为进水速率为1.5 L/min的曝气自来水, 每天对养殖水体进行3次监测, 实验期间盐度5‰—6‰, 水温27—31℃,氨氮<0.20 mg/L, 亚硝酸盐<0.01 mg/L, 溶氧>6.0 mg/L, pH 7.5—7.9。实验期间采取自然光源, 时间为2019年7月14日至2019年9月7日, 地点为广州市天河区五山。
1.3 样品采集
在饲养实验结束前, 禁食24h, 统计每桶对虾的存活数, 称量每桶虾体重, 计算末体重、特定生长率和存活率。每桶随机选取3尾置于–20℃保存, 用于检测全虾体组成。以无菌的1 mL注射器及针头自围心腔取血, 置于Eppenddorf离心管中, 静置2h,3000 r/min离心10min, 取上清液作为待测血清,–78℃冷冻保存备用。采血后的对虾在冰盘上采集肌肉, 迅速投入液氮中速冻, 保存于–78℃冰箱用于肌肉血蓝蛋白(Haemocyanin)、脂多糖/ß-1,3-葡聚糖结合蛋白(LPS/b-glucan binding protein, LGBP)、抗菌肽(Penaedin-3)、酚氧化物酶原(Prophenoloxidase, proPO)、丝氨酸蛋白酶(Serine proteinase, SP)和超氧化物歧化酶(Superoxide dismutase, SOD)mRNA表达的分析。
1.4 亚硝酸氮应激实验
在12周的饲养实验结束后, 每组保留60尾对虾进行应激实验。应激实验停止循环水, 每个实验组设4个应激实验缸, 应激持续120h, 应激源为亚硝酸钠(NaNO2)。150 L水体加入NaNO2, 使氮浓度达到20 mg/L。实验期间继续投喂实验饲料, 观察并记录各组对虾0、24h、48h、72h、96h和120h内死亡情况, 计算120h内的累计死亡率。和应激实验结束后, 采集对虾血清和肌肉样品, 置于–78℃冰箱冷冻保存备用。
累计计死亡率(Cumulative mortality rate,CMR,%)=应激后实验鱼死亡尾数/应激前实验鱼尾数×100
1.5 指标测定
生长性能计算增重率(Weight gain rate,WGR,%)=100×(终末体重-初始体重)/初始体重; 特定生长率(Specific growth rate,SGR, %/d)=100×(ln终末体重-ln初始体重)/饲养天数; 存活率(Survival rate,SR, %)=100×实验结束时虾尾数/实验开始时放虾尾数。
实验饲料和实验虾营养成分测定实验饲料和实验虾全虾营养成分测定参照AOAC(1984)[13]方法。水分含量采用105℃烘箱(HDG-9203A, 上海一恒科学仪器有限公司)烘干至恒重测定, 粗蛋白质含量采用凯氏自动定氮仪(KDN-103F, 上海纤检仪器有限公司)测定, 粗脂肪含量采用索氏抽提仪(SXT-06, 上海洪纪仪器设备有限公司)测定, 粗灰分含量采用550℃灼烧法(SX410, 天津泰斯特仪器有限公司)测定。
血清代谢指标分析血清总蛋白(Total protein, TP)、葡萄糖(Glucose, GLU)、胆固醇(Cholesterol, CHO)、甘油三酯(Triglyceride, TG)、乳酸盐(lactate)含量及谷草转氨酶(Glutamic oxaloacetic transaminase, GOT)和谷丙转氨酶(Glutamic-pyruvic transaminase, GPT)活性采用Beckman Synchron CX5全自动生化分析仪测定。
基因mRNA表达量分析取对虾肌肉组织在液氮中充分研磨成粉状, 加入裂解液按TaKaRa RNA提取试剂盒操作步骤提取总RNA。采用实时荧光定量PCR测定对虾肌肉LGBP、Haemocyanin、Penaedin-3a、proPO、SP和SOD mRNA相对表达量, 以β-肌动蛋白(β-actin)为内参基因。根据对虾上述6种基因的cDNA序列利用Primer5.0软件设计实时荧光定量PCR特异引物(表 2)。实时荧光定量PCR(SYBR Premix ExTaqII, TaKaRa, 大连)扩增程序为93℃预变性3 min, 40个循环包括93℃ 30s,55℃ 45s, 72℃ 45s。采用2−ΔΔCt法分析基因相对表达量[14]。
1.6 数据分析
实验结果用平均值±标准误表示, 采用SPSS11.5软件进行数据分析和统计, 先对数据作单因素方差分析(One-way ANOVA), 若组间差异显著, 再用Duncan氏多重比较。显著性水平为P<0.05。
2 结果
2.1 凡纳滨对虾生长性能
如表 3所示, G0、G1、G2和G3组凡纳滨对虾的终末均重、特定生长率和存活率没有显著性差异(P>0.05)。
2.2 凡纳滨对虾肝胰腺消化酶活性
由表 4可知, G3组凡纳滨对虾肝胰腺的蛋白酶活性显著高于G1组(P<0.05)。G2和G3组凡纳滨对虾肝胰腺的脂肪酶活性显著高于G0和G1组(P<0.05)。各实验组凡纳滨对虾肝胰腺的淀粉酶活性没有显著性差异(P>0.05)。
2.3 凡纳滨对虾体成分
如表 5所示, G0、G1、G2和G3组凡纳滨对虾的全虾水分、粗蛋白质、粗脂肪和灰分含量没有显著性差异(P>0.05)。
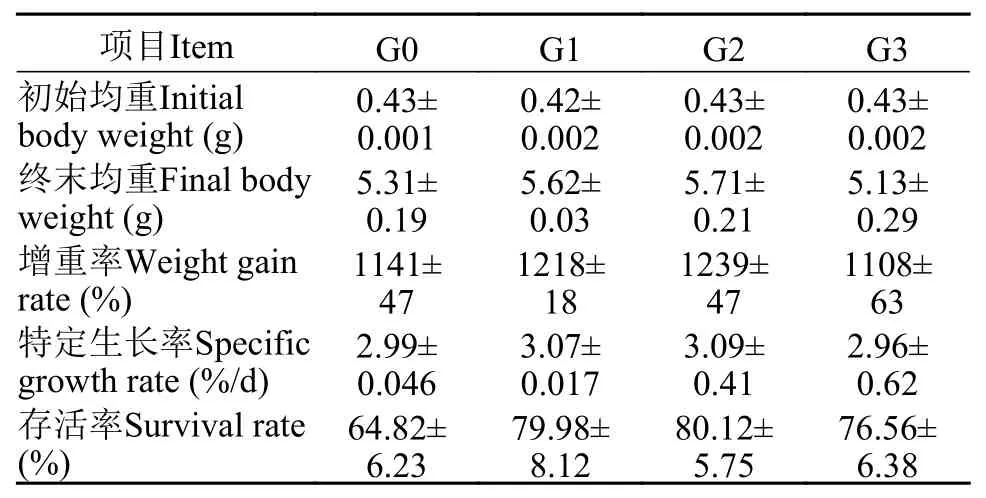
表 3 β-1,3-葡聚糖对凡纳滨对虾生长性能的影响Tab. 3 Effects of dietary β-1,3-glucan on growth performance of litopenaeus vannamei
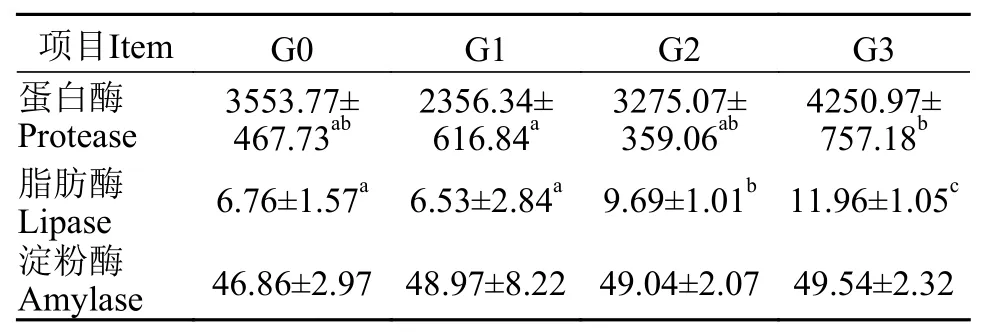
表 4 β-1,3-葡聚糖对凡纳滨对虾肝胰腺消化酶活性的影响Tab. 4 Effects of dietary β-1,3-glucan on activities of digestive enzymes in hepatopancreas of Litopenaeus vannamei (U/mg prot)
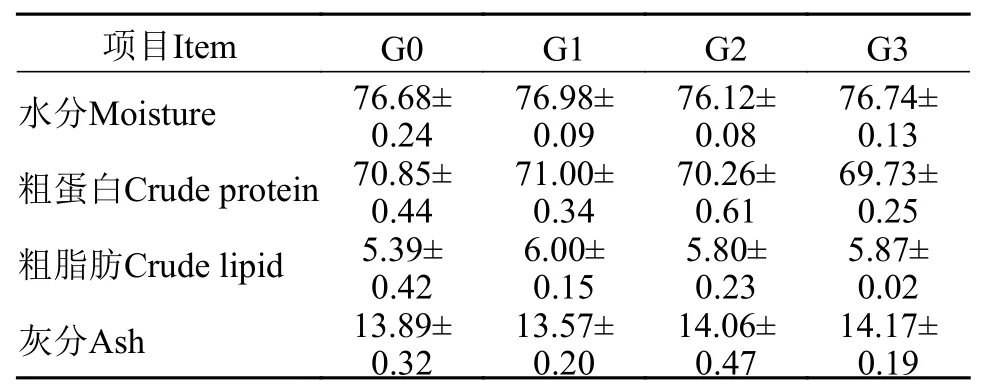
表 5 β-1,3-葡聚糖对凡纳滨对虾体成分的影响(%DM)Tab. 5 Effects of dietary β-1,3-glucan on body composition of Litopenaeus vannamei
2.4 亚硝酸氮应激120h累计死亡率
如图 1所示, 亚硝酸氮应激120h, G1、G2和G3组凡纳滨对虾累计死亡率显著低于G0组(P<0.05), G3组凡纳滨对虾累计死亡率显著低于G0、G1和G2组(P< 0.05)。
2.5 凡纳滨对虾应激前后血清代谢指标
如图 2所示, 在养殖84d后, G1、G2和G3组凡纳滨对虾血清CHO和TG含量显著高于G0组(P<0.05)。各实验组凡纳滨对虾血清TP、GLU、LD、GOT和GPT活性无显著差异(P>0.05)。亚硝酸氮应激120h后, G1、G2和G3组凡纳滨对虾血清TP含量显著高于G0组(P<0.05)。G1和G3组凡纳滨对虾血清乳酸盐含量显著高于G0组(P<0.05)。凡纳滨对虾血清葡萄糖含量、谷丙转氨酶和谷草转氨酶活性在G0组达到最高, 显著高于G1、G2和G3组(P<0.05)。各实验组凡纳滨对虾血清CHO和TG含量无显著差异(P>0.05)。
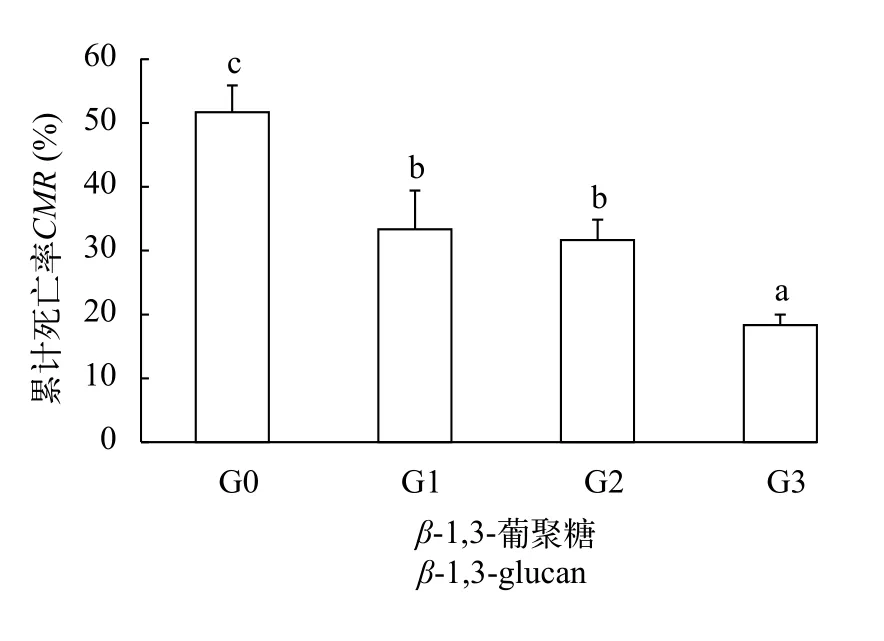
图 1 β-1,3-葡聚糖对凡纳滨对虾抗亚硝酸氮应激能力的影响Fig. 1 Effects of dietary β-1,3-glucan on anti- nitrite-nitrogen stress ability of Litopenaeus vannamei
2.6 凡纳滨对虾应激前后免疫相关基因表达
如图 3所示, 在养殖84d后, G3组凡纳滨对虾肌肉LGBP和proPO mRNA表达显著高于G0、G1和G2组(P<0.05)。G3组凡纳滨对虾肌肉SOD mRNA表达显著高于G0和G1组(P<0.05)。在各实验组中凡纳滨对虾肌肉Haemocyanin、Penaedin-3a和SP mRNA表达量无显著差异(P>0.05)。在亚硝酸氮应激120h后, G3组凡纳滨对虾肌肉LGBP和proPO mRNA表达显著高于G0和G1组(P<0.05)。G1组凡纳滨对虾肌肉SP mRNA表达显著高于G0、G2和G3组(P<0.05)。G1、G2和G3组凡纳滨对虾SOD mRNA表达显著高于G0组(P<0.05)。各实验组凡纳滨对虾肌肉Haemocyanin和Penaedin-3a mRNA表达量无显著差异(P>0.05)。
3 讨论
研究表明, 在饲料中短期添加β-葡聚糖可以提高凡纳滨对虾生长性能[3,15]。摄食β-葡聚糖饲料56d显著提高低盐度养殖凡纳滨对虾生长性能、消化酶活性和存活率[3]。然而, 凡纳滨对虾连续摄食β-葡聚糖饲料36d造成免疫疲劳, 但间隔投喂β-葡聚糖饲料可以提高对虾免疫力[15]。在本实验中, 连续或间隔投喂β-1,3-葡聚糖84d对凡纳滨对虾生长性能和体成分没有显著影响, 但间隔投喂显著提高了凡纳滨对虾的脂肪酶活性及血清胆固醇和甘油三酯水平, 表明间隔投喂β-1,3-葡聚糖促进了对虾机体内的蛋白质和能量代谢。尼罗罗非鱼(Oreochromis niloticus)摄食实验饲料(2周、4周投喂或间隔7d投喂β-葡聚糖)56d, 对生长性能没有显著影响,但间隔投喂显著提高罗非鱼免疫功能和抗Aeromo-nas hydrophila和Flavobacterium columnare感染能力。这与本实验结果相似, 与未添加组相比, 投喂0.1% β-1,3-葡聚糖84d显著提高了对虾抗亚硝酸氮应激能力, 但14d间隔投喂β-1,3-葡聚糖组凡纳滨对虾的累计死亡率达到最低。
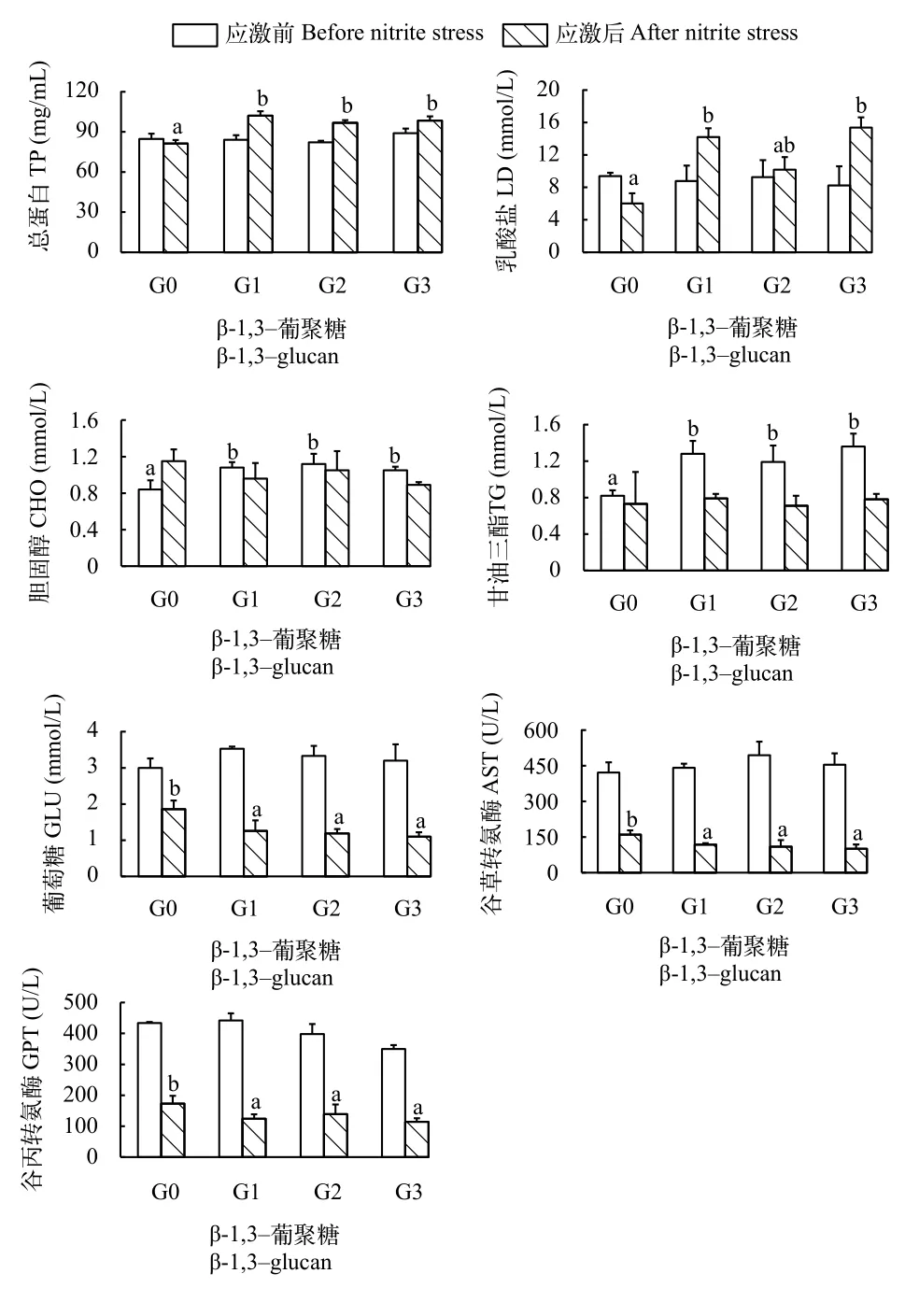
图 2 β-1,3-葡聚糖对凡纳滨对虾应激前后血清代谢指标的影响Fig. 2 Effects of dietary β-1,3-glucan on hemolymph variables before (time 0) and after (120h) nitrite stress in Litopenaeus vannamei
在高密度集约化养殖系统中, 随着对虾养殖密度的增加, 过度投喂的高蛋白残饵和含氮排泄物不断沉积, 导致亚硝酸盐积累, 成为诱发疾病的主要环境胁迫因子[16]。研究表明, 亚硝酸盐随养殖周期延长而上升, 在凡纳滨对虾养成池塘中可能达到20 mg/L[17]。罗氏沼虾暴露于21 mg/L亚硝酸钠的水体120h, 死亡率50%至66.67%[18]。在本实验中,饲料中添加β-1,3-葡聚糖能够提高凡纳滨抗亚硝酸氮应激能力, 可能与β-1,3-葡聚糖对凡纳滨对虾的血清代谢和免疫功能的调节作用相关。亚硝酸盐进入虾类血淋巴, 促使氧合血蓝蛋白转化为脱氧血蓝蛋白, 导致血淋巴对氧的亲和性降低, 降低了机体的输氧能力, 同时伴随着血淋巴pH降低,对机体产生毒害作用[19]。此外还影响虾类血淋巴中含氮废物的排泄、血淋巴蛋白质水平、血淋巴渗透压和离子浓度等许多方面[19,20]。血蓝蛋白作为血淋巴蛋白的重要组成成分, 是甲壳动物的载氧蛋白, 具有载氧功能, 还具有酚氧化物酶活性、抗细菌和抗病毒活性和转运金属离子, 外界环境的变化影响血蓝蛋白的合成与代谢[21]。对虾处于应激或是饥饿、摄食不佳和蜕壳等环境中, 将消耗体内营养物质用来满足所需“额外能量”的支出,血淋巴中蛋白水平下降可能是用作能量供给[22,23]。研究发现, β-1,3-葡聚糖在消化腺中能够被葡聚糖酶降解产生能量[24]。在本实验中, 亚硝酸盐应激120h后, 0.1% β-1,3-葡聚糖连续投喂组和间隔投喂组对虾的血淋巴蛋白水平显著高于对照组, 血淋巴葡萄糖水平显著低于对照组。这可能因为β-1,3-葡聚糖在消化腺中降解产生能量, 促进甘油三酯、胆固醇和葡萄糖代谢, 用于满足应激过程中机体增加的能量需求, 从而避免了饲料蛋白质作为能量的消耗。乳酸盐是甲壳动物在低氧或缺氧状态下的主要厌氧产物[25]。从缺氧状况下恢复时, 乳酸盐水平首先得到提升, 但机体不能分泌产生乳酸盐, 它必须通过糖质异生途径缓慢地重新代谢。在亚硝酸氮应激120h后, 摄食葡聚糖的凡纳滨对虾血清乳酸盐水平上升, 表明葡聚糖通过增强亚硝酸氮应激后的厌氧代谢, 进一步促进了机体的能量代谢。谷丙转氨酶和谷草转氨酶是广泛存在于动物组织细胞线粒体内的重要氨基转移酶, 当组织中毒发生病变,或受损伤组织范围较大, 可引起血清中这两种酶浓度上升或活性增强[26]。本研究结果显示, 亚硝酸盐应激120h后, 0.1% β-1,3-葡聚糖连续投喂组和间隔投喂组对虾的血淋巴转氨酶活性显著低于对照组,表明在饲料中添加β-1,3-葡聚糖减少了亚硝酸氮应激造成的机体损伤。
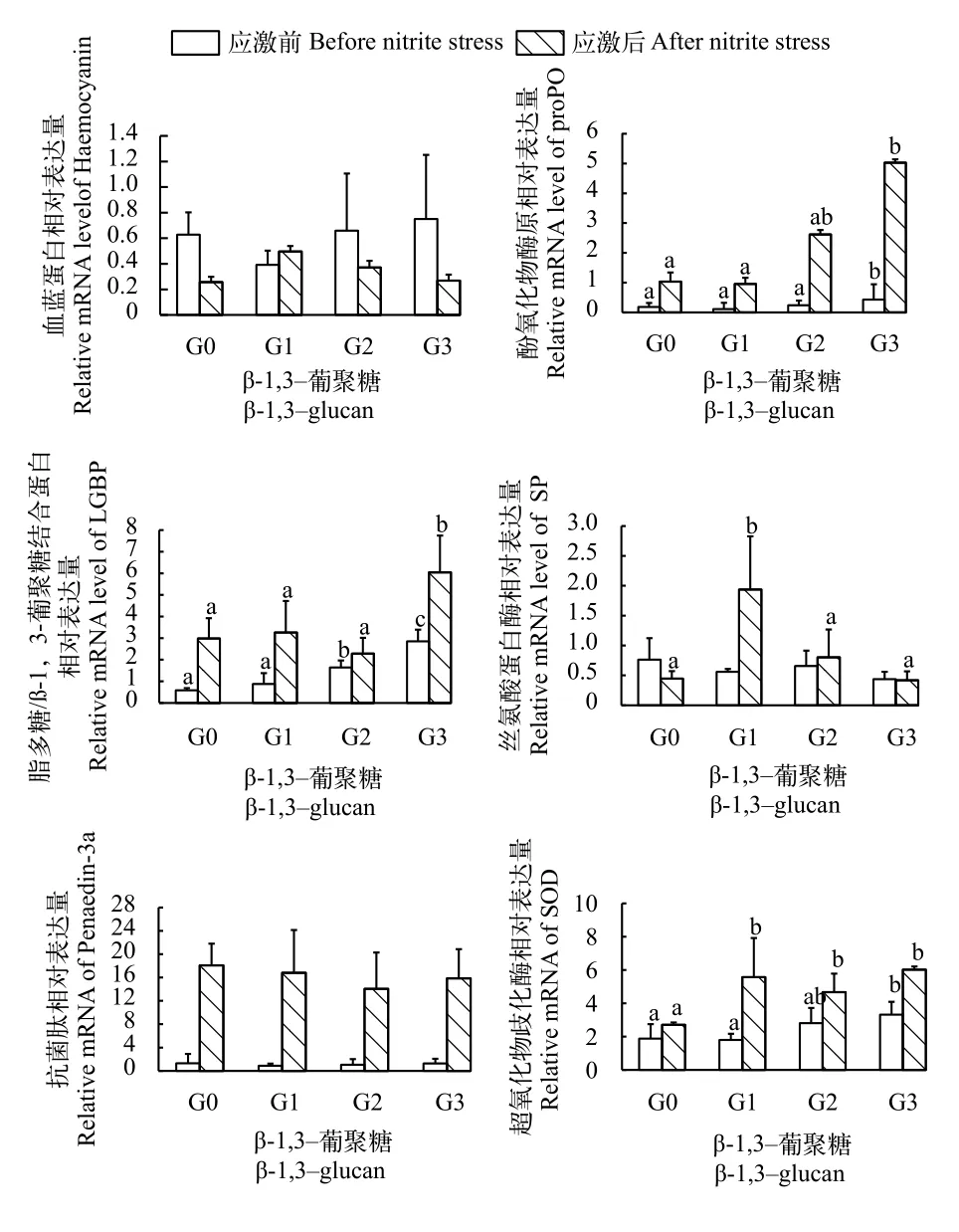
图 3 β-1,3-葡聚糖对凡纳滨对虾应激前后肌肉免疫相关基因表达的影响Fig. 3 Effects of dietary β-1,3-glucan on expression of immunerelated genes in muscle before (time 0) and after (120h) nitrite stress in L. vannamei
β-1,3-葡聚糖通过结合甲壳动物的模式识别受体β-1,3-葡聚糖结合蛋白(BGBP)而连接到血淋巴颗粒细胞膜表面发生反应, 使颗粒细胞释放出丝氨酸,丝氨酸继续激活酚氧化酶原发生级联放大反应, 使酶原变为具有活性的酚氧化酶, 反应产生大量黑色素和醌过氧化物等活性物质, 杀灭病原菌[27]。脂多糖-β-1,3-葡聚糖结合蛋白是一种多功能的模式识别受体, 能够识别革兰氏阴性菌的细胞壁成分脂多糖和真菌的细胞壁成分β-1,3-葡聚糖[28]。丝氨酸蛋白酶在级联放大反应中作为重要调控因子参与免疫反应。超氧化物歧化酶是生物体抗氧化防御系统重要的酶类, 清除体内活性氧自由基, 保护细胞膜及细胞内的核酸免受氧化应激的损害。饲料中加益生菌显著提高凡纳滨对虾抗副溶血弧菌感染的能力和上调对虾感染副溶血弧菌后先天免疫缺陷基因、抗菌肽、酚氧化酶原和溶菌酶mRNA表达[29]。凡纳滨对虾摄食蜈蚣藻多糖饲料显著提高肝胰腺血蓝蛋白、酚氧化酶原和热休克蛋白70基因mRNA表达量[30]。在本实验中, 14d间隔投喂0.1% β-1,3-葡聚糖显著上调凡纳滨对虾在亚硝酸氮应激前后的肌肉脂多糖/β-1,3-葡聚糖结合蛋白、酚氧化化酶原和超氧化物歧化酶表达, 表明β-1,3-葡聚糖通过刺激凡纳滨对虾的免疫相关基因的表达, 提高其抗亚硝酸氮应激能力。与本实验结果相似, Soraat等研究不同投喂方式对罗非鱼免疫功能和抗Aeromonas hydrophila和Flavobacterium columnare感染能力的影响, 认为β-葡聚糖间隔投喂方式是最佳施加方法。斑节对虾摄食含褐藻酸钠饲料能够显著上调LPS/β-1,3-葡聚糖结合蛋白、超氧化物歧化酶和抗菌肽 mRNA表达, 但对酚氧化酶原没有影响[31]。在本实验中, 在饲料中添加0.1% β-1,3-葡聚糖对凡纳滨对虾肌肉血蓝蛋白和抗菌肽基因表达没有显著影响, 可能β-1,3-葡聚糖主要是通过作用于模式识别受体和抗氧化物酶基因发挥作用。
4 结论
在84d养殖实验后, β-1,3-葡聚糖持续或间隔投喂对凡纳滨对虾生长性能和体成分没有显著影响,但显著提高了凡纳滨对虾血清胆固醇、甘油三酯水平和降低凡纳滨对虾亚硝酸氮120h应激累计死亡率。7d或14d间隔投喂β-1,3-葡聚糖显著提高了凡纳滨对虾脂肪酶活性, 14d间隔投喂β-1,3-葡聚糖显著上调了凡纳滨对虾亚硝酸氮应激前后LGBP、proPO和SOD mRNA表达。饲料添加0.1% β-1,3-葡聚糖显著提高了凡纳滨对虾亚硝酸氮应激后血清TP含量, 并显著降低血清GLU含量、GOT和GPT活性。因此, 14d间隔投喂0.1% β-1,3-葡聚糖可能通过促进能量代谢和上调LGBP、proPO和SOD基因表达提高凡纳滨对虾抗亚硝酸氮应激能力。

