单唾液酸神经节苷酯对鱼藤酮诱导的大鼠中脑神经元细胞的保护作用
蒋暐卿
(上海市奉贤区古华医院老年科,上海 201499)
帕金森病(Parkinson's disease,PD)是常见的老年性神经系统变性疾病,其主要发病机制是黑质纹状体部多巴胺能神经元的变性、凋亡。目前随着老龄化进程的加剧,帕金森病患病人群在逐年增多,现阶段帕金森病的治疗以左旋多巴替代治疗为主,虽然能一定程度上减缓病程的发展但最终仍无法有效的阻止病情的最终结果。因此开发能有效的延缓病情发展甚至阻断病程的药物已相当紧迫。单唾液酸神经节苷酯是一种神经营养剂,目前已广泛的应用于脑卒中的治疗中,它可以促进神经系统的生长、分化,同时可以增强神经生长因子的活性,从而起到修复中枢神经的效果[1]。也有研究[2]认为神经节苷酯的保护神经、维持神经元活性的能力在对于帕金森病的治疗方面也有一定的作用。基于此,本研究通过鱼藤酮建立帕金森细胞模型,观察单唾液酸神经节苷酯对多巴胺细胞的保护作用,并探讨其可能的机制。
1 材料与方法
1.1 主要试剂及材料 雌性Sprague-Dawley(SD)大鼠24只,由中国科学院上海实验动物中心提供。DF12/DMEM细胞培养液、胎牛血清、胰蛋白酶、青霉素、链霉素、B27(Gibico,美国);MTT、Hoechst 33258(碧云天生物技术有限公司);异硫氰酸荧光素(FITC)和四甲基异硫氰酸罗丹明(TRITC)(Sigma,美国),加入辣根过氧化物酶标记的抗鼠抗体(cell signaling,美国);ECL显色试剂盒(Thermo,美国);鱼藤酮(Sigma,美国);单唾液酸神经节苷酯;酶标仪(Thermo,美国);倒置荧光显微镜(IX81,Olympus,日本)。
1.2 动物模型制作及分组 将24只SD大鼠随机分成随机分成正常对照组、鱼藤酮组、GM1对照组及GM1治疗组,各6只。正常对照组不予以任何处理,鱼藤酮组从实验第一日起,每日上午于大鼠背部皮下注射鱼藤酮1.5 mg/kg,GM1治疗组从实验第一日起,每日上午于大鼠背部皮下注射鱼藤酮1.5 mg/kg,15 min后腹腔注射GM1 20 mg/kg,GM1对照组从实验第一日起,每日上午腹腔注射GM1 20 mg/kg。连续注射1周,观察各组大鼠的反应情况。
1.3 中脑原代神经元培养、处理 经过1周处理后,将各组SD大鼠以10%水合氯醛麻醉,在显微镜中去软脑膜,分离腹侧中脑,剪碎,以0.05%胰蛋白酶室温消化10 min,期间不断振荡;使用含有10%胎牛血清的DF12/DMEM培养液终止反应,轻柔吹散10次/ml,静置3 min取上清细胞悬液,以1200 r/min离心5 min,去上清,沉淀加入完全培养基。经台盼蓝染色活细胞计数,以1.5×105/cm2的密度种入预先包被有D-多聚赖氨酸,并且加入完全培养基的培养板中,置37 ℃、CO2培养箱12 h后更换为无血清培养基(DF12含2%B27,青霉素和链霉素各50 U/ml),体外培养7 d,并按照A组:正常对照组;B组:鱼藤酮模型组;C组:GM1治疗组;D组:GM1对照组进行分组,用于后续实验。
1.4 MTT法检测细胞存活率 于96孔板中加入各组经过不同处理后的原代神经元培养液,每孔加入MTT液至终浓度为5 mg/ml,加入无细胞孔作为空白对照;37 ℃培养3 h后,吸除培养液,加入150 μl的DMSO振荡混匀。在酶标仪上以波长560 nm和参比波长630 nm检测每孔光密度(D)值,细胞存活率=[(实验组D值-空白组D值)-(对照组D值-空白组D值)]/(对照组D值-空白组D值)×100%。
1.5 免疫荧光染色 接种在玻片上的原代培养神经元经4%多聚甲醛固定30 min,PBS洗3×5 min,以0.2%Triton-X-100 4 ℃孵育12 min,PBS洗3×5 min,用1%山羊血清封闭液孵育30 min,之后加入一抗:兔抗TH抗体(1:200)4 ℃孵育过夜,PBS洗4×5 min,加入FITC(1:500)和TRITC标记(1:1000)的二抗混和液,室温下避光孵育3 h,去除二抗孵育液,加入Hoechst 33258染核50 s(1:300),PBS洗4×5 min,之后加入抗荧光淬灭剂,用激光共聚焦显微镜显像,荧光强度利用Image-Pro Plus软件分析。
1.6 统计学方法 所有数据以用SPSS 17.0软件包分析,计量资料采用()表示,行单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠行为学表现 各组大鼠在实验开始前均反应灵敏,摄食正常,无明显异常表现。正常对照组大鼠和GM1对照组大鼠在整个实验过程中无明显行为学无异常改变。鱼藤酮组在实验第1天注射鱼藤酮约60 min后5只大鼠出现行走缓慢、步态不稳症状,第3天3只大鼠均出现进食减少、竖尾、步态不稳加重、行走困难等现象,第4天5只大鼠均出现上述行为学表现,并随着时间推移大鼠的表现越来越明显。GM1治疗组大鼠在实验第1天无明显异常行为学改变,第3天2只大鼠出现活动减少、摄食减少,第4天相同的2只大鼠出现肢前抬举困难伴震颤、活动减少、摄食减少,但无明显竖尾、步态不稳,第7天相同的2只大鼠仍出现前肢抬举伴震颤、活动减少,但症状较前无明显加重,1只大鼠出现活动减少,但无其它行为学改变,剩余2只大鼠无明显行为学改变。
2.2 各组细胞存活率比较 MTT实验显示:正常对照组细胞存活率为96.64%,鱼藤酮组细胞存活率为48.51%,GM1治疗组细胞存活率为76.58%,GM1对照组细胞存活率为94.82%。单因素方差分析显示,鱼藤酮组细胞存活率低于正常对照组、GM1对照组,GM1治疗组细胞存活率低于正常对照组、GM1对照组,高于鱼藤酮组,差异均有统计学意义(P<0.05);正常对照组与GM1对照组细胞存活率比较,差异无统计学意义(P>0.05),见图1。
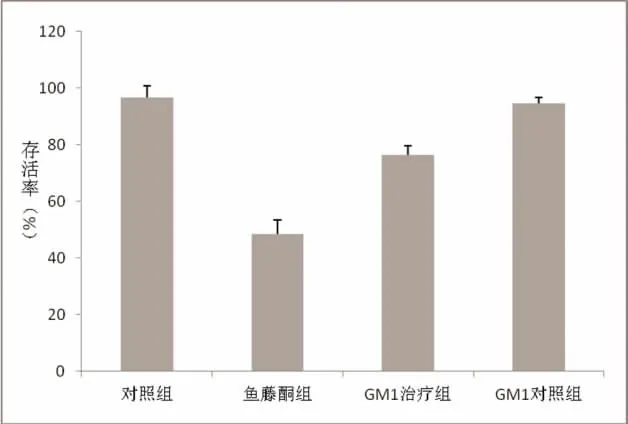
图1 各组细胞存活率比较
2.3 免疫荧光染色结果 TH免疫组化染色显示,正常对照组和GM1对照组神经元形态无损伤,神经元突触无损伤;鱼藤酮组TH阳性神经元数量减少,神经形态也严重损伤,GM1保护组TH阳性神经元的形状及突触的数目长度较鱼藤酮组改善。TH阳性神经元计数统计显示:正常对照组TH阳性细胞存活率为99.86%,鱼藤酮组TH阳性细胞存活率为46.54%,GM1保护组TH阳性细胞存活率为74.83%,GM1对照组TH阳性细胞存活率为103.65%,见图2。
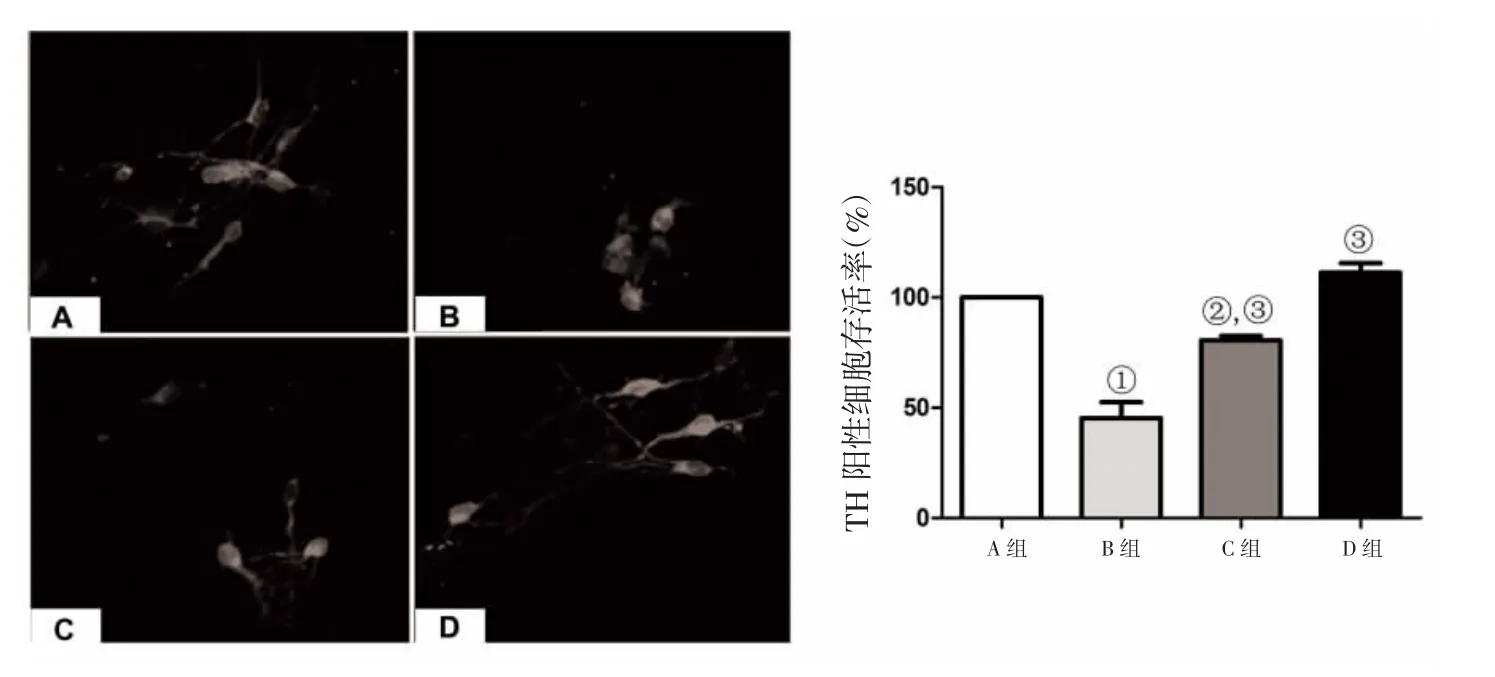
图2 免疫荧光染色结果
3 讨论
鱼藤酮是一种由天然植物鱼藤中提取的脂溶性物质,并于上世纪40年代起被广泛的当作杀虫剂在农业生产中使用,其具有很强的脂溶性,能轻易的通过血脑屏障,进入脑组织内的线粒体中,选择性的阻断铁硫簇N2与泛醌Q的作用从而抑制线粒体呼吸链,产生细胞毒性,从而导致细胞凋亡。流行病学研究显示,长期接触鱼藤酮的人群中其患PD的风险明显高于普通人群[3]。实验显示[4],鱼藤酮能使大鼠可出现类似PD的症状,而大鼠黑质区的多巴胺神经元则出现大量的死亡,残存的神经元类内出现类似路易小体的包涵体结构。说明鱼藤酮从流行病学角度和动物实验模型角度均能很好的模拟帕金森病的发生,因此其已被广泛用于制作PD模型的试剂。
本研究以鱼藤酮制备PD大鼠模型,发现鱼藤酮组大鼠明显出现类似帕金森的行为学表现,而通过MMT方法检测发现鱼藤酮组大鼠中脑神经元细胞出现凋亡,同时通过免疫荧光法发现在鱼藤酮组中,经过TH免疫组化染色的多巴胺能神经元在形态上出现损伤。
GM1是一种由单个唾液酸残基和4个己糖基构成的鞘糖脂,主要分布于神经细胞的细胞膜内,它具有保护、营养神经元细胞以及促进神经细胞轴突和突触生长等多种作用。在神经营养方面,GM1主要通过把跨膜络氨酸激酶受体A(TrkA)磷酸化将其激活,从而激活下游多种目标蛋白,发挥其生物学作用对神经细胞进行营养,促进受损的神经元进行生长,同时它还能诱导神经营养因子(NT)家族的分泌,而分泌后的NT则可以通过激活神经元本身的Trk受体,从而进行神经营养及促进神经元细胞的生长。在抗细胞氧化方面和细胞毒性方面,GM1可以通过阻止Ca2+内流,降低自由基浓度,防止膜脂质水解,抑制细胞色素C的活性和兴奋性氨基酸及花生四烯酸等的毒性作用,从而起到保护细胞作用[2]。在对抗细胞凋亡方面,GM1可以通过抑制α-突触核蛋白的异常聚集,阻断其所导致的氧化应激等反应,从而起到抗细胞凋亡的作用[7]。本研究发现,在经过GM1治疗后帕金森大鼠的行为学较鱼藤酮组改善,这与Forsayeth J等[8]的研究一致;同时,GM1治疗组中大鼠中脑神经元细胞的存活率较鱼藤酮组上升,进一步通过TH免疫组化染色后发现经过GM1保护后TH阳性神经元的形状及突触的数目长度较鱼藤酮组改善,这更为直观的说明GM1可以有效的抑制鱼藤酮导致的细胞凋亡,起到保护神经元的作用。
综上所述,GM1可缓解鱼藤酮所诱导的PD大鼠行为学改变,并通过营养神经细胞、抗细胞氧化等作用减少细胞模型中神经元细胞的损伤及变性,对神经元细胞有一定的保护作用。

