微生物法提取黄精多糖及体外降脂功能评价
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
脂代谢紊乱是一种或多种脂蛋白浓度或组成发生异常,包括总胆固醇、甘油三酯、低密度脂蛋白水平升高,或高密度脂蛋白水平不足[1]。长期脂质积累会引发代谢综合征[2]、非酒精性脂肪肝[3]、肥胖[4]、2型糖尿病[5]等全身性疾病。胆汁酸是由肝细胞中胆固醇合成的两亲性类固醇物质,胆汁酸的衍生物胆酸盐具有极强的乳化性质,有助于脂类物质在小肠内的消化吸收,胆固醇和胆酸盐直接或间接地参与机体脂类代谢[6]。降低胆固醇和胆酸盐水平可有效缓解血脂水平,降低此类疾病的发病率。通过评价样品胆固醇与胆酸盐的结合能力可以预测样品是否具有降脂潜力。临床实验中发现许多传统西药可用于血脂异常的治疗中,但普遍具有严重的副作用,例如横纹肌溶解、肌病和肝酶异常等[8]。目前迫切需要开发一种药物或营养保健食品来预防或治疗此类疾病。天然来源的植物化合物因其疗效佳和安全性高而成为治疗血脂异常的新策略,至今已经发现许多植物多糖具有药物治疗作用。
黄精为百合科黄精属多年生草本植物,又名老虎姜、鸡头参,在我国已有两千多年的栽培历史。根据原植物差异,黄精可分为姜形黄精、鸡头黄精和大黄精。中医黄精常用于治疗阴虚肺燥、干咳久咳、内热消渴及脾胃虚弱等症。李时珍在《本草纲目》中也曾记载黄精有“补诸虚、填精髓、平补气血而润”的作用[9]。黄精多糖是黄精中主要且含量最多的活性成分,研究显示其含量最高可达22%[10]。黄精多糖具有降血糖、降血脂、增强免疫功能等多种功效[11-12]。目前,各种提取方式,例如热水浸提[10]、碱提[13]、酶法提取[14-15]和超声提取[16]等,被广泛应用在植物多糖组分的提取中。而微生物发酵技术作为一种新兴的提取技术,近年来一直备受关注。微生物发酵技术借助发酵菌种对样品进行发酵处理,通常可提高植物有效成分的提取含量或达到生物转化的效果[17]。刘平平等[18]研究发现,经微生物发酵处理后不但可提高三七多糖的提取率,还增强了其抗炎功效。刘玉辉等[19]利用微生物发酵技术提取的玉米芯多糖率比未发酵提高了20.16%,同时也提高了玉米心的益生功能。
因此,本实验采用微生物发酵技术对黄精多糖的提取工艺进行优化,选择一种既能使提取含量最大化又保证了其活性功能的提取方法,为开发新型降脂药物提供理论依据。
1 材料与方法
1.1 材 料
黄精于2018年12月采自贵州省印江县(经贵州省中药材产业黄精专家组专家龙昌顺鉴定为百合科植物多花黄精的干燥根茎)。将黄精除杂烘干,粉碎,过60目筛后,将其浸泡于95%乙醇溶液12 h脱脂,置于通风处蒸干溶剂后得到脱脂原料,储存在干燥器中备用;植物乳杆菌,由东北林业大学林学院食品微生物实验室提供。
1.2 试验方法
1.2.1 试剂与设备
试剂:葡萄糖、胆固醇、牛磺胆酸钠,上海源叶生物科技有限公司;胃蛋白酶、胰蛋白酶,Biotopped公司;所有试剂均为分析纯,无需处理,可直接使用。
设备:SW-CJ-IFD超净工作台,北京思博晟达科技有限公司;HY-200标准筛(60 目),北京祥宇伟业仪器设备有限公司;JA2003分析天平,上海良平仪器仪表有限公司;DK-8D电热恒温水槽,上海森信实验仪器有限公司;RE-52旋转蒸发器,上海亚荣生化仪器公司;IS-RSDS型台式恒温振荡器,上海捷呈实验仪器有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;722s型紫外分光光度计,上海第三分析仪器厂。
1.2.2 菌种活化
将植物乳杆菌接入MRS培养基中,在37℃培养16~18 h,如此传代2次,得到活化菌种(菌落数达到1×109cfu/mL以上),备用。
1.2.3 微生物发酵法提取黄精多糖工艺的优化
1)培养基条件(原料添加量、葡萄糖添加量和接种量)对黄精多糖提取含量的影响
向装有等量蒸馏水的锥形瓶中添加一定质量分数的脱脂黄精粉(1%、3%、5%、7%、9%)和葡萄糖(0%、0.25%、0.5%、0.75%、1%)制备发酵培养基,经115℃灭菌20 min后,再以不同的接种量(v/v)(1%、3%、5%、7%、9%)接种于室温冷却后的发酵培养基中,在37℃条件下静置培养24 h后4 000 r/min离心20 min,得上清液即待测液,通过数据分析筛选出最佳的原料添加量、葡萄糖添加量和接种量。
2)发酵条件(温度和时间)对黄精多糖提取含量的影响
在上述筛选得到的最佳原料添加量、葡萄糖添加量和接种量条件下,分别在一定温度条件(31、34、37、40、43℃)和发酵时间(12、24、36、48、60 h)下对菌种进行培养,然后4 000 r/min离心20 min,得上清液即待测液,通过数据分析筛选出最佳的发酵温度和发酵时间。
1.2.4 响应面试验优化提取工艺
综合单因素实验结果,选取单因素参数范围内黄精多糖提取含量变化范围较大的因素进行响应面优化。因此,以发酵时间(A)、原料添加量(B)、葡萄糖添加量(C)、接种量(D)4个因素进行考察,以多糖提取含量为响应值,采用Design Expert 8.0.6软件Box-Behnken的中心组合设计原理建立四因素三水平的试验[20],进行二次多项回归方程拟合及其优化分析。因素水平如表1所示。
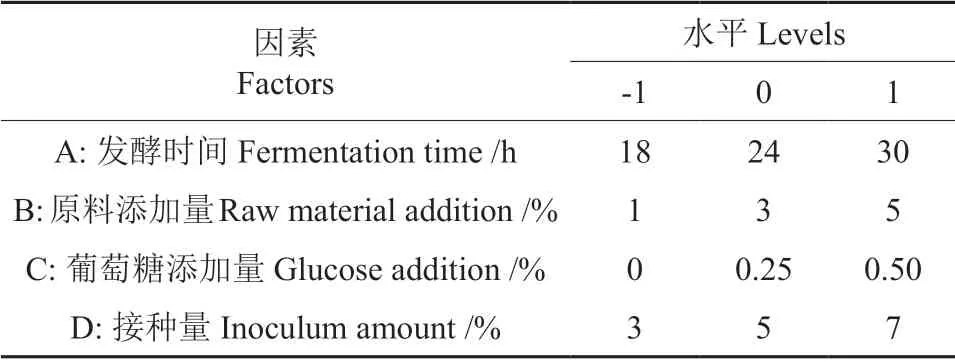
表1 响应面条件优化试验因素水平Table 1 Factors and levels of response surface optimization test
1.3 不同提取方法的比较
分别用热水浸提法、超声辅助提取法和微生物法提取黄精多糖,取3种待测液用于测定多糖提取含量;将待测液浓缩至原来体积的1/3,缓慢加入4倍于浓缩液体积的95%乙醇进行醇沉,边加边搅动,在4℃条件下静置过夜,离心弃去上清液,所得沉淀经真空干燥后用于测定胆固醇和胆酸盐的结合量。
热水浸提法采用韩春杨等[21]的提取方法并根据实际情况略作修改,具体方法如下:准确称取1.1中的脱脂原料,在料液比19∶1、提取时间3.5 h、提取温度73℃条件下对脱脂原料进行提取。
超声辅助提取法采用骆文灿等[22]的提取方法并根据实际情况略作改动,具体方法如下:准确称取1.1中的脱脂原料,在料液比18∶1、超声处理时间60 min、浸提温度73℃、超声功率153 W条件下对脱脂原料进行提取。
微生物法采用1.2.4中的最佳优化工艺。
1.4 多糖含量的测定
总糖含量的测定采用苯酚-硫酸法[23]并稍作修改,绘制标准曲线。计算回归方程为y=0.013 1x-0.037 0,R2=0.999,线性范围为10~50 μg/mL,线性关系良好。还原糖含量的测定采用DNS法[24]并稍作修改,绘制标准曲线。计算回归方程为y=1.115 7x-0.032 3,R2=0.999 7,线性范围为0.15~0.45 mg/mL,线性关系良好。其中总糖含量和还原糖含量均为提取液离心后得到的待测液中测得。公式如下:
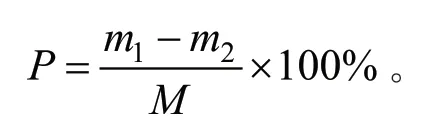
式中:P为多糖含量,%;m1为总糖含量,g;m2为还原糖含量,g;M为原料质量,g。
1.5 胆固醇结合试验
1.5.1 标准曲线的绘制
参考金秋[25]的研究方法并稍作修改,配制并移取不同梯度浓度的标准胆固醇溶液(0.05、0.075、0.100、0.125、0.150 mg/mL)0.4 mL于具塞试管中,后加入0.2 mL邻苯二甲醛溶液和混酸(V浓硫酸∶V冰乙酸=1∶1)4 mL,37℃水浴10 min,在OD550nm处测定吸光值。以胆固醇浓度为横坐标,吸光度为纵坐标,绘制标准曲线为y=3.688 0x-0.005 9,R2=0.999 0。
1.5.2 胆固醇结合量的测定
采用邻苯二甲醛法测定胆固醇含量[26]。取50 mL10 mg/mL多糖样品与100 mL 1 mg/mL胆固醇溶液混合,分别调节pH值为2和7(为模拟肠胃环境),在转速80 r/min、37℃恒温振荡2 h,取0.4 mL待测溶液加入0.2 mL邻苯二甲醛溶液和混酸(V浓硫酸∶V冰乙酸=1∶1)4 mL,37℃水浴10 min,在4 000 r/min下离心20 min,取上清液进行胆固醇的测定。计算公式如下:
C=C1-C2。
式中:C为胆固醇结合量,mg/g;C1为胆固醇加入量,mg/g;C2为胆固醇剩余量,mg/g。
1.6 胆酸盐结合试验
1.6.1 标准曲线的绘制
参考刘爽爽等[27]的方法并稍作修改,配制并移取不同梯度质量浓度的标准牛磺胆酸钠溶液(0.025 0、0.050 0、0.062 5、0.075 0、0.100 0 mg/mL)2 mL于具塞试管中,加入6 mL质量分数60%的H2SO4溶液,在70℃水浴20 min,取出后流水冷却至室温,在OD387nm处测定吸光值。以胆酸盐浓度为横坐标,吸光度为纵坐标,绘制标准曲线为y=5.272 4x+0.102 5,R2=0.990 9。
1.6.2 牛磺胆酸钠结合量的测定
取1 mL 2 mg/mL样品溶液,为模拟肠胃环境,加入1 mL HCl (0.01 mol)37℃恒温振荡1 h后,0.1 mol NaOH调pH值为6.3,随后加入4 mL 10 mg/mL胰酶(以pH值6.3的0.1 mol/L磷酸缓冲液配制)37℃恒温振荡1 h,再加入4 mL 2 mg/mL牛磺胆酸钠溶液(以pH值6.3的0.1 mol/L磷酸缓冲液配制),继续37℃振荡1 h。在4 000 r/min下离心20 min,取上清液进行胆酸盐的测定。计算公式如下:
D=d1-d2。
式中:D为牛磺胆酸钠结合量,mg/g;d1为牛磺胆酸钠初始量,mg/g;d2为牛磺胆酸钠剩余量,mg/g。
1.7 统计学分析
实验中的数据均平行测定3次,以x±s表示,基础数据统计采用Excel软件,作图采用Origin8.5软件,显著性分析采用SPSS19.0软件完成。
2 结果与分析
2.1 单因素实验结果
综合单因素试验结果发现,发酵时间、原料添加量、接种量和葡萄糖添加量对多糖提取含量影响较大,唯独发酵温度对其影响相对较小。由图1可知,随着发酵时间的延长,多糖含量不断提高,这是因为在发酵过程中菌种代谢产生强大酶系破坏植物细胞结构,提高黄精多糖溶出率。发酵24 h时,多糖含量达29.73%。继续延长发酵时间,植物多糖类化合物也可作为微生物的能源物质使多糖提取含量下降[28]。因此,确定提取黄精多糖的时间为24 h。随着原料添加量的增加,微生物发酵作用也随之增强,使多糖含量增加,当原料添加量过高时多糖含量反而降低,因为黄精作为一种药食两用中药植物,未经炮制前具有一定的刺激性和毒性[29],抑制菌种生长,造成多糖含量下降。故原料最佳添加量为3%。接种量过高或过低都会影响菌种进入对数生长期的速度,发酵初期菌种的菌龄影响整个发酵过程,因此选择合适的接种量使其在多糖提取中发挥最大作用十分重要。接种量为5%时可很好地保持菌种高度活性,此时测得多糖含量最大,故而最佳接种量为5%。发酵初期适当添加葡萄糖可缩短菌种进入稳定期的时间,有效地减少发酵时间,降低成本。但葡萄糖添加量过大时,其代谢产生的大量葡萄糖苷酶反而会造成发酵液中多糖含量大幅下降,导致不必要的浪费,故选择0.25%为葡萄糖最优添加量。发酵过程中温度升高,菌体胞内酶的活性增强,菌群保持较强活力[30],进而影响黄精多糖的提取含量。温度过高或过低都会抑制菌种的生长代谢,发酵不充分,降低多糖含量,故而选择37℃作为最佳温度。
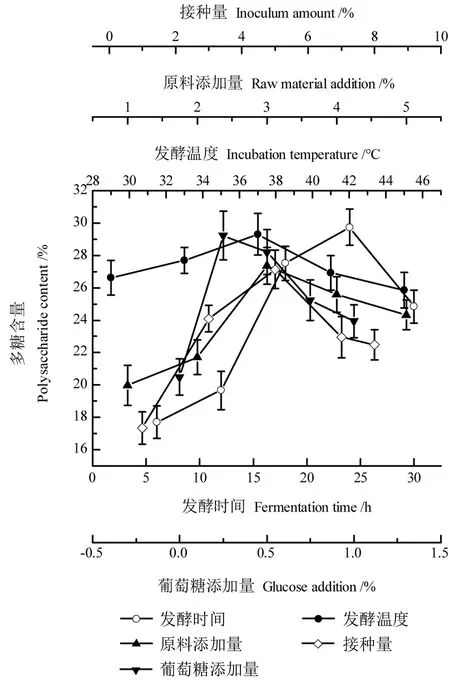
图1 单因素实验结果Fig.1 The results of complete randomalized design
2.2 响应面优化试验
在单因素的基础上,以发酵液中多糖含量(Y)为响应值,根据Box-Behnken中心组合试验设计原理,通过Design Expert 8.0.6软件设计响应面法试验,考察发酵时间(A)、原料添加量(B)、接种量(C)、葡萄糖添加量(D)4个因素对黄精发酵液中多糖含量的影响,优化方案及结果见表2。
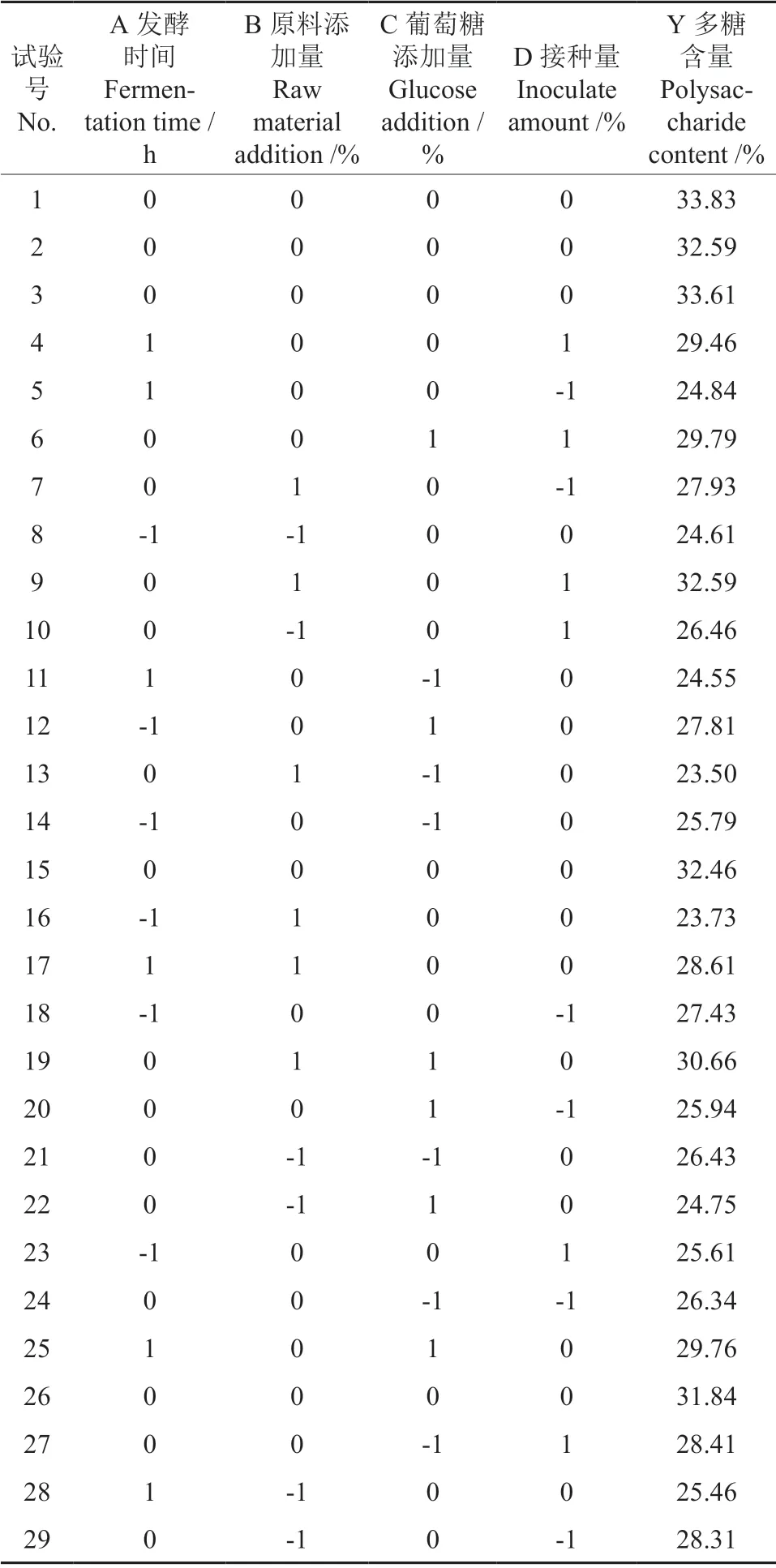
表2 中心组合试验设计方案及结果Table 2 Central composite design matrix and experimental results
2.2.1 响应面试验设计及结果
各因素经回归拟合后,解得回归方程为:

由表3可知,该回归模型的回归效果极显著(P<0.000 1),线性关系较好(R2=0.910 7)。失拟项P=0.145 2>0.05不显著,说明未知因素对试验结果的干扰较小,该试验模型充分拟合试验数据,可以用于确定提取黄精多糖的最佳工艺。由表3中F值可判断各因素对响应值的影响,结果显示:4个因素对响应值的影响大小顺序为C>D>B>A,即葡萄糖添加量>接种量>原料添加量>发酵时间。B、C、D、AD、BC、BD、A2、B2、C2、D2的P值均<0.05,其中B、D、AD、BD对黄精多糖提取含量的影响显著(P<0.05),C、BC、A2、B2、C2、D2对黄精多糖提取含量的影响高度显著(P<0.01)。
表3显示,PCD>PAC>PAB>PAD>PBD>PBC,比较P值可知接种量与葡萄糖添加量的交互作用对黄精多糖提取含量干扰最小,而葡萄糖与原料添加量的交互作用对黄精多糖提取含量干扰最大。根据发酵时间、原料添加量、接种量和葡萄糖添加量四个因素交互作用与响应值的关系得出三维响应面和等高线,结果见图2。响应面坡度越陡且等高线越接近椭圆,代表两两因素交互作用越显著[31]。由图2可知,BC曲面拱形明显更陡峭且等高线为椭圆形,其次是AD和BD,这说明葡萄糖与原料添加量交互作用最为显著(P<0.01),然后是接种量与发酵时间、接种量与原料添加量(P<0.05)。而AB、AC、CD曲面拱形不明显,等高线形状较圆润,说明发酵时间和原料添加量、葡萄糖添加量与发酵时间、接种量和葡萄糖添加量两两之间的交互作用不显著(P>0.05),与方差分析结果一致。
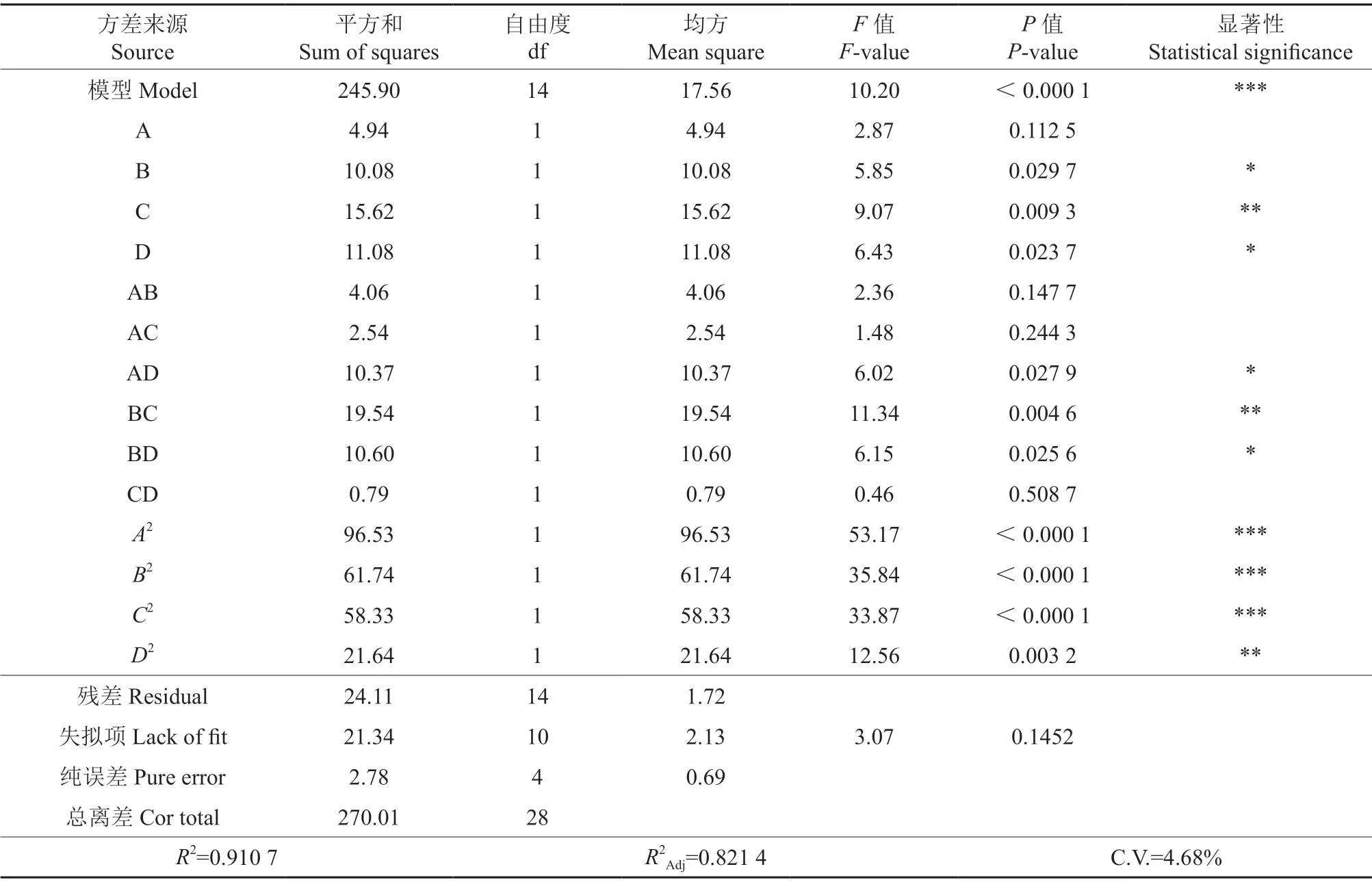
表3 回归模型的方差分析†Table 3 Results of variance analysis of regression model
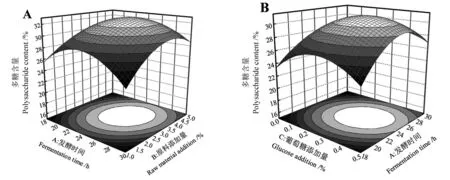
图2 不同因素对黄精多糖提取含量的影响Fig.2 Response surface and contour for interactive effects of different factors on extraction content of PSP
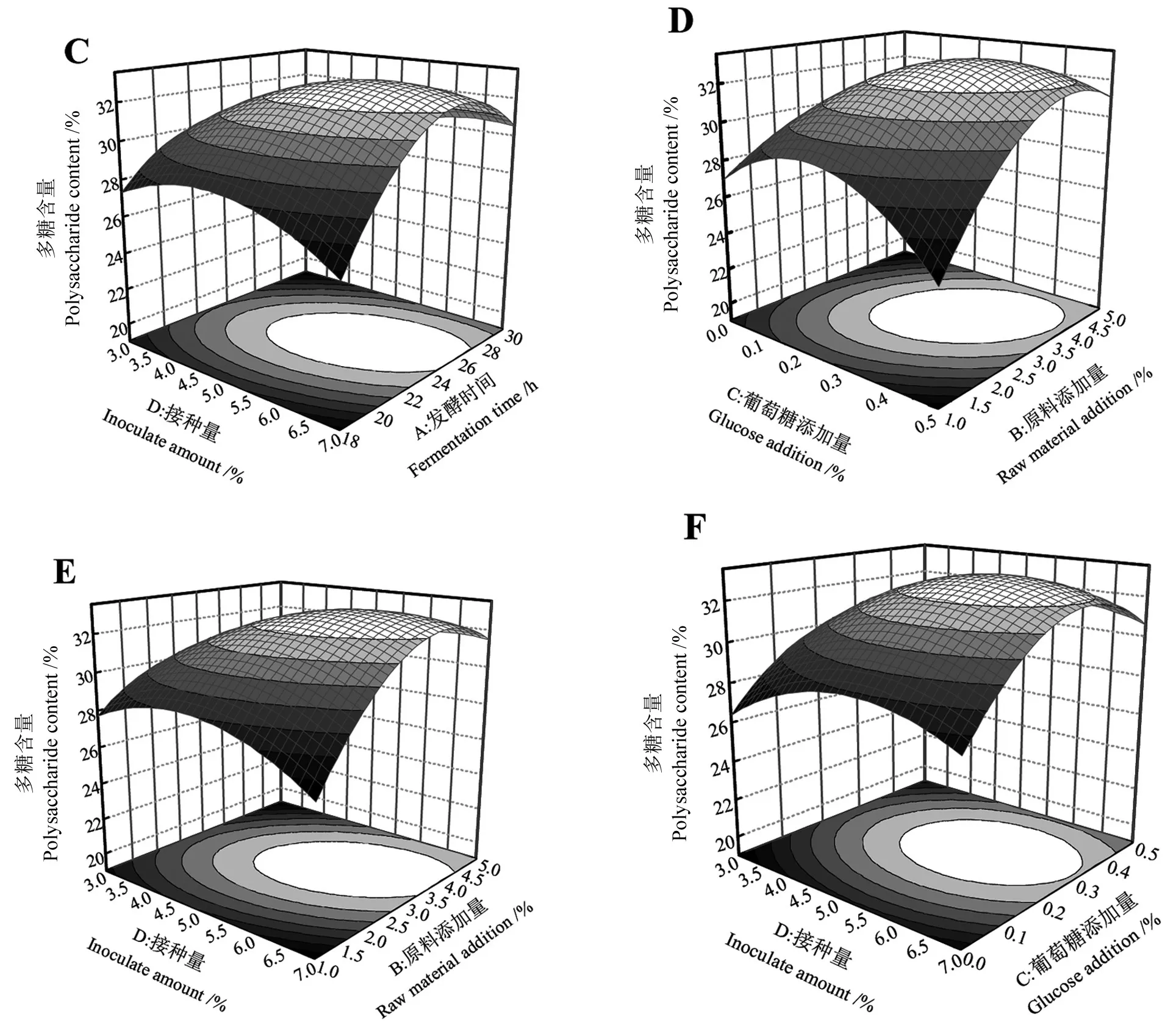
续图2Continuation of Fig.2
2.2.2 最佳工艺参数及验证
通过Design Expert 8.0.6软件分析,确定微生物发酵提取黄精多糖最佳工艺条件为:发酵时间26 h,原料添加量4%,葡萄糖添加量0.38%,接种量7%,在此优化条件下发酵液中多糖含量可达33.92%。结合实际,将工艺条件修改为:发酵时间26 h,原料添加量4%,葡萄糖添加量0.4%,接种量7%。在此优化条件下做3次平行验证试验,黄精多糖提取率实际值为33.11%,与预测值相差不大,说明响应面分析法优化得到的模型参数具有可靠性。
2.3 不同提取方法黄精多糖的提取率、胆固醇及胆酸盐结合能力的测定
人体肝脏中胆固醇分解成胆汁酸,而胆汁酸的衍生物胆汁盐具有很强的乳化脂肪的能力,可促进脂肪的消化吸收,牛磺胆酸盐是胆酸盐的主要成分之一[32-33]。许多植物多糖由于其可结合胆酸盐阻断机体对胆酸盐的重吸收作用或可将他们移除,所以具有一定的降脂作用[34]。因此,此实验对比3种提取方法的黄精多糖对牛磺胆酸钠和胆固醇的吸附能力。由表4可知,基于提取原理的差异,不同提取方法的多糖含量呈现显著差异(P<0.05)。微生物发酵技术提取的黄精多糖含量最高,可达(33.11±1.23)%;其次是超声波辅助提取法和热水浸提法,多糖含量分别为(29.72±0.84)%、(27.51±0.77)%。微生物发酵技术利用微生物代谢产生活性酶可破坏植物细胞结构的完整性,有助于活性物质溶出,与此同时也常常伴有生物转化发生,对活性成分有一定的修饰和转化作用[35]。超声辅助提取技术则是利用超声波空化效应破坏植物细胞结构的方式使更多目标物质溶出[16,22],这两种方法最终均达到了提高多糖含量的目的。另外推测微生物发酵技术中发酵菌种自身代谢产生的胞外多糖也有助于此实验中多糖含量的升高[36]。由表4还可看出,微生物发酵技术提取的黄精多糖胆固醇(pH值7)及胆酸盐结合能力显著高于其他两种方法(P<0.05),分别为96.58±0.48、297.10±0.71 mg/g;而热水浸提法提取的黄精多糖胆固醇(pH值7,pH值2)及胆酸盐结合能力显著高于超声辅助提取技术(P<0.05)。虽然超声辅助提取技术增大了黄精多糖的提取含量,但由于超声过程会引起大分子多糖发生降解,破坏了多糖结构,因此对黄精多糖的活性功能有所影响[37]。热水浸提法因其在提取过程中对样品进行长时间加热,最终造成黄精多糖提取含量损失及结构的破坏,这与其胆固醇、胆酸盐结合能力降低密切相关。因此,可推测微生物发酵技术提取条件较温和,不仅提高了黄精多糖的提取含量,还最大程度地保护了多糖结构,避免其因为高温失去活性而降低其胆固醇、胆酸盐的结合能力。
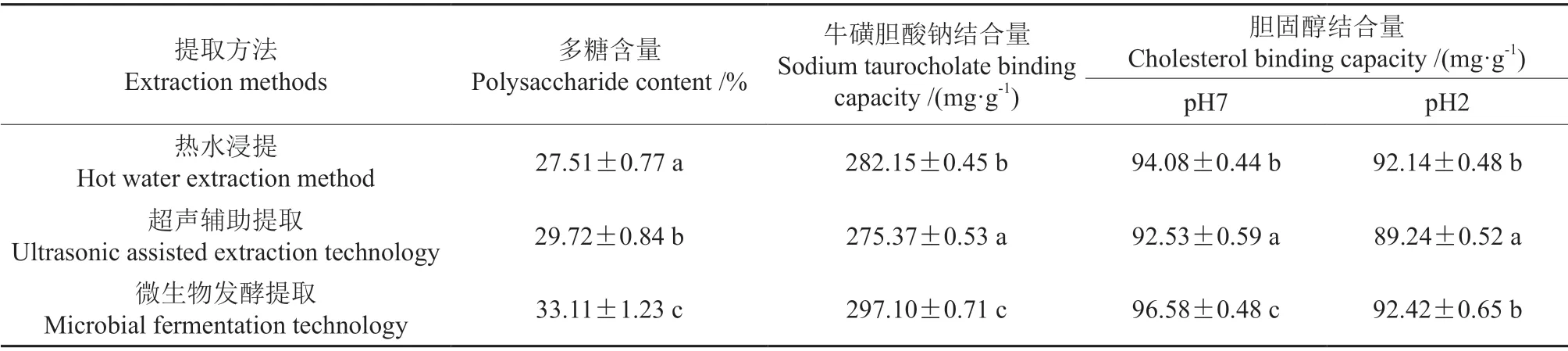
表4 不同提取方法的结果及比较†Table 4 The results of different extraction methods and comparison
3 结论与讨论
首先,此次实验以黄精多糖的提取含量为指标,通过单因素响应面试验对微生物法提取黄精多糖的提取工艺进行优化,优化后的最佳工艺条件为:发酵时间26 h,原料添加量4%,葡萄糖添加量0.4%,接种量7%,在此工艺条件下黄精多糖的提取含量为33.11%。然后,对比热水浸提法、超声波辅助提取技术及微生物法在黄精多糖提取含量、胆固醇及胆酸盐体外结合能力三方面的差异。与其他两种提取技术相比,微生物发酵技术不仅成本低廉、提取含量高,同时还能保证黄精多糖类化合物的高药理活性,使其具有明显的降脂效果。
由于微生物生长代谢促进活性成分分离,从而产生新功效,增强药用价值,微生物发酵技术开始广泛应用于植物功能性成分的开发中。植物中的有效成分大多储存在结构致密的细胞壁中,在进行植物有效成分提取时,有效成分必须穿过细胞壁和细胞间质双重阻碍,而微生物在生长、繁殖、代谢过程会分泌大量酶系,包括纤维素酶、蛋白酶、半纤维素酶、果胶酶、淀粉酶等胞外酶,可破坏细胞壁结构,进而提高植物中有效成分的溶出率,使植物中的目标组分被充分提取并利用[38]。由此可合理推测本研究利用植物乳杆菌自身生长代谢过程中产生的纤维素酶、半纤维素酶等破坏了黄精植物细胞壁的完整性,使得多糖物质大量溶出,进而提高了黄精多糖的提取含量。焦方文等[39]研究发现益生菌发酵后的炒麦芽多糖含量比发酵前增加了38.64%,此结果与本实验结果相似。有研究认为发酵后植物中的某种有效成分活性增强是因为微生物的生长代谢具有强大的分解转化能力,将许多不能被机体直接利用的大分子活性物质降解成更具活性的小分子物质[40],如有文献表明经益生菌发酵后铁皮石斛多糖的抗炎活性却有所增强,研究者推测其原因为微生物对多糖的降解作用,使其甘露糖比例显著升高引起的[41]。还有研究表明植物乳杆菌代谢产生的胞外多糖具有很强的胆固醇吸附能力[42],因此,这也可作为微生物法提取黄精多糖具有较强的胆固醇吸附能力的原因。由此可见,微生物发酵技术在天然植物化合物的提取及开发中具有良好的应用前景。
另外,本次实验仅研究了微生物发酵对黄精多糖提取率及体外降脂能力的判断,而微生物发酵技术对黄精多糖的化学结构包括单糖组成、分子量、构象等方面的影响还没有系统的研究,以及多糖分子结构与其降脂活性的关系和相关机制还有待深入探讨与分析。

