镉致PC12细胞的神经毒性
赵 静,汪惠丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
民以食为天,食以安为先,食品安全是关系到国计民生的头等大事。近年来,国内一些地方接连出现的镉大米事件引起卫生部门等的高度重视。环境污染、农药残留及食品加工等过程均可能引起食品镉污染[1]。镉(Cadmium,Cd)是一种蓄积性的重金属元素,即便在很低的浓度水平上,也会对人体和其他生物造成危害[2]。镉可通过食物链在人体内蓄积,进而引起人体各种急性、慢性毒性作用,镉积累能造成结缔组织损伤、生殖系统功能障碍、肾损伤、致畸和致癌等危害,包括影响儿童生长和智力发育[3-5]。镉可以破坏机体血脑屏障进入中枢神经系统,损伤学习记忆[6],但其具体神经毒性机制尚不清楚。
PC12细胞来源于大鼠肾上腺髓质嗜铬细胞瘤,是一个常用的神经细胞株,膜上有NGF受体,NGF诱导后长出神经突起,因此广泛用于神经系统疾病的体外研究[7]。
需氧细胞在代谢过程中会产生一系列活性氧簇(reactive oxygen species,ROS)。镉作为过渡金属可通过Fenton反应将H2O2转变为羟自由基,作用于质膜,造成膜的脂质过氧化。同时,镉可以直接与抗氧化酶中的金属相互作用,抑制酶的活力,使自由基的清除受到影响,从而加重细胞的氧化损伤[8]。
本文研究选择形态结构及功能方面均具有神经元特性的PC12细胞为实验模型,用不同浓度氯化镉处理PC12细胞,观察细胞存活率、神经发生和细胞内ROS变化,以探究镉的神经毒性效应和机制。
1 材料与方法
1.1 材料
1.1.1 主要仪器耗材
5%的二氧化碳培养箱、超净工作台(Thermo Fisher Scientific 公司)、细胞培养皿(康宁,96孔板、24孔板、d=90 mm的大皿)、细胞培养盖片(Corolina Science and Math)、载玻片、荧光显微镜、高压灭菌锅、pH计(雷磁PHSJ-3F)、恒温水浴锅、高速冷冻离心机(CT14RD)、酶标仪、移液枪、水平摇床(TanonTs-92)。
1.1.2 主要试剂
Poly-L-lysine hydrobromide(Sigma-aldrich)、DMEM(Thermo、Fisher-Gibco)、抗荧光淬灭剂(Solarbio-s2100)、氯化镉(阿拉丁化学试剂)、二甲基亚砜(国药试剂)、MTT(碧云天生物技术公司)、FBS(浙江天杭生物科技有限公司)、HS(维森特生物技术(南京)有限公司)、PBST缓冲液、胰蛋白酶-EDTA消化液(KGY0012,KeyGEN BioTECH)、ROS活性氧试剂盒、抗荧光淬灭剂、NGF。
1.2 实验方法
1.2.1 PC12细胞培养
实验中使用的PC12细胞购于上海中国科学院典型培养物保藏委员会细胞库。从液氮中取出冻存的细胞置于37 ℃水浴锅解冻,3 000 r/min离心3 min,弃上清,用1 mL已预热的含有10%胎牛血清和1% PS的高糖DMEM培养基悬浮,并吸取细胞溶液均匀加在含有8 mL培养基的大皿里,置于37 ℃、5% CO2培养箱中培养,待细胞密度达到80%左右进行传代培养。传代前预热培养基、1×PBS和0.25%胰蛋白酶,并将培养皿和操作台照紫外30 min。弃掉培养基,用3 mL 1×PBS洗1次,再用1 mL胰蛋白酶消化(放于37 ℃培养箱消化1 min)。待消化完全后,加入3 mL培养基混匀结束消化过程,并将细胞溶液分装到2个离心管,3 000 r/min离心3 min。充分去除上清液,加入1 mL事先在培养箱中预热过的培养基DMEM制备悬浮液,连续吹打10次(尽量避免气泡)混匀,按照实验目的加入培养皿中进行培养。大皿、24孔板和96孔板分别为9 mL、500 μL和100 μL体系。
1.2.2 MTT比色法
MTT法又称MTT比色法,是一种检测细胞存活和生长的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝色结晶甲瓒,并沉积在细胞中。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在540 nm或720 nm波长处测定其吸光值(OD值),可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比,及OD值在0~0.7区间的可信度比较高。该方法已广泛用于细胞毒性试验。MTT溶液由MTT粉和1×PBS配置,并使用0.22 μm无菌滤膜过滤,质量浓度为5 mg/mL,配置和保藏过程要避光。取处于对数生长期的PC12细胞,利用血细胞计数板计数,6×103个/孔的浓度接种于96孔板,过夜培养;进行不同浓度的镉(0.1、0.5、2.5 μmol/L)处理,培养24 h。吸出培养基,每个孔加入20 μL MTT溶液,操作过程避光,并将培养皿用锡纸包裹避光,放置于培养箱中孵育4 h。弃去培养基,每孔加入150 μL DMSO,摇床上低速震荡15 min,然后用酶标仪在540 nm波长下测吸光值。每个处理重复6个孔,取各孔均值,计算细胞存活率,其公式如下:
细胞存活率=(实验组OD均值/空白对照组OD均值)×100%。
1.2.3 ROS检测
活性氧检测试剂盒(reactive oxygen species assay kit)是一种利用荧光探针DCFH-DA进行活性氧检测的试剂盒。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能透过细胞膜,细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光即可得知细胞内活性氧的水平。
24孔板中加入事先清洗并照过紫外的细胞爬片,每孔加入300 μL PLL包被过夜,PLL回收,用无菌水清洗24孔板,每孔500 μL,放于培养箱中培养30 min孵育后吸出,重复3次。将细胞接种于24孔板过夜,镉处理后培养24 h,吸出培养基,每孔加入500 μL已经预热的含ROS的DMEM(V(ROS)∶V(DMEM)=1∶1 000,未加PS和FBS),该操作避光,混匀后用锡纸覆盖放置于培养箱中孵化30 min。吸出DMEM,用已灭菌的1×PBS洗3次,每次换枪头,加入已预热的无血清的DMEM覆盖,以紫外光340 nm波长激发,在荧光显微镜下观察细胞的荧光强度和形态。
1.2.4 细胞分化检测
本实验以未分化PC12细胞为模型,细胞复苏后培养两代后即可用于实验。24孔板中加入事先清洗并照过紫外的细胞爬片。每孔加入300 μL PLL包被过夜,PLL回收,用无菌水清洗24孔板,每孔500 μL,放于培养箱中培养30 min孵育后吸出,重复3次。将未分化PC12细胞接种于24孔板,增殖培养过夜至细胞密度约为30%,用含有50 ng/mL NGF和镉的分化培养基全换液,镉处理的浓度为0.1、0.5 μmol/L。每隔24 h用同上的分化培养基进行半换液,至培养96 h。用荧光显微镜在20倍率下进行拍片,并用Image J software进行数据分析,统计突起总长度、一级分支数目、二级分支数目,并进行sholl analysis。每组至少统计20个细胞。
1.2.5 统计学分析
实验数据均以(均值±标准差)表示,采用SPSS软件进行统计学分析。分析组间差异均采用T-test和One-way ANOVA分析。以P<0.05为差异具有统计学意义,*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果与分析
2.1 不同浓度镉处理对细胞存活率的影响
PC12细胞是一个常用的神经细胞株,为了研究镉的神经毒性,实验采用PC12细胞作为细胞模型。镉对PC12细胞存活率的影响如图1所示,由图1可知,与空白对照组(镉浓度为0)相比,0.1 μmol/L的镉处理24 h对细胞存活率没有显著影响;0.5 μmol/L 和2.5 μmol/L的镉处理PC12细胞24 h分别降低细胞存活率11.6%和43.4%;镉在一定浓度范围内,对PC12细胞存活率的降低呈剂量依赖性。

图1 镉对PC12细胞存活率的影响
2.2 不同浓度镉处理对细胞分化的影响
由于未分化PC12细胞在NGF诱导后长出神经突起,因此本实验用镉处理未分化PC12细胞以研究镉对神经元分化即神经发生的影响。由于镉处理剂量为2.5 μmol/L时细胞存活率不足对照组的80%,因此分化实验选择较低浓度的镉处理。镉对PC12细胞突起总长度的影响如图2所示,由图2可知,0.1、0.5 μmol/L镉暴露组的细胞突起总长度比对照组的分别减少22.7%和48.9%。

图2 镉对PC12细胞突起总长度的影响
镉对PC12细胞一级分支数量的影响如图3 所示,由图3可知,0.1、0.5 μmol/L 镉暴露组的细胞一级分支数量比对照组的分别降低9%和26.6%。镉对PC12细胞二级分支数量的影响如图4所示,由图4可知,0.1、0.5 μmol/L镉暴露组的二级分支数量比对照组的分别减少13.3%和82.9%。镉处理对交点数的影响如图5所示,由图5可知,镉暴露后突起末端距离胞体中心点距离减小;且随着暴露剂量的增大,同一距离下的交点数随着镉浓度增加而逐渐减小,此指标主要综合反映突起长度和数量。综上,镉对神经发生有明显抑制作用,且呈剂量依赖性。
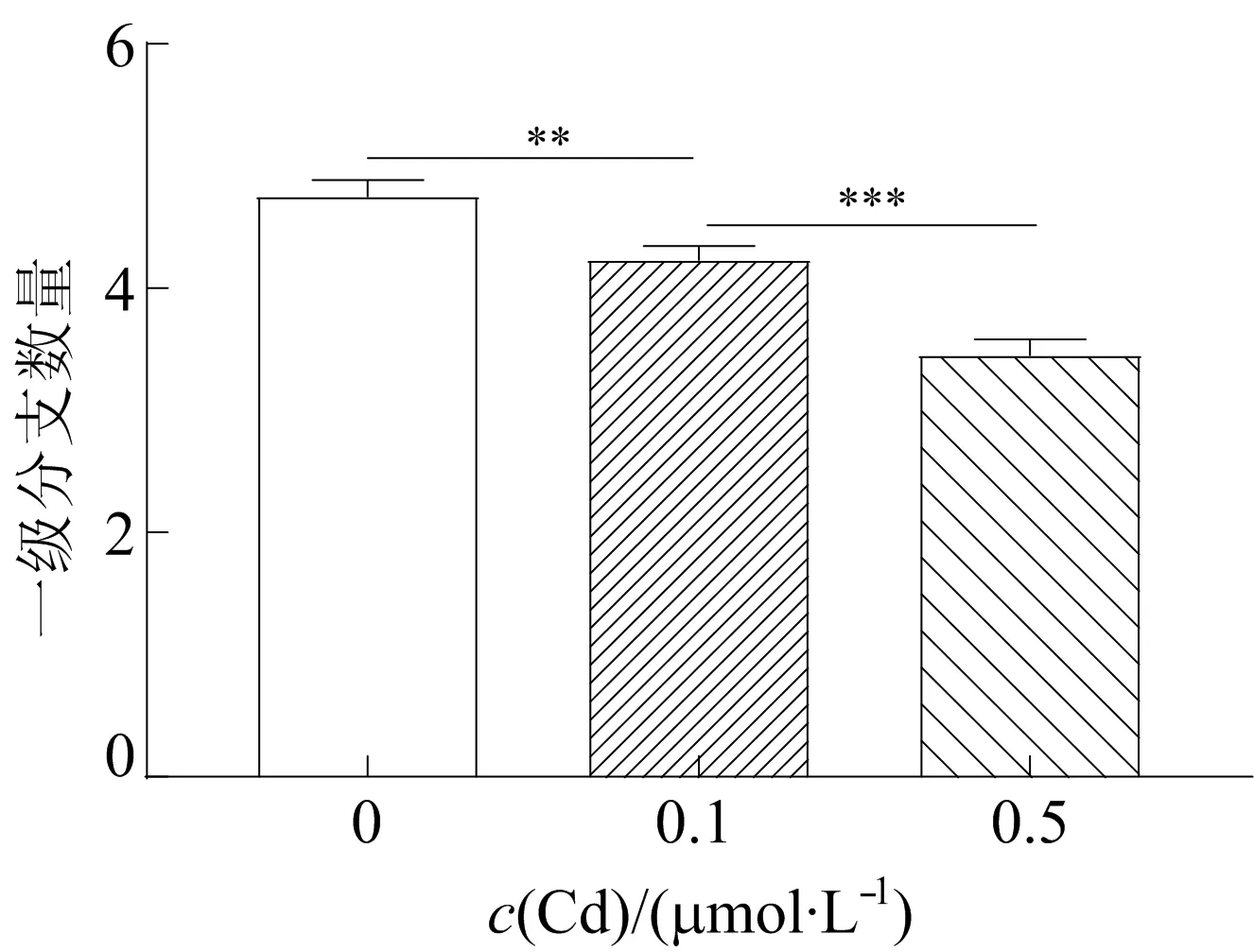
图3 镉对PC12细胞一级分支数量的影响

图4 镉对PC12细胞二级分支数量的影响

图5 镉对交点数的影响
2.3 镉对细胞内ROS的影响
镉对PC12细胞ROS水平的影响如图6所示,图6a~图6c分别为0(空白对照组)、0.1 、0.5 μmol/L镉暴露后细胞内的ROS荧光信号。由图6可知,随着镉暴露剂量的增加,细胞内ROS荧光信号越强;更多的PC12细胞出现突起消失,细胞变成圆球状。以上分析表明镉能导致PC12细胞内活性氧增加,导致氧化损伤,且氧化损伤呈剂量依赖性。
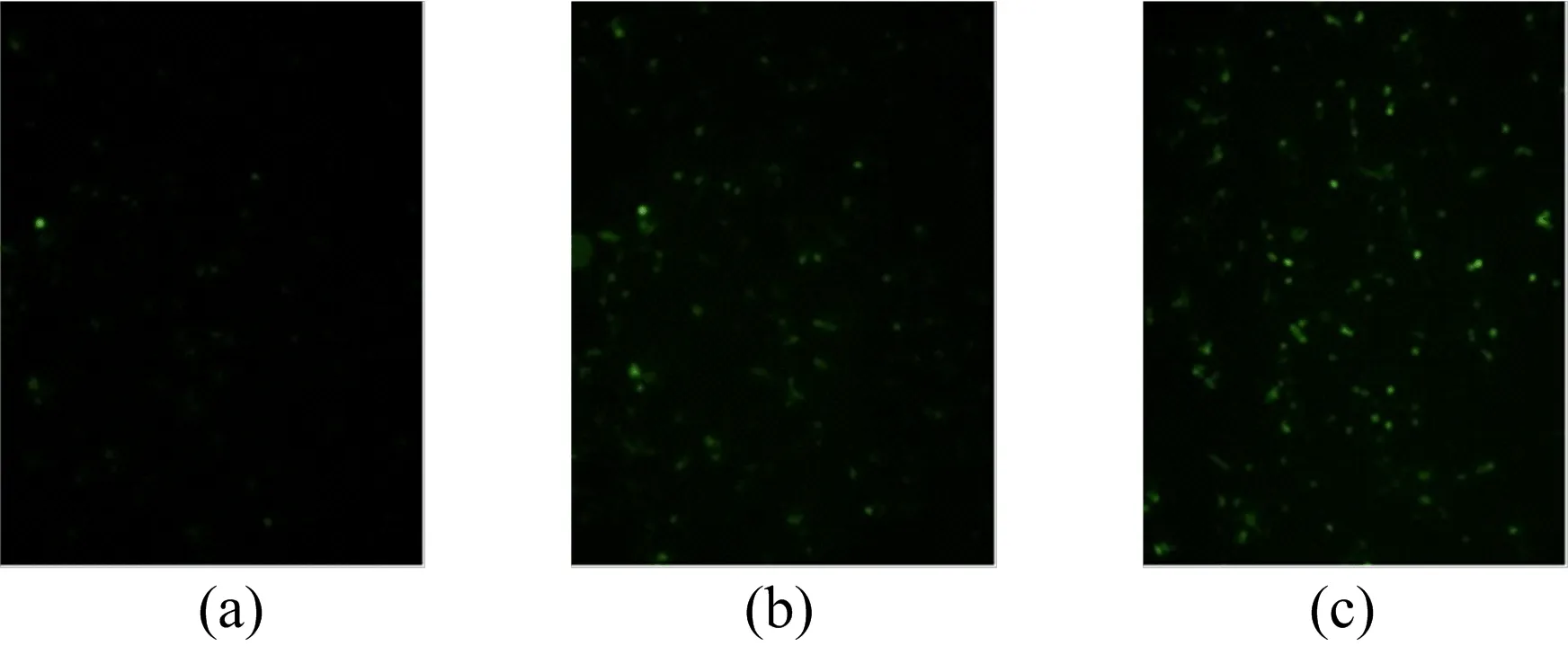
图6 镉对PC12细胞ROS水平的影响
3 结 论
近年来镉的毒理学作用及其机制研究,已取得重要进展,但关于镉的神经毒性及其机制尚不清楚[9]。由于食品镉污染而食源性摄入镉,或者空气镉污染而通过呼吸道吸入镉,镉可以进入人体并在人体积累,因此关于镉慢性暴露导致的神经系统损伤问题亟待解决。因为过去研究认为镉不能通过血脑屏障,所以随后的镉神经毒性一直被忽视。近年来研究发现镉能够损伤并通过发育期大鼠的血脑屏障[10],因此探究镉暴露对大脑神经元毒性作用对研究镉的神经毒性具有重要的意义。本文直接对PC12细胞镉暴露,以探究大脑中神经元镉暴露后可能出现的损伤情况。本实验发现镉的毒性很大,PC12细胞暴露0.5 μmol/L镉24 h,细胞存活率显著下降,且毒性作用呈剂量依赖性。因为环境中镉暴露通常是长时间低剂量的慢性暴露,所以后续的分化和活性氧检测实验选择了更低浓度的镉暴露。0.1 μmol/L镉暴露24 h不影响PC12细胞存活率,但出现明显氧化损伤和神经发生抑制。镉暴露引起细胞内ROS增加可能是引起细胞损伤的内在机制,这是由于伴随着细胞内ROS上升出现突起消失、存活率降低现象。
综上所述,镉神经毒性作用呈剂量依赖性,镉可能通过减少神经细胞数量和细胞突起、引起氧化损伤而损伤神经系统。本文只探究了镉可能导致神经元损伤情况,应该在离体神经元细胞和在体基础上进一步验证,并且进一步探究镉导致损伤的机制。本文结论对于镉导致的损伤修复有一定的借鉴意义,根据镉导致氧化损伤现象,尝试利用抗氧化天然产物修复镉造成的损伤。

