不同类型土壤胡敏酸提取物环境持久性自由基特征及影响因素
鲁遥,王朋,尹梦楠,杨名毅,张凰
(1昆明理工大学环境科学与工程学院,云南昆明650500;2成都理工大学生态环境学院,四川成都610059;3昆明理工大学农业与食品学院,云南昆明650500;4云南省土壤固碳与污染控制重点实验室,云南昆明650500)
自由基是一种至少含有一个未配对电子的原子、分子或共价基团,由分子共价键受到外界能量影响而发生均裂产生[1]。自1900年Gomberg[2]发现了三苯甲基自由基的存在后,科研工作者便开始对自由基的环境行为和反应机理进行深入研究。20世纪60年代末,研究者在光化学烟雾形成机理的实验中,证明了自由基的产生是化学反应的关键[3]。在生物体内,自由基参与免疫系统工作能杀死病毒、细菌等。但是从生物体外进入的过量自由基,如吸烟、大气颗粒物等途径,会导致过氧化氢酶在消除过量自由基方面的功能失调,从而引起应激反应,导致细胞损伤[4]。但这种自由基在环境中存在时间短(约为10-9s),且不稳定,被称为瞬时自由基[5]。
1977年,Heimer[6]提出有机化学反应过程中能形成稳定的自由基。直到2007年,Delinger等[7]提出环境持久性自由基(environmentally persistent free radicals,EPFRs)的概念。越来越多的研究结果表明,EPFRs广泛存在于大气悬浮颗粒物[8-10]、土壤沉积物[11-13]和天然有机质[14-18]等环境介质中。土壤中EPFRs的来源可以分为自然产生和人为影响。自然产生是指天然有机质[14-18]以及有机污染物(如多环芳烃、五氯苯酚等)与土壤矿物相互作用[19-20]而产生的EPFRs。人为影响来源于人类活动,如焚烧[21-22]、低温热裂解[23]以及高温制备的土壤改良剂[24-26]等固体颗粒物,通过大气循环或干湿沉降进入土壤。研究发现EPFRs可以稳定在固体颗粒上几分钟至几十天,由于其高的氧化应激效应可诱发生物细胞和机体损伤,从而引发肺部和心血管疾病[27]。研究土壤中天然有机化合物携带的EPFRs,特别是在不同有机质组分中的分布特征与稳定机制,是预测土壤中EPFRs环境风险至关重要的一步。
对于全球环境来讲,土壤有机质作为全球碳循环中关键的一部分,与土壤中的EPFRs有着密切的联系,探究其活性与稳定性对全球碳循环有着重要的意义[28]。胡敏酸(humic acids,HAs)是一种含有羧基、羟基、醌基等多种官能团的高分子有机聚合物,其中芳香环是构成HAs分子结构的基础,由碳链连接成疏松的网状结构[29],常被用作土壤有机质研究的替代物。研究证实HAs中含有的自由基是生物体大骨节病的一种致病因子[30]。由于不同来源的HAs结构和功能差异性较大,从HAs前体分子的结构角度来预测EPFRs性质和环境行为的研究还存在不足[31]。研究表明,EPFRs形成与在HAs性质之间有何关系存在争议,Gonzalez等[32]研究发现半醌自由基的浓度与芳香碳的比例呈正相关,芳香性强的腐殖质中电子共轭体系更完善,从而自由基信号强度高;相反地,Riffaldi等[17]则发现甲基化程度高的腐殖质含有更大的未配对电子迁移率,这一类腐殖质的自由基信号更强。因此,HAs中EPFRs形成和稳定的影响因素还需要更加深入系统的研究。
本文对不同来源土壤的HAs进行表征,原位测定HAs的EPFRs信号强度,同时对EPFRs的浓度和种类特征进行了研究,包括g值和线宽(ΔH),探究不同性质HAs(如来源、结构或组分)与HAs中EPFRs信号特征的关系,对研究土壤天然有机质中EPFRs的产生、迁移及环境风险有着重要意义。
1 材料与方法
1.1 材料
本研究采用的盐酸(HCl)和氢氧化钠(NaOH)来自成都市科龙化工试剂厂,焦磷酸钠(Na4P2O7·10H2O)来自重庆市川东化工有限公司,氢氟酸(HF)来自四川西陇化工有限公司,纯度均高于分析级。
实验所用土壤采集地分别为来自云贵高原红土(东经102.10°,北纬24.23°)、黑龙江省黑土(东经127.85°,北纬42.8°)、山东省黄土(东经120.75°,北纬37.8°),将土壤自然风干,过100目筛备用。
1.2 HAs的提取
采用碱溶酸析法进行HAs提取[33],将过好筛的土壤样品按固液比1∶10(kg/L)加入氢氧化钠溶液和焦磷酸钠溶液(0.1mol/L,1∶1),静置12h后,用虹吸法将上清液吸出保留,提取过程重复4次。向提取的上清液中加入盐酸溶液沉淀,保留沉淀物。向沉淀物中加入氢氟酸(10%)洗涤5次,再用清水洗涤。以3500r/min的转速离心20min,收集固体部分,将固体部分冷冻干燥。以B-HAs、R-HAs、Y-HAs分别对3个不同地区的土壤胡敏酸命名,分别是黑土、红土、黄土。黑土分4次提取,依次命名为B-HA-1、B-HA-2、B-HA-3、B-HA-4,红土和黄土命名方式同黑土,分别用R和Y代替B。
1.3 HAs的表征
(1)灰分测定用灰分判断HAs的纯度,灰分含量越高,HA的纯度就越低[34]。灰分测定采用马弗炉灼烧法,在600°C条件下对从土壤中提取的HAs灼烧4h,进行称量,按式(1)计算。

式中,w为灰分含量,%;m0为坩埚质量,g;m为灼烧后样品和坩埚质量,g;m1为灼烧前样品和坩埚质量,g。
(2)元素分析用元素分析仪(vario MICRO cube,Elementar,Germany)测定固体HAs中C、H、O、N等的元素组成。每种样品称取2mg左右进行元素分析,所有测定重复2次。
(3)固体碳谱核磁测定13C NMR(DPX 300,Bruker,美国)用于主要结构碳的测定,测试参数如下:13C NMR光谱是在75MHz、13C和300MHz的频率下获得的,MAS扫描速率13kHz,接触时间2ms,1s循环延迟,每次样品扫描约30000次,谱线展宽50Hz[35]。
(4)傅里叶红外光谱采用溴化钾压片法,用傅里叶红外光谱仪(PerkinElmer Spectrum One)对所有HAs进行红外吸收分析。将干燥且研磨好的溴化钾粉末与HAs混合在一起,以400∶1(KBr∶HAs)的比例在干燥的环境下研磨并混合均匀,在波长范围400~4000cm-1中对样品化学结构及官能团变化进行分析。
(5)紫外分光光度法采用岛津UV-3600分光光度计进行紫外-可见光谱测定,以超纯水为空白对照,称取一定量的胡敏酸固体,用少量0.1mol/L NaOH溶液溶解,加入UP水,用0.1mol/L的HCl和NaOH溶液调节pH至7.5,配制成被测胡敏酸溶液。在200~800nm范围内扫描,步长为1nm。计算E4/E6值,表示被测溶液在波长465nm和665nm处吸光度的比值,是对HAs组成结构表征的重要指标,按式(2)计算。

(6)三维荧光光谱测定使用Lumina荧光分光光度计测定HAs溶液,设定参数如下,扫描速度为2400nm/min,间隔时间为20ms;扫描范围如下,激发波长(λEx)为240~450nm,发射波长(λEm)为300~600nm,带宽均为5nm。
(7)分子量的测定采用高效液相色谱(HPLC Agilent 1200,美国)紫外检测法在254nm处测量了HAs的分子量(MW)。实验流动相采用磷酸二氢钾溶液和磷酸氢二钾溶液(0.1mol/L,1∶1)配制盐溶液,采用分子量为分别210、4300、6800、17000、32000和77000的聚苯磺酸溶液(钠盐)建立标准曲线。
1.4 电子顺磁共振波谱(EPR)测定
将冻干后的HAs提取物固体样品置于高纯度石英EPR管中,室温下在电子顺磁共振波谱仪(EPR)(Bruker,A300-6/1,X band)中进行单腔体分析,调制为100kHz,微波频率为9.2~9.9GHz。EPR微波功率设定为0.1mW,扫描时间为81.92ms。EPR测量的其他典型参数如下:扫描宽度为100G,调制幅度为1.00G,X轴的分辨率为1024个点。
2 结果与讨论
2.1 不同源HAs的自由基特征
分别从黑土、红土和黄土中各提取4次HAs,HAs的EPFRs信号如图1所示。对同一土壤来源,随着提取次数的增加,EPFRs的信号强度在减弱,自由基信号强度变化最明显的是B-HAs,其次是Y-HAs,R-HAs自由基信号强度变化最弱,说明R-HAs中EPFRs最稳定。不同土壤来源HAs中EPFRs信号强度具有显著的差异(表1),信号强度大小依次为B-HAs>R-HAs>-HAs。红土中含有大量的过渡金属Fe,Li等[36]研究发现酚类化合物在Fe(Ⅱ)和Fe(Ⅲ)的循环过程中能形成EPFRs。Lovley等[37]发现微生物在土壤中可以利用腐殖质这个电子穿梭体将电子传递给Fe3+,微生物活动旺盛,更有利于微生物与不易接触到的Fe3+氧化物之间传递电子,因此R-HAs中的EPFRs信号更稳定。黑土所处的气候温和干燥,土壤中有机质的腐殖化过程较矿质化过程更快,气温低抑制土壤微生物的活动,因此有利于腐殖质在土壤中的积累[38]。由于黑土中有机质含量丰富,而因此在B-HA-1中EPFRs含量最多,但是随提取次数的增加,B-HA-4与B-HA-1相比减少了2.8倍,提取批次对B-HAs的EPFRs信号强度变化的影响最明显。这一结果表明,黑土中EPFRs的分布与其HAs异质性有关。山东黄土的腐殖质形成过程较弱,地表的凋落物大多以干燥的形式覆于土壤表面,从而导致积累的腐殖质较少[38],因此Y-HAs中自由基含量少于B-HAs。此外,黄土分布区域没有红土所在地日照时间长,而黄土中过渡金属含量低于红土,因此在自由基信号强度稳定性方面介于黑土和红土之间。
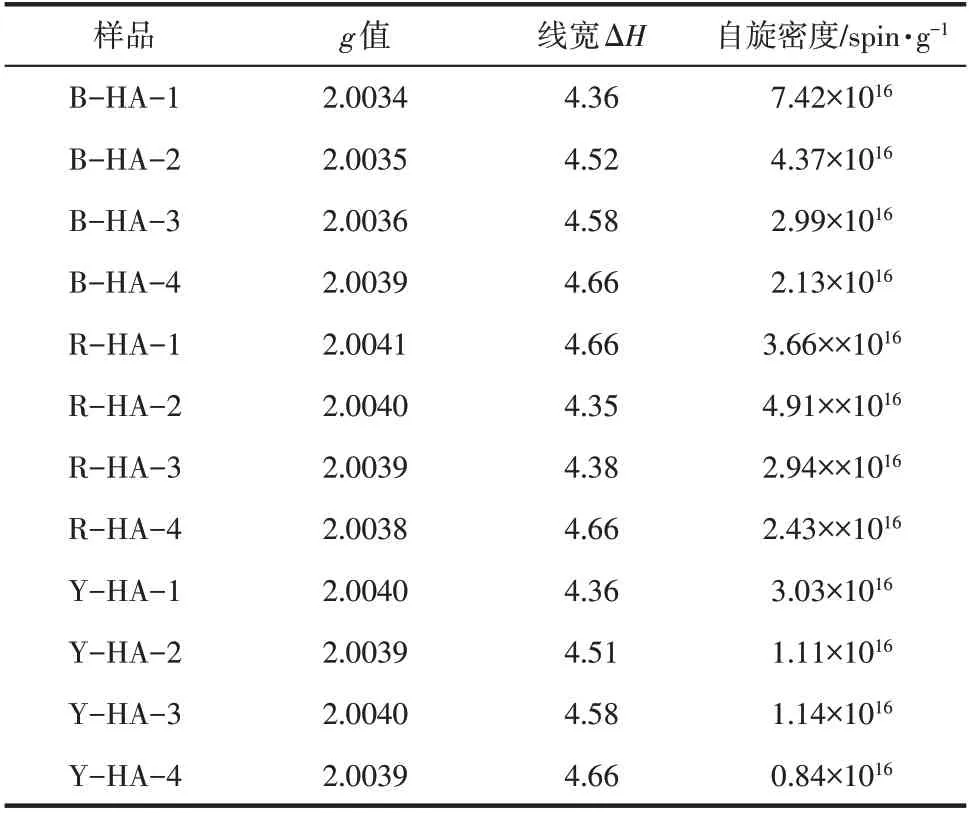
表1 不同来源HAs中EPR信号特征参数
g值又称朗德因数,可以表示磁场共振位置,能够提供化学键和分子或原子结构的信息,是电子顺磁共振测试中的重要特征参数[39]。根据不同g值可判断样品中所包含的EPFRs特征信息,g值小于2.0030,主要是以碳原子为中心的自由基,如芳烃类自由基;若g值大于2.0040,主要是以氧原子为中心的自由基,如醌类或半醌类自由基。实验中所有HAs的自由基g值均在2.0034~2.0041(表1),可以判断自由基信号来源于碳中心自由基与氧中心自由基的混合体系或者孤电子附近有含氧官能团的碳中心自由基[40-42]。从线宽(ΔH)来看,不同土壤来源提取HAs的线宽虽然差异不大,但是在同一土源中随提取次数的增加线宽值略有增加,整体ΔH在4.30~4.70G,说明EPFRs的种类差异并不明显,Arangio等[40]指出ΔH在3~8G说明醌类或半醌类自由基是主要EPFRs。从g值和线宽的数据均表明本文中HAs携带的EPFRs主要是醌类或半醌类自由基[43]。
土壤中腐殖质主要充当电子穿梭体,利用其自身的氧化还原反应,在土壤微生物与不易接触到的Fe3+氧化物之间传递电子[44]。紫外辐射、氧气含量、pH都能对腐殖酸中EPFRs的产生造成影响,使醌从苯醌态还原到半醌态[45]或特定条件下苯醌基团与对苯二酚反应,从而产生了半醌自由基[46]。而HAs作为复杂的天然有机质并非只含有这两种自由基信号,还可能存在HAs与金属离子形成络合物产生的自由基信号[32],或含有超精细结构信号[45],但半醌自由基信号在其中占主导地位。
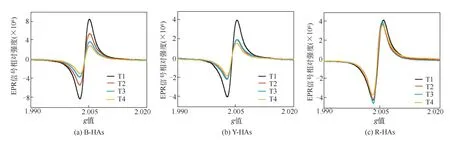
图1 不同来源土壤分批次提取HAs的EPR信号(TX表示提取次数,X=1~4)
2.2 HAs极性和结构对自由基特征的影响
2.2.1 HAs极性与EPFRs之间的关联
不同类型土壤HAs提取物的元素分析和灰分含量列于表2,灰分质量分数小于5%时可以忽略其对分析结果的影响[35]。由表2可知,所有HAs样品的元素组成中C和H含量随着提取批次的增加略有增加,O含量则与之相反。B-HAs中C元素占54.39%~54.80%,R-HAs中C元 素 占53.75%~55.34%,Y-HAs中C元素占51.28%~51.71%。结果表明,不同源土壤灰分差异较小,说明获得的HAs纯度相近,不同源土壤HAs中C、O、H和N元素含量不同,其中C、O和N相近,但H存在一定差异,C/H比略有不同。

表2 3种土壤分批次提取的HAs的元素分析和紫外吸收光谱
进一步通过计算C/H比和(N+O)/C比可以判断HAs组成的性质。C/H比可用于推测HAs的芳香性和脂肪性,C/H比大表明其芳香性强,C/H比小则表明其脂肪化程度高[47]。如表2所示,B-HAs中C/H比(0.87~1.05)显 著 高于R-HAs(0.79~0.88)和Y-HAs(0.73~0.82)。这主要归因于黑土中的腐殖酸来源主要受陆源植物影响,而黄土和红土的C/H比小于1,表示这两种土壤中更多是微生物来源的HAs[48]。对于同一来源土壤,提取的HAs中C/H比随着提取次数的增多呈下降趋势,表明芳香性组分优先被提取。通过计算(N+O)/C比可以用于描述HAs的极性,其中(N+O)/C比越低,说明HAs极性越弱。结果表明,相同来源土壤中的HAs随提取次数的增加极性呈下降趋势,即极性高的组分优先被提取。这些现象与前人的研究结果一致[49]。
随提取次数的增加,C/H比越大(表2),说明更多芳香性强的HAs被逐渐提取出来。由图2(a)可知,C/H比与EPFRs信号强度呈显著正相关(r=0.861,p<0.05),这一结果表明芳香性组分对HAs中EPFRs信号强度起重要贡献。这主要归因于芳香族化合物自由电子能够部分离域,向过渡金属提供电子,形成稳定的EPFRs[49]。进一步分析EPFRs的特征发现,本文中所有HAs样品的g值在2.0034~2.0041,属于以碳中心基团和氧原子为中心的自由基混合存在,或者未成对电子附近有含氧官能团的碳中心自由基。EPFRs的g值与C/H比呈显著负相关(r=-0.755,p<0.05)[图2(b)],表明随着HAs芳香性的降低,氧中心自由基基团所占比例逐渐减少。
2.2.2 HAs提取物对EPFRs的影响
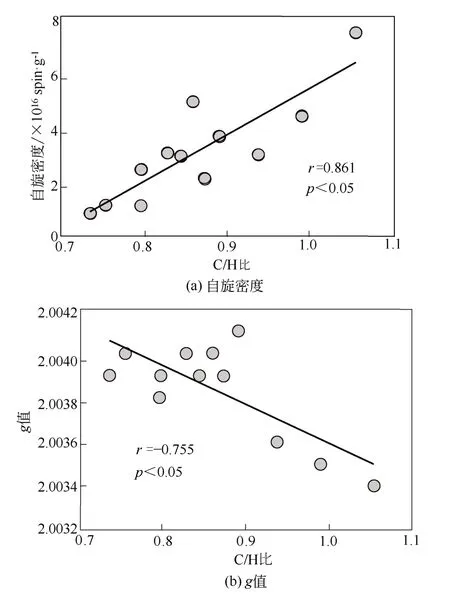
图2 HAs的C/H比与EPFRs自旋密度和g值的相关性
不同类型土壤HAs提取物的三维荧光谱图如图3所示。在Ex/Em=270~440nm/430~540nm间出现的峰为类胡敏酸,在Ex/Em=240~360nm/370~450nm间出现的峰为类富里酸,在Ex/Em=260~290nm/300~350nm间出现的峰表示类蛋白[50]。从谱图中可以发现,每个谱图都存在一些肩峰,这是因为腐殖酸分子结构组分复杂,不仅含有单一荧光基团[39]。除B-HAs有两个特征峰a、b外,R-HAs和Y-HAs中均出现第3个特征峰c,主要归因于生物降解产生芳香环氨基酸结构形成的类蛋白类物质。多糖、纤维素等类蛋白类物质可能出现在R-HAs和Y-HAs中,且数值越大,类蛋白类物质在三维荧光谱图中荧光响应就越高。a峰荧光强度比b、c峰荧光强度强,类胡敏酸物质的相对荧光强度大,因此可知,B-HAs、R-HAs和Y-HAs中均是类胡敏酸物质占最主要地位。Y-HAs和R-HAs中出现类蛋白类物质,说明土壤腐殖质在形成过程中受到微生物的作用,这与R-HAs和Y-HAs元素结果(C/H比)主要是微生物源结论相一致。b峰与HAs中羰基和羧基结构有关[50-51],在12种HAs中均有羰基和羧基结构,但是荧光强弱不一,主要归因于来源地域差异和提取次数的影响。
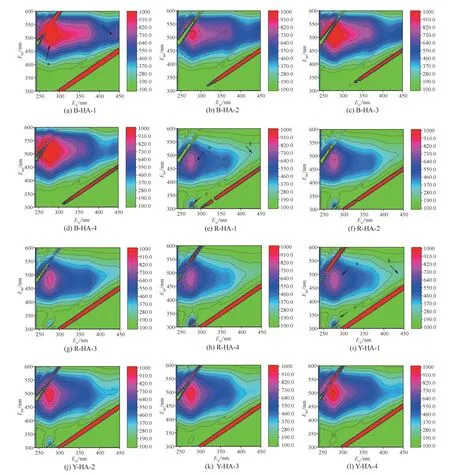
图3 3种土壤分批次提取HAs的3D荧光谱图
Senesi等[52]认为,在相同波长范围内,荧光强度的增强表明物质结构复杂化,而强度降低则表明芳构化程度的降低。按荧光峰位置及强度分析,B-HAs中类胡敏酸物质荧光强度要高于Y-HAs,R-HAs中类胡敏酸物质荧光强度最弱。因此推测B-HAs中含有芳构化程度最大的类胡敏酸物质[53],且相同来源HAs随着提取次数的增加,a峰荧光响应强度下降,因此HAs的芳构化程度减弱。对于出现c峰的R-HAs和Y-HAs可能由于土壤微生物活动产生类蛋白类物质,类蛋白类物质的疏水性[54]使其随提取次数的增加而逐渐析出,因此类蛋白类荧光响应增强。而黑土中微生物活动弱,产生的类蛋白物质少,B-HAs的类蛋白峰响应强度弱。
进一步分析了HAs的紫外光谱特征。由表2可知,12种HAs的紫外吸收强度随波长的增加HAs吸光度逐渐减少,这说明HAs中含有芳香族C==C键及其他生显色官能团[55]。HAs作为一个结构和成分复杂的混合体天然有机质,同一土源中随着提取次数的增多,紫外吸收强度在同一波长范围内呈下降趋势,说明随提取次数增加,其芳香族组分及其他生色团(芳烃羧基、羰基或酚基)含量减少[56-58]。
在285nm处的吸光度可用来表征HAs的芳香性,在285nm处的吸光度越高,表明HAs的芳香性越大,芳香族基团含量越高[59],同一土源中的HAs在285nm处的紫外吸收值随提取次数的增加而减小,说明芳香性随提取次数的增加呈下降趋势。HAs在285nm处的紫外吸光度列于表2,随着提取次数的增加,3种来源土壤HAs的芳香性均减弱,这与元素分析的结论一致。
由图4可知,HAs在285nm处的吸光度与EPFRs信号强度具有显著的正相关关系(r=0.842,p<0.05)。研究表明HAs中芳香碳含量和半醌自由基浓度呈很好的正相关,与脂肪碳呈负相关[32]。HAs中芳香碳含量高低能影响自由基的信号强度,芳香碳含量越高,HAs拥有更完善的电子共轭体系[48-49]。因此,EPFRs含量随芳香性的增强而呈上升趋势。
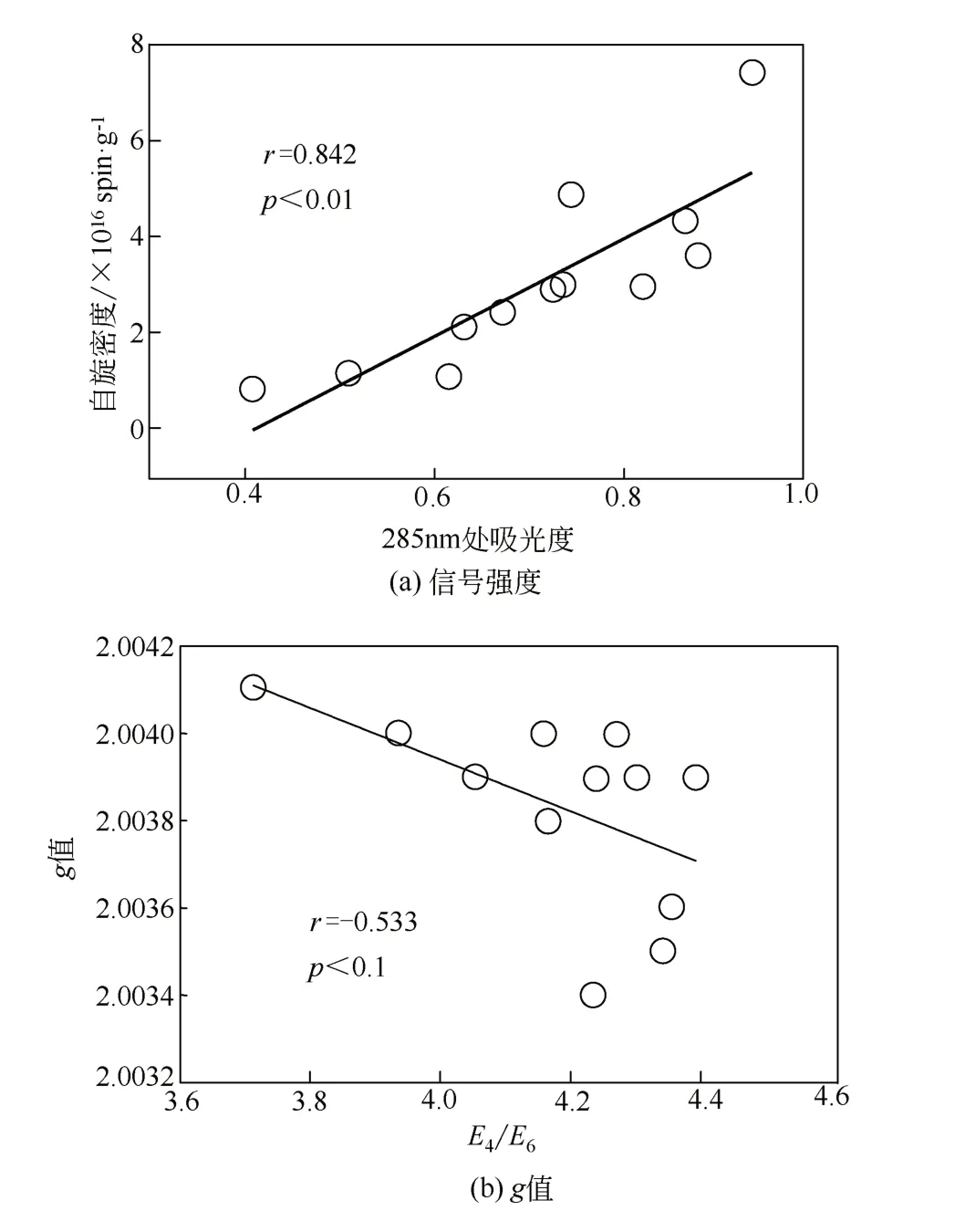
图4 HAs的EPFRs与其紫外光谱特征之间的相关性分析
腐殖化程度可以用腐殖酸分子中芳香族结构物质所占的百分率来表示[46]。研究表明,有机质腐殖化程度越高,拥有更多的芳香性结构物质[60]。本实验采用紫外-可见光分光光度法表征HAs样品的芳香性[61],用来说明实验所用HAs的化学性质和腐殖化程度。E4/E6判断腐熟度的指标,如图4(b)所示,HAs中EPFRs的g值与E4/E6之间有一定的负相关关系。这一结果表明,随着土壤中HAs的腐殖化程度加深,形成氧中心自由基的量减少,主要形成以碳中心自由基或者碳中心自由基与氧中心自由基的混合体系,这可能与腐殖化导致O元素的量减少有关(表2)。
2.3 HAs分子量和性质对EPFRs特征的影响
2.3.1 分子量影响EPFRs的形成
HAs的分子量分布如图5所示。所有HAs的色谱图中均有3个峰,峰a是70~300的分子量,强度不明显,峰b是300~2.5×104的分子量,代表芳香族结构,峰c是2.5×104~1×105的分子量,代表脂肪族结构[62]。不同来源HAs之间存在明显差异,说明各HAs间分子量差异较大。根据图5中分子量谱图可以清楚地看出,虽然a峰区域的小分子量变化不明显,但是b峰区域(300~2.5×104)随提取次数增加紫外响应值在下降,而c峰区域(2.5×104~1×105)却呈明显增加趋势,由此可知,随着提取次数的增加,HAs中小分子物质在减少,大分子物质增多,这可能是因为亲水性的小分子组分先提取出来,后提取出来的是大分子组分。

图5 3种土壤分批次提取HAs的分子量分布(TX表示提取次数,X=1~4)
当提取次数增加时,整个体系的大分子逐渐变多且亲水性降低,使得大分子量组分扩散变得困难。结合EPR分析结果,随着提取批次的增加,HAs分子量的增加,EPFRs信号强度减弱。研究表明体系中稳定自由基的含量与自由基的链长有关,自由基单体会与长链自由基结合而降低自由基稳定性[63-64]。大分子结构中聚集形式的腐殖质可以保护自由基前体相关的结构,使产生自由基的前体分子不容易发生化学键的断裂[65],从而抑制了EPFRs的形成。
2.3.2 HAs分子特征对自由基的贡献
3种土壤分批次提取得到的HAs固体经13C NMR测试后各个峰的积分面积所占百分比见表3,HAs的13C NMR波谱可主要分为5种结构带:脂肪碳(δ0~45),与O相连的脂肪碳(δ45~110),芳香碳(δ110~165),羧基碳(δ165~190),羰基碳(δ190~220),其中芳香碳中含有两个共振峰,分别为与C、H原子相连的芳香碳(δ110~145)和与O、N原子相连的芳香碳(δ1145~165)[48]。HAs化学结构相似,主要碳结构有芳香碳、脂肪碳、羧基碳和羰基碳。虽然结构差异不大,但是根据每种碳所占比例(表3)可以看出,由于土壤来源和提取批次不同,每种HAs都具有各自的结构,且每种结构碳含量不相同。
根据表3可知,B-HAs的芳香碳含量为45.00%~39.96%,R-HAs中芳香碳含量为37.62%~36.36%,Y-HAs中芳香碳含量为36.63%~30.00%,不同土源HAs中芳香碳含量最多的是黑土,其次是红土和黄土。对于3种土壤不同提取批次的HAs,芳香碳含量表现出相同的变化趋势,即随提取批次的增加,芳香碳(δ110~165)含量减小,脂肪碳(δ0~110)含量增加。从芳香性和脂肪性的角度看,B-HAs含有更多的芳香结构,R-HAs次之,Y-HAs芳香结构最少,脂肪性则呈现相反趋势;而对于同土源不同提取批次的HAs来讲,随提取批次增加芳香性减弱,脂肪性增加,这一结果与前面的结论一致。
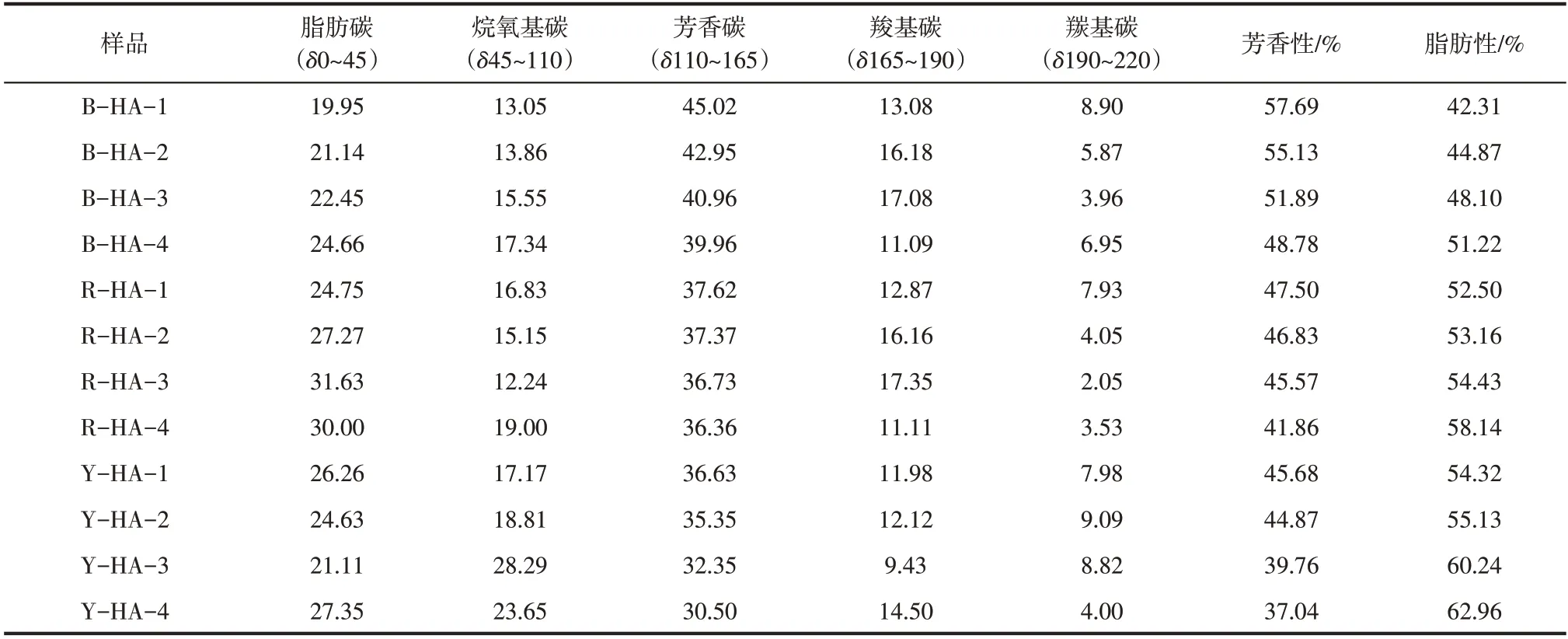
表3 固态13C NMR谱分析结果
如图6所示,EPFRs信号强度与HAs芳香性呈正相关(r=0.813,p<0.01),说明HAs中持久性自由基主要来自芳香类组分贡献。如图6(b)所示,g值与HAs芳香性呈负相关(r=-0.752,p<0.01),说明随着芳香性的增加,以氧为中心基团的自由基含量减少。这一结果与前面元素分析、紫外光谱分析结论相一致。

图6 EPFRs信号强度和g值与HAs芳香性组分之间的相关性分析
随提取次数增加,3种土源HAs的自由基强度都在减小,但R-HAs的自由基强度变化要比其他两种土壤HAs的自由基强度变化更小。R-HAs的EPFRs信号更加稳定,可能的原因是在自然界中腐殖质是微生物与铁氧化物之间电子传递过程的重要介导,红土中过渡金属铁含量较温带地区丰富[66],Fe3+可以与氢氧根离子或水分子结合,形成[Fe(OH)1~4]-1~2+这样的小聚物,易与芳香族自由基阳离子发生络合,部分转化为更加稳定的氧源性自由基[37]。此外,相对于其他两种土壤的来说,红土中R-HAs来自紫外辐射强烈的云贵高原,紫外辐射可以加快HAs中苯酚类物质发生转化,在此过程中前体化学键断裂可产生寿命长达数天的EPFRs。因此,R-HAs中含有更加稳定的EPFRs,使自由基强度变化受提取次数影响小。
3 结论
胡敏酸自身结构较为复杂,其产生的自由基信号是混合信号峰。本文通过对HAs进行系统表征分析,建立其分子结构特征与EPFRs特征之间的关联,主要结论如下。
(1)EPFRs的g值和线宽的数据均表明本文中HAs携带的EPFRs主要是醌类或半醌类自由基。随着土壤中HAs的腐殖化程度加深,形成氧中心自由基的量减少,主要形成以碳中心自由基或者碳中心自由基与氧中心自由基的混合体系,这可能与腐殖化导致O元素含量的减少有关。
(2)HAs的芳香性与其EPFRs信号强度有相同变化趋势,芳香性结构中自由电子能够部分离域导致自由基信号强度增强,因此HAs随提取次数的增加芳香性减弱,脂肪性增强,EPFRs信号强度与芳香性成正相关。
(3)从不同类型土壤HAs提取物来看,RHAs相对于其他两种土源HAs的Fe3+含量丰富、受紫外辐射强,通过过渡金属氧化物与芳香族自由基阳离子的络合反应或自由基前体化学键断裂,产生稳定EPFRs,R-HAs的EPFRs信号稳定性强于其他两种来源HAs。

