羧甲基纤维素-大豆分离蛋白农药缓释颗粒的制备及性能
李梓泳,马憬希,赵明,陈龙,周红军,周新华
(仲恺农业工程学院化学化工学院,广东省普通高校农用绿色精细化学品重点实验室,广东广州510225)
农药在使用过程中,喷雾漂移、叶面流失、蒸发、紫外线降解等都会造成农药的利用率低下;雨水的冲刷、气凝胶的流动等可能会使农药通过生物链给人类的健康带来不利的影响;因此提高农药利用率、减少农药流失已成为农药发展的主流方向。制备控释农药是满足上述条件的有效方法,而控释农药种类繁多,如微胶囊包裹、介孔吸附、凝胶负载等[1]。Zhang等[2]利用聚酯和聚乙二醇开发了一种温度响应型混合胶束来控制除虫菊酯的释放,提高了除虫菊酯的光稳定性,增长了活性成分的存活时间,比商业配方有更好的利用效率。Liang等[3]利用可降解淀粉修饰二硫键功能化介孔硅,制备了具有氧化还原响应和酶响应的纳米粒子,有效防止阿维菌素的光降解,阻止其过早泄露。此外,纳米粒子对小菜蛾幼虫具有良好的杀虫活性,实现了农药的靶向释放。颜慧琼[4]利用海藻酸钠衍生物、膨润土和壳聚糖制备负载啶虫脒的凝胶,在水溶液中有好的稳定性能和缓释性能。
在提高农药效率的同时,也应该重视控释农药的载体性质。天然高分子载体具有制备简单、来源广泛、可降解、生物相容性好等优势。羧甲基纤维素(CMC)是一种天然的阴离子水溶性多糖,是纤维素的衍生物,具有黏着、增稠、流动、乳化性,应用于食品、医药、日化等行业。其中,已经有很多关于CMC在缓释农药应用方面的报道。Hao等[5]用疏水改性的CMC通过静电作用包封磷酸化玉米醇溶蛋白,负载阿维菌素(AVM)后的平均粒径为360nm,封装效率提高了82.11%,对叶片的黏附性能也提高了约20%,在有效防止紫外光降解的同时还保持与原药无明显差异的毒力效果。Sarkar等[6]用CMC和柠檬酸与膨润土制备的pH响应农药载体,让触发杀虫剂精准地在碱性内脏释放。但亲水性强的CMC单独作为载体负载农药时负载率低。陈龙等[7]将甲基丙烯酸甲酯接枝到CMC上制备的微胶囊提高了AVM在叶片上的亲和性。大豆分离蛋白(SP)是一种丰富的原料,在释放系统中可促进蛋白质与营养物质的相互作用[8]。Di Giorgio等[9]使用乳化法将鱼油包封在SP中,包封率达88%,但该工艺需要使用大量的乳化剂,还需要昂贵的喷雾干燥机将所需产品分离。
本文以CMC和SP为原料,制备负载AVM的缓释体系。利用红外光谱(FTIR)、扫描电镜(SEM)和热重(TGA)等对CMC-SP@AVM稳定性和微观结构进行表征,并对其包封效率、抗紫外线性能和毒理性能进行研究。此外,在不同pH和配比下,探究CMC-SP@AVM释放AVM的机理。
1 实验
1.1 实验材料
1-(3-二甲氨基丙基)-3-乙基二碳亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺(NHS),3-氨丙基三乙氧基硅烷(APTES),以上材料均为上海阿拉丁生化科技股份有限公司的分析纯级产品;羧甲基纤维素(CMC,300~800mPa·s),上海阿拉丁试剂公司提供;大豆分离蛋白(SP)由安阳天力食品有限公司提供的大豆脱脂蛋白粉提取[10];阿维菌素(AVM,工业级,纯度为95%),河北威远生物化工有限公司提供;溴化钾(分析纯),广州化学试剂厂;无水乙醇(分析纯),天津大茂化学试剂有限公司。
1.2 实验仪器
紫外可见分光光度计,T6型,北京新世纪有限公司;差示扫描量热仪,Q200型,美国赛默飞世尔科技公司;傅里叶变换红外光谱仪,Spectrum100型,美国赛默飞世尔科技公司;热重分析仪,TGA2型,瑞士梅特勒-托利多公司;激光粒度仪,90Puls型,英国马尔文仪器有限公司。
1.3 羧甲基纤维素-大豆分离蛋白(CMC-SP)的制备
称取3.0g SP于100mL去离子水中,然后依次滴入0.5g APTES、2.5g EDC和5g NHS,在室温下搅拌1h。将所得溶液在水中透析24h以除去小分子,得到A-SP。添加1.5g CMC于上述所得溶液,并在80℃下加热反应24h。冷冻干燥后得到CMCSP(mCMC∶mSP=1∶2),并以此法制备1∶1和2∶1的CMC-SP。合成机理如图1所示。
1.4 CMC-SP@AVM的制备
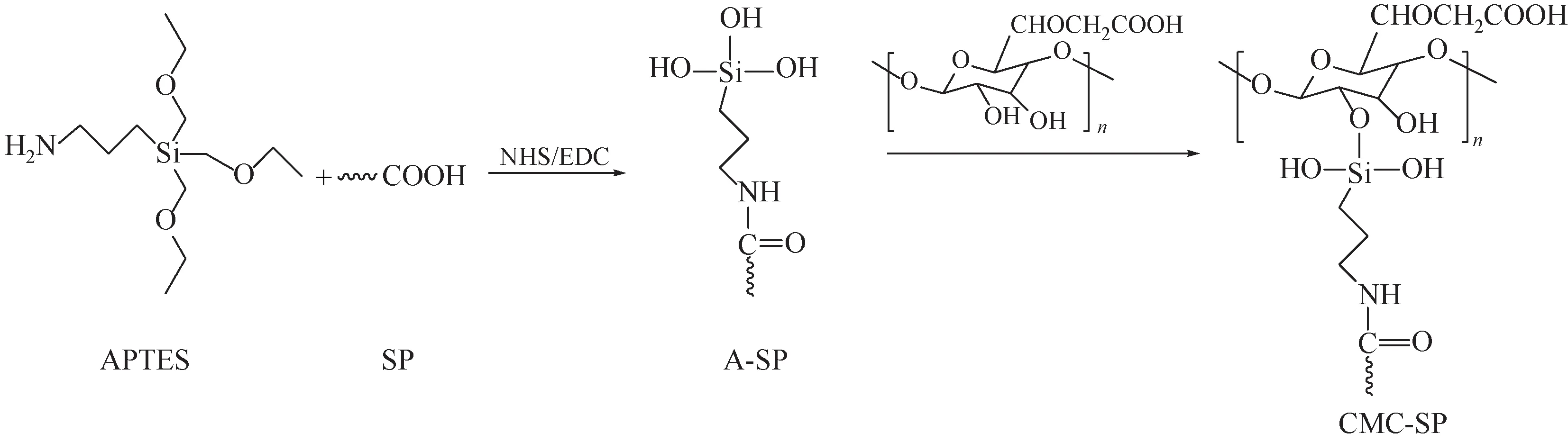
图1 CMC-SP的合成
采用自组装法制备了CMC-SP@AVM。首先加1.0g AVM于100mL无水乙醇中制备10mg/mL的AVM溶液,然后将0.1g CMC-SP粉末溶解在90mL去离子水中,加2mL AVM溶液,并定容至100mL,最后经磁力搅拌30min,得到稳定分散的CMCSP@AVM悬浮液。
1.5 结构表征及性能测试
1.5.1 傅里叶红外光谱(FTIR)
利用溴化钾压片法表征和比较CMC、SP、CMC-SP,扫描波长为4000~450cm-1,分辨率为2cm-1。
1.5.2 热重(TGA)
氮气氛围下(20mL/min),升温速率为10℃/min,升温范围为30~800℃,分析SP、CMC、CMC-SP的热稳定性。
1.5.3 扫描电镜(SEM)
将一小滴样品溶液置于干净的表面,在室温下蒸发溶剂,然后喷金,在加速电压为15kV下获得样品的SEM形貌图。
1.5.4 载药性能测试
取4mL新鲜制备的CMC-SP@AVM悬浮液置于离心管,10000r/min离心10min。取1mL上清液于棕色容量瓶中,并用无水乙醇定容至25mL。用紫外分光光度计在245nm下测吸光度,根据式(1)计算阿维菌素的包封率(EE,%)。
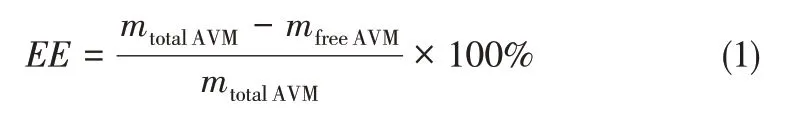
式中,mtotalAVM为体系AVM总质量,g;mfreeAVM为体系中未包封的阿维菌素质量,g。
1.5.5 抗紫外性能实验
10mL新鲜制备的CMC-SP@AVM悬浮液分散于90mL水溶液中,在距离20cm的紫外光源(16W)的照射下,进行抗紫外性能实验。然后每隔一段时间取出一部分溶液,并用紫外分光光度计测量吸光度。由式(2)可计算得残留率(Rv,%)。
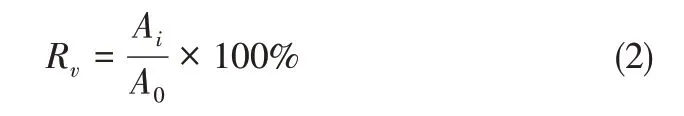
式中,A0为AVM在溶液中的初始浓度,mg/mL;Ai为不同光照时间后样品中的AVM浓度,mg/mL。
1.5.6 AVM缓释实验
将新鲜制备的CMC-SP@AVM悬浮液(5mL)放入到透析袋中,并置于锥形瓶中,然后在室温下加入50%的乙醇水溶液(50mL)进行透析,往乙醇溶液中加入HCl或NaOH来控制缓释溶液的pH。在一定的时间间隔下,取1mL样品于紫外分光光度计测量样品溶液的AVM浓度,并及时加入1mL相应的乙醇水溶液至锥形瓶。根据标准曲线:A=0.03782C-0.04705(R2=0.999)计算AVM浓度。累积释放率(Ri,%)按照式(3)计算。
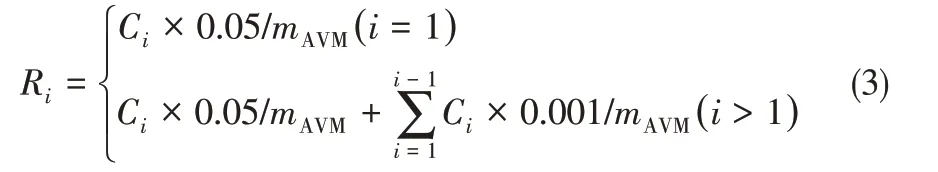
式中,Ci为每个样品在不同时间间隔时AVM的浓度,mg/mL;mAVM为锥形瓶中AVM的总质量,g。
1.5.7 杀虫活性
将白菜叶子(大小为2cm×2cm)分别浸泡在浓 度 为200mg/L、100mg/L、50mg/L、25mg/L、12.5mg/L、6.25mg/L和3.125mg/L的CMC-SP@AVM溶液里,待其自然干燥后,与10条2龄的小菜蛾一同放入垫有滤纸的培养皿中,于恒温室中培养48h后观察其死亡率,刺激时不能移动则视为死亡。用AVM乙醇溶液处理昆虫作为对照组,并计算死亡率和校正死亡率。
2 结果与分析
2.1 傅里叶红外光谱分析
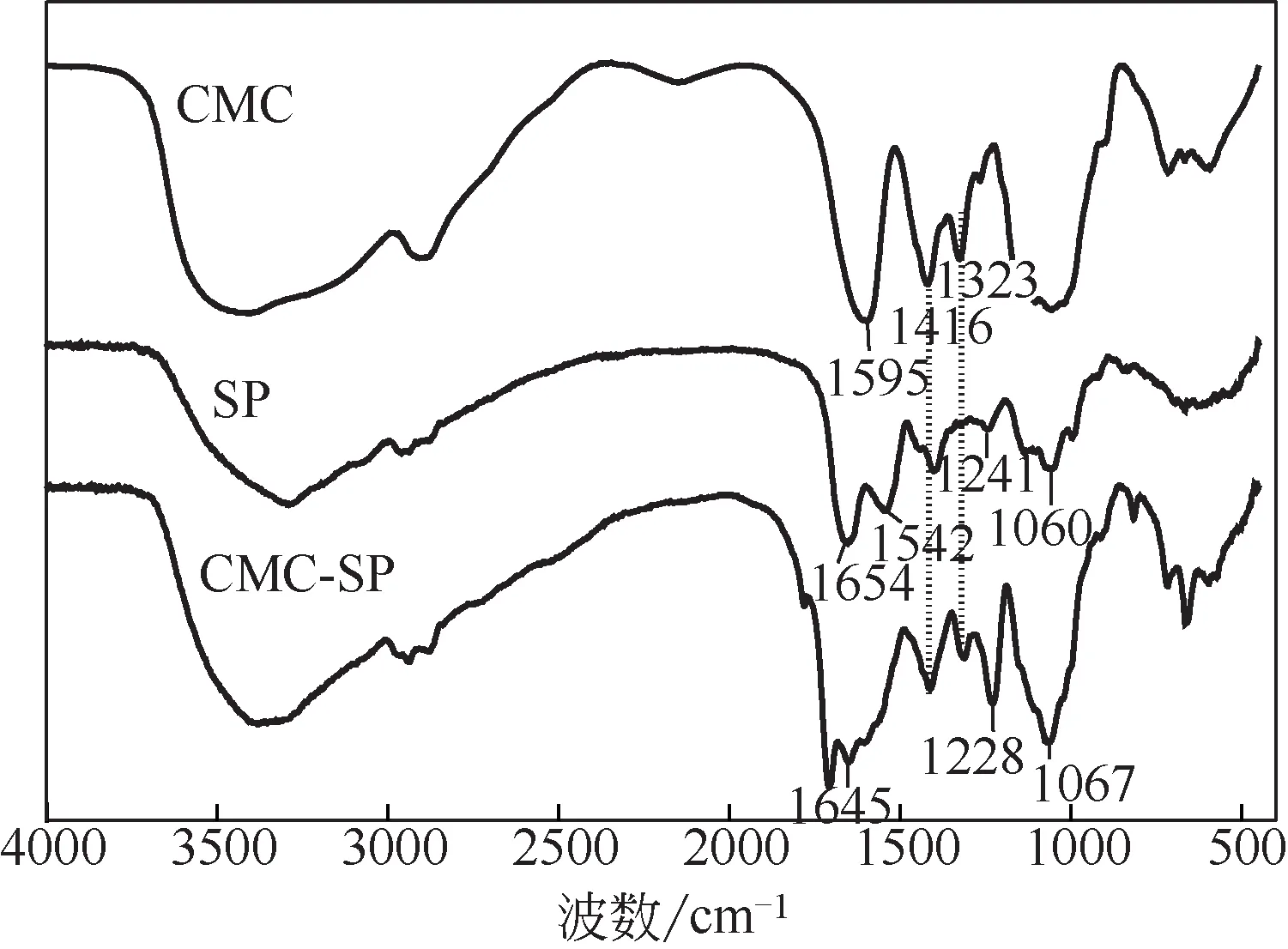
图2 CMC、SP和CMC-SP的红外光谱图
如图2所示,CMC曲线中,3500cm-1处出现的宽吸收峰是羟基、分子间和分子内氢键的伸缩振动峰[11]。2920cm-1左右出现—CH2—的伸缩振动峰,在1595cm-1处出现—COO不对称伸缩振动峰,1416cm-1和1323cm-1处出现羧甲基的对称伸缩振动峰[12]。在SP曲线中,3294cm-1左右出现的峰是由蛋白质链和水分之间的氢键引起的,1654cm-1和1542cm-1处出现酰胺键的吸收峰,在1241cm-1处的吸收带是由C—N伸缩振动和N—H弯曲振动引起的,1060cm-1处出现C—H平面外的振动峰[13]。在CMC-SP曲线中,酰胺I的吸收峰出现在1645cm-1处,表明APTES的氨基与SP反应生成新的酰胺键,导致吸收峰发生了红移。1710cm-1处出现的吸收峰可能是APTES水解后产生的羟基与SP上的羧基反应产生酯基[14]。另外,羧甲基对称伸缩振动在1416cm-1和1323cm-1处的峰也在CMC-SP中出现。CMC的C—O—C振动具有强烈吸收带,与在1150cm-1和1135cm-1处出现的Si—O—C和Si—O—Si的典型信号峰重叠[15]。
2.2 热重分析
图3(a)是CMC、SP和CMC-SP在40~600℃的TGA曲线。各样品在100℃左右的质量损失是由于样品中少量残留水分的蒸发。CMC在260℃开始分解,并且质量损失较大,因为CMC中的羧基在这个温度范围分解成二氧化碳[16],最后的质量损失率为60%。SP在204~300℃之间开始剧烈分解,质量损失峰明显,这是由大豆分离蛋白的主链多肽分解引起的[17]。在400~600℃之间的分解曲线趋于平缓,这一阶段主要为残余物质的继续缓慢分解,最终的总质量损失率为83%。CMC-SP最后的质量损失率为70%,为了进一步了解质量损失情况,对SP、CMC、CMC-SP的导数热重(DTG)图进行了研究。如图3(b)所示,CMC的分解温度质量损失峰为290℃,而SP有两个质量损失峰分别在241℃和285℃。在此段降解过程中,分子间和分子内氢键、静电作用以及疏水作用被破坏。CMC-SP的质量损失峰在248℃和313℃,因为CMC与SP反应后,分子链中的共价键数量增多,CMC-SP有更好的热稳定性[18],说明CMC成功接枝到SP上。
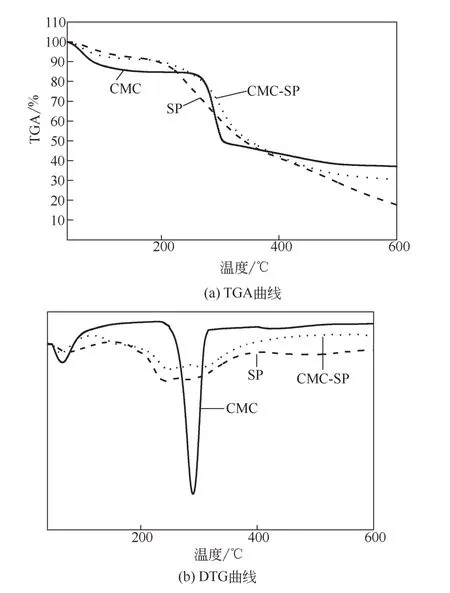
图3 CMC、SP和CMC-SP的TGA曲线和DTG曲线
2.3 SEM分析
图4为CMC-SP、CMC-SP@AVM和加热后的CMC-SP@AVM的SEM图。经Image-Pro Plus 6.0软件测量,CMC-SP的平均尺寸为195nm,呈棱柱或棱锥状,因为SP的三级和四级结构决定了颗粒的形状和大小[19]。负载AVM后,粒子的棱角减少,呈现椭圆或圆形,平均粒径减小到104nm。CMC-SP的疏水基团在疏水作用下形成一个空腔,当AVM进入该疏水腔时,形成了新的疏水平衡,重新形成的疏水腔对CMC-SP的吸引力更大,因此转变成椭圆形[20]。负载AVM的粒子加热后,棱角变得更少,平均粒径增加到110nm。这是由于SP发生了蛋白质变性,暴露了疏水性基团,相邻粒子间发生团聚[21],增加了颗粒尺寸。
2.4 粒径、zeta电位和载药性能分析
如表1所示,随着CMC-SP中SP比例的上升,其电荷值由-(15.02±0.93)mV下降到-(22.91±0.04)mV,因为SP带负电荷。随CMC-SP电位的下降,对AVM的静电排斥力增强使包封率从41.9%降低到33.1%。粒子的平均粒径变化很大,可能是由于热变性后的蛋白质不规则聚集所致[22]。测得的平均粒径与SEM图差别较大,这可能是因为CMC-SP的亲水性质导致CMC-SP@AVM在水中膨胀[23]。
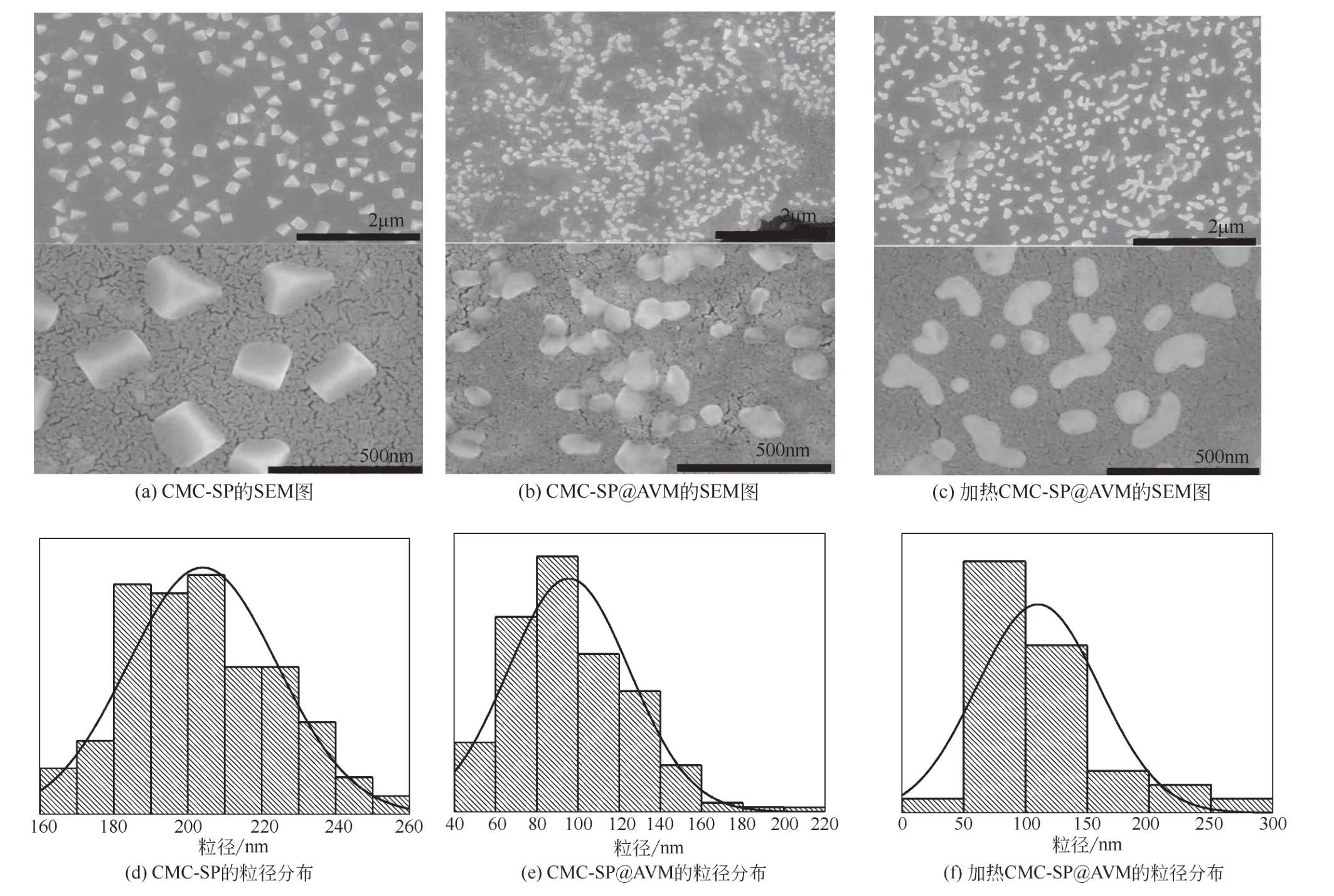
图4 CMC-SP、CMC-SP@AVM和加热CMC-SP@AVM的扫描电镜图及其粒径分布
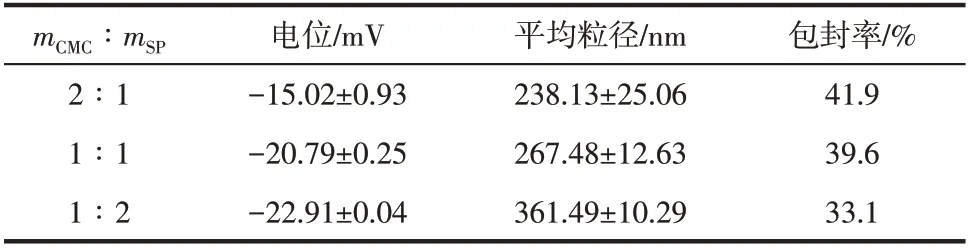
表1 不同配比的CMC-SP@AVM的粒径、电位和包封率
2.5 抗紫外分析
由图5可知,未包封的AVM在紫外光照射下迅速降解,照射0.5h后残留率为79.19%。连续辐射7.5h后,残留率为43.63%。24h内残留率仅有31.00%,且未封装的AVM的半衰期只有3.75h。CMC-SP@AVM中AVM的残留率比未包封的AVM高117%,这是因为CMC-SP作为物理屏障阻隔了紫外线的辐射,SP中的芳香氨基酸可以吸收紫外光并使蛋白质形成共价交联[24]。此外,CMC中的羧基和羟基作为发色基团会吸收部分紫外光,从而减弱紫外光的强度。不同配比的CMC-SP的抗紫外效果也不同,其中mCMC∶mSP=2∶1的CMC-SP的抗紫外性能最好。因为CMC增加了CMC-SP@AVM的厚度,另外,增加的发色基团减弱了紫外光的强度[5]。
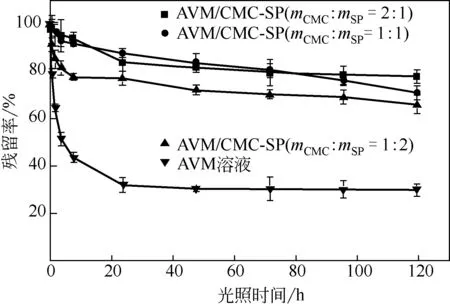
图5 不同配比的CMC-SP@AVM的抗紫外图
2.6 缓释分析

图6 不同配比下CMC-SP@AVM的缓释曲线
图6为CMC-SP@AVM在 不 同CMC和SP质量比下的缓释曲线。在初始阶段的14h,大量游离的AVM或在次级键作用下黏附于载体表面的AVM在渗透压作用下被迅速释放导致了缓释初期的快速释放,可达到75%以上[25],说明缓释粒子可在较短的时间内达到初期防治所需的较高浓度。而后期内外渗透压降低,且AVM在蛋白疏水片段强吸引力的作用下,释放速率较为缓慢。在实际应用中,CMC-SP@AVM缓释颗粒中,大豆分离蛋白可在昆虫肠道或环境中大量存在的蛋白酶中分解,从而促进AVM的快速释放,起到增效的作用。
累积释放时间到达96h后,CMC-SP@AVM(mCMC∶mSP=2∶1)、CMC-SP@AVM(mCMC∶mSP=1∶1)和CMC-SP@AVM(mCMC∶mSP=1∶2)的累积释放率分别为68.0%,83.7%和89.2%。CMC-SP@AVM(mCMC∶mSP=1∶2)的粒径最大,AVM在释放的过程中需跨越较长的距离,故其释放率最小,而CMC-SP@AVM(mCMC∶mSP=1∶1)与CMCSP@AVM(mCMC∶mSP=2∶1)的粒径相差不大,但前者的电负性较大,对带负电的AVM排斥力大,故释放率偏大。
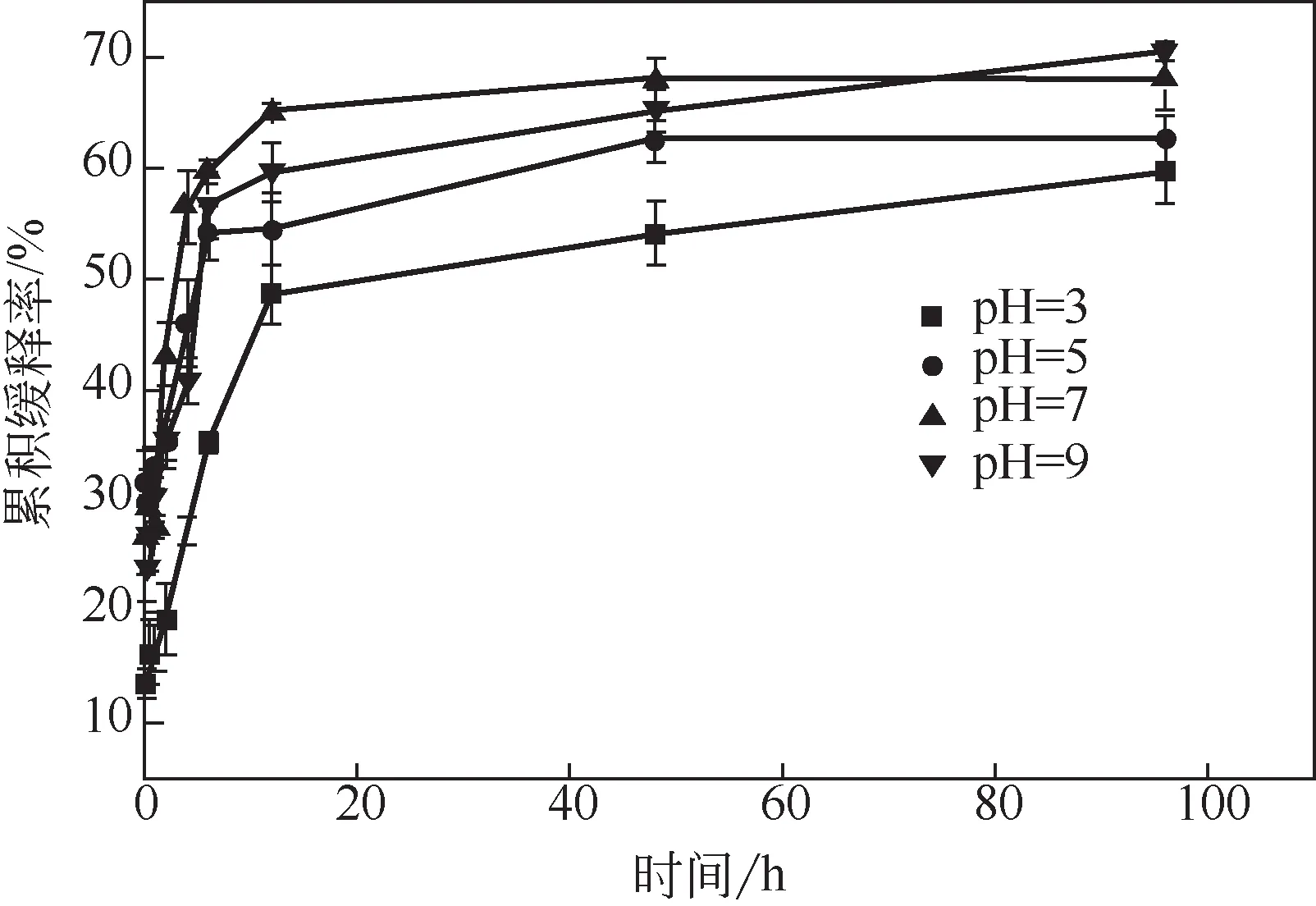
图7 不同pH的CMC-SP@AVM的缓释曲线
图7是CMC-SP@AVM(mCMC∶mSP=1∶2)在不同pH下的缓释曲线。最终累积释放率的变化趋势为pH 9>pH 7>pH 5>pH 3,即pH越高,释放速率越快。当累积释放时间为40h、pH为3时的累积释放率为59.6%,相对缓慢。大豆分离蛋白的谷氨酸和天冬氨酸含量较高,大豆分离蛋白的等电点在4.5左右[26]。缓释体系的pH小于等电点时,氨基质子化,CMC-SP@AVM的空间结构更加稳定,减缓了AVM的释放速率。当pH为5时的累积释放速率为62.38%,释放速率相对提高。pH为7和9时的累积释放速率在140h处都大于68%。因为当溶液的pH大于蛋白质的等电点时,羧基阴离子群之间的电荷斥力占主导地位,导致静电相互排斥,进一步加速了AVM的释放[23]。
据报道,具有pH响应特性的农药缓释剂在实际应用中可起到比商业杀虫剂更好的效果[27]。缓释作用有效延长了农药的作用周期,pH响应赋予了缓释剂在特定时间、特定环境下有效控制害虫的特性。具体而言,根据pH响应特性,CMC-SP@AVM用于防治具有碱性中肠的植食性鳞翅目害虫可起到较好的效果,平台期后的缓慢释放可以防止颗粒内的药物被紫外光分解,并保证颗粒内存在足够多的有效成分,在施药后一段时间仍然能达到杀虫效果[28]。
2.7 缓释动力学分析
为了进一步研究其释放机制,选取pH为3、5、7、9时的曲线进行Zero-order[29]、First-order[30]、Elovich[31]等模型拟合。模型拟合图及拟合结果分别如表2和图8所示。由表2可知,缓释动力学曲线更符合回归系数R2相对较高的Elovich模型。当pH为3、5、7、9时,Elovich模型与Gwak等[32]报道的一样,累积释放系统表现出a0值大、a1值小的现象,说明该粒子具有较好的缓释性能。不同pH下的释放动力学的差异,与材料在不同氢离子浓度下的内部结构有关。
2.8 杀虫实验分析
毒力分析结果如表3所示,其中AVM和CMC-SP@AVM的毒力回归方程分别为Y=2.8998+1.1426X和Y=2.6025+1.1895X。尽管回归方程中的常数比AVM中的小,但是其斜率大于AVM,说明在增加浓度时,CMC-SP@AVM的毒力效果逐渐接近AVM。此外,AVM的95%置信限为45.12~105.16,这意味着完全超出这个区间的概率为5%。CMCSP的包封使CMC-SP@AVM的半数致死量(103.66mg/L)高于AVM(68.88mg/L)。此外,有95%置信度说明两种毒力效应无显著差异。因此,CMC-SP@AVM包埋AVM可以改善AVM的各项性能,并对AVM的毒力作用无显著影响[33]。
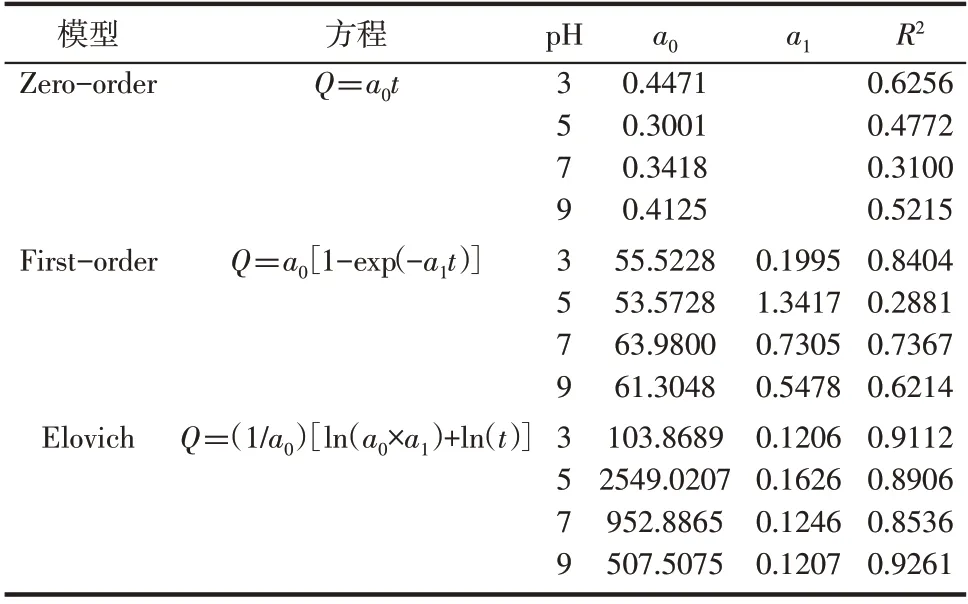
表2 pH模型拟合参数
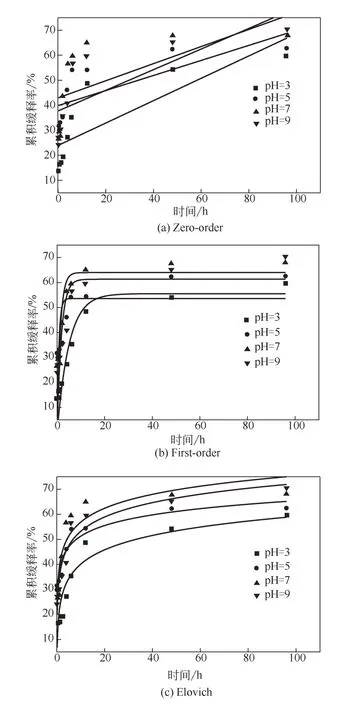
图8 不同pH下的缓释拟合模型
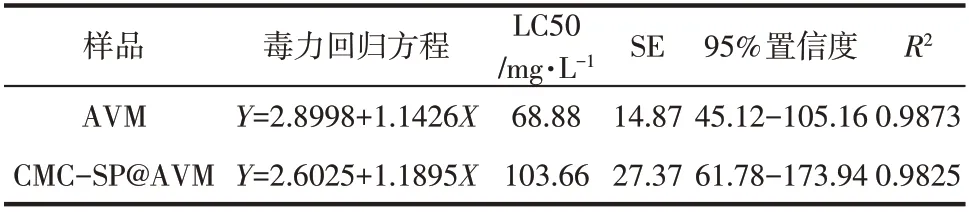
表3 毒力测定计算结果
3 结论
本文合成了具有pH响应的载药颗粒,提高了农药的利用效率。该载药颗粒通过对SP进行CMC的接枝改性,并利用疏水作用将AVM包裹。通过FTIR、DSC及TGA-DTG分析,表明CMC已经接枝到SP上。CMC-SP@AVM具有近似于椭圆形的结构,SEM分析显示粒径在104~195nm之间。接枝改性后的SP能够持久有效地包裹AVM,包封率达41.9%。CMC-SP@AVM在乙醇溶液中溶胀释放AVM具有pH响应性,并符合Elovich模型。抗紫外实验表明,CMC-SP可以显著提高AVM的抗紫外性能,有效延长AVM的半衰期。总的来说,CMCSP@AVM可以减缓农药的光降解速率,根据环境pH特性相应释放,有望提高农药的有效利用率,降低农药对环境的危害。

