壳聚糖对钙镁离子的吸附性能*
孙启卓,关叶青,何紫阳,宇文泽琦,王阿兵,张大伟
(东北林业大学 材料科学与工程学院,黑龙江 哈尔滨150040)
前 言
目前地球上能被直接利用的淡水资源仅占总资源的2.5%,其中70%冻结于南极,难以供人类使用。而我国16.44%的城市严重缺水,45.6%的城市水质较差,有许多重金属盐离子[1~3],对人民的生活健康造成巨大影响。其中大部分不可饮用水因其硬度过高而对人体有害,若降低水的硬度可直接饮用或便于后处理。寻求经济环保可行的降低饮用水硬度的技术成为当务之急。目前硬水软化方法主要有离子交换法、药剂软化法、膜分离法[4]和煮沸法[5]。离子交换法软化硬水虽降低了硬度,但同时引入了大量的Na+离子,不利于高血压人饮用。这种方法需要消耗大量试剂,不经济且不适用于大规模生产;药剂软化法操作繁琐,会产生大量废弃物,对环境污染大;膜分离法设备要求高,需要专业技术,成本高;煮沸法不节能环保。因此,寻找新的处理方法成为人们迫切的需求。
壳聚糖(Chitosan,2-氨基-β-(1,4)葡聚糖,CS)[6~7]由甲壳素脱乙酰化制备,是地球上蕴藏最丰富的生物质材料之一,无毒无害,易于生物降解,具有良好的生物相容性,是一种天然螯合剂,对大部分金属具有较强的配位能力[8~10]。由于壳聚糖中存在大量羟基、氨基,可形成大量氢键,形成类似于网状结构的笼形分子,可以同很多金属离子发生螯合作用[11~13],使离子富集、分离处理方便环保[14~16]。量产丰富,无毒无害的壳聚糖对解决软化水的问题有很高的应用价值。本文以壳聚糖为吸附剂,吸附水中Ca2+、Mg2+离子,研究吸附条件(吸附时间、pH值、壳聚糖用量、壳聚糖粒径)对吸附性的影响。
1 实验部分
1.1 材料与设备
试剂:CS脱乙酰度92%(浙江金壳生物化学有限公司);氯化钙、氯化镁、氢氧化钠均为分析纯,采购自阿拉丁试剂公司;37%的盐酸,采购自广州化学试剂厂。
仪器:过滤器(海门市希欧实验器材销售部);精密试纸,pH值试纸(天津市金达化学试剂有限公司);TAS-990原子吸收分光光度计,北京普析通用仪器有限责任公司;HJ-6A数显多头恒温搅拌器(常州市金坛友联仪器研究所)。
1.2 实验方法
使用CaCl2配制浓度为500mg/L的Ca2+标准溶液,每次均取25mL标准溶液置于250mL容量瓶,稀释成50mg/L模拟海水浓度的溶液。同样配制MgCl2溶液,浓度为500mg/L,每次均取25mL标准溶液置于250mL容量瓶,稀释成50mg/L模拟海水浓度的溶液。称取一定量的壳聚糖置于100mL锥形瓶中,分别向瓶中加入Ca2+模拟溶液、Mg2+模拟溶液50mL,在25℃下恒温匀速震荡一段时间,用过滤器吸取上层清液并稀释(Ca2+上清液稀释倍数为20倍、Mg2+上清液稀释倍数为25倍)、储存并测定稀释后上清液中Ca2+、Mg2+浓度,每种比例平行做五组,取平均值。溶液中Ca2+、Mg2+浓度采用原子吸收分光法测定。使用精密pH值试纸测试上清液pH值。
1.2.1 吸附时间
吸取50mL的Ca2+与Mg2+溶液(pH值为5.0~5.6)置于烧杯(或者别的容器)中,然后称取0.2g壳聚糖置于其中,分别搅拌10min、20min、30min、40min、50min、60min、90min、120min、180min、300min和360min后,离心处理,用过滤器吸取上层清液,使用原子吸收光谱法测定溶液中Ca2+与Mg2+溶液浓度,确定吸附时间对Ca2+与Mg2+吸附量的影响。
1.2.2 pH值
配制规定浓度的Ca2+与Mg2+溶液,使用浓度为1mol/L的盐酸和氢氧化钠溶液调节溶液的pH值,pH值分别为4、5、6、7和8。取50mL两种离子溶液,将0.2g CS置于其中搅拌5h,用过滤器吸取上层清液并测定吸附前后溶液中Ca2+和Mg2+浓度变化,确定pH值对吸附量的影响。
1.2.3 壳聚糖用量
分别称取0.05g、0.1g、0.2g、0.3g、0.5g、0.7g壳聚糖粉末,将其分别置于50mL Ca2+与Mg2+溶液中(pH=5.0~5.6)。搅拌5h,离心后抽取上层清液,测定吸附前后溶液中Ca2+与Mg2+浓度变化,确定CS用量对Ca2+、Mg2+吸附量的影响。
1.2.4 壳聚糖粒径
筛选出粒径为100~120目、120~300目、300目以上的壳聚糖,分别称取0.2g置入50mL Ca2+与Mg2+溶液(pH值为5.0~5.6)中,吸附5h,测定粒径对Ca2+与Mg2+离子的吸附量的影响。
2 结果与讨论
2.1 吸附时间对吸附量的影响
25℃条件下,壳聚糖对Ca2+、Mg2+离子的吸附速率曲线如图1所示。从图1中可以发现,在吸附的前60min,壳聚糖对Ca2+、Mg2+的吸附速率差别不大,都在2.3mg/g左右。吸附90min后两种离子的吸附量出现差异,Ca2+在此后吸附速率基本保持不变,吸附量稳步上升,在180min后Ca2+吸附基本达到平衡;Mg2+在吸附60min后,吸附速率明显下降,同样在吸附180min后基本达到平衡。两者吸附平衡时吸附容量不同的现象可能与两者的竞争吸附有关,由于壳聚糖与金属离子结合的位点有限,在吸附初期,壳聚糖对钙镁离子吸附均衡。当自由氨基、羟基减少时,Ca2+活性更大,离子交换作用、螯合作用更强,优先与壳聚糖结合,因此吸附速率在60min后不变,而Mg2+吸附速率降低。同时也与各个离子的吸附能力有关,60min后镁离子吸附容量变化不大,基本上达到饱和吸附,Ca2+尚未达到平衡。为了保证实验的准确性,以下吸附影响因素实验均取搅拌吸附时间为180min。

图1 壳聚糖对Ca2+、Mg2+的吸附速率曲线Fig.1 The adsorption rate curve of Ca2+and Mg2+by chitosan
2.2 pH值对吸附量的影响
壳聚糖在一定pH值(pH值<3)范围下会溶解形成凝胶,导致吸附性突变,影响吸附效果,不便于后处理。因而,在较低的pH值时,钙、镁离子会在壳聚糖颗粒上发生吸附,在溶胶化壳聚糖上也会发生大量吸附,所以实验中采用的pH值应≥4,以避免壳聚糖溶解;当pH值高于某一值时,钙镁离子会形成Ca(OH)2与Mg(OH)2沉淀,因此实验中选择的pH值范围为4~8。
考察pH值对壳聚糖吸附性量的影响,控制pH值在壳聚糖凝胶化pH值以上,Ca2+、Mg2+氢氧化物沉淀的临界pH值以下,即pH值在4~8之间。pH值对吸附量的影响如图2所示。由图2可见,当pH值在4~7之间时,随着pH值的增大,壳聚糖吸附Ca2+、Mg2+离子能力都有一定程度的增强;pH值为7时,Ca2+、Mg2+离子的吸附容量最大;当pH值大于7时,吸附容量反而大幅度减少,降至与pH值=4时的吸附容量值附近。

图2 pH值对吸附容量的影响Fig.2 The effect of pH value on the adsorption capacity
这种吸附值在pH值=7附近发生突变的现象表明,中性条件下CS对Ca2+、Mg2+离子吸附性最好。出现这种现象可能是由于此时容易发生壳聚糖分子中-NH2与Ca2+、Mg2+的螯合作用有关,这种螯合作用促进了壳聚糖对两种离子的吸附[19]。其螯合原理如图3所示。
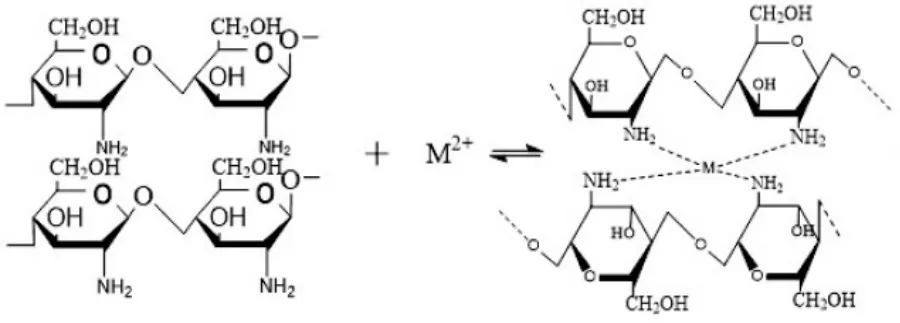
图3壳聚糖螯合钙镁离子方式Fig.3 The mode of chitosan chelating calcium magnesium ion
在酸性条件下,壳聚糖上的氨基先发生质子化,再以离子交换的形式与钙镁离子形成络合物以此吸附钙镁离子。

pH值较低时,壳聚糖上-NH2多以-NH3+形式存在,溶液中-NH3+的亲水性强,不利于与钙镁离子络合,因而吸附量较低。随着pH值升高,壳聚糖分子上的-NH3+量逐渐减少,-NH2不断增加,而-NH2与Ca2+、Mg2+离子的螯合作用使CS能吸附更多的两种离子。当pH值升至7时,吸附性最强。继续增大pH值,此时壳聚糖不仅体现螯合作用还有絮凝作用,二者作用相互对抗,吸附性开始减弱。
2.3 壳聚糖用量对吸附性的影响
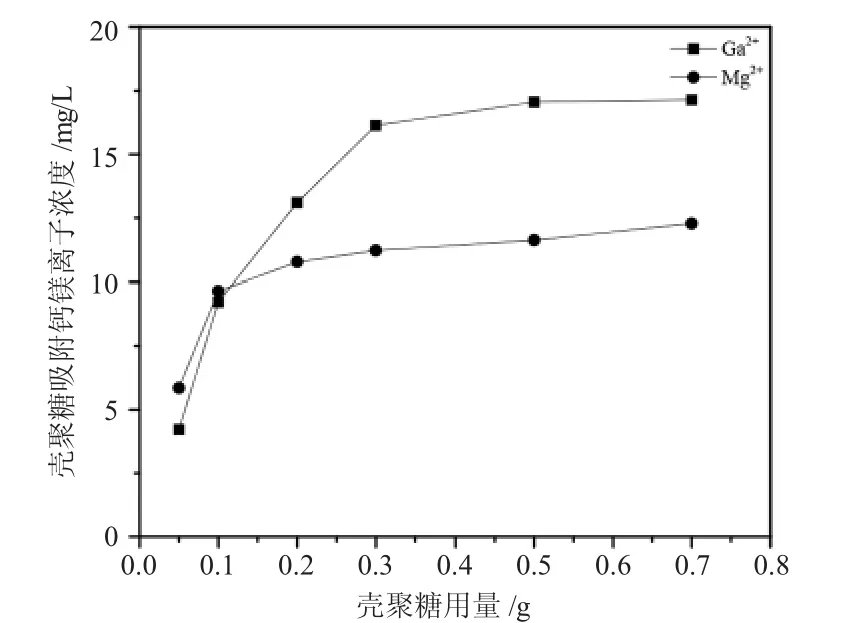
图4 壳聚糖用量对吸附性影响Fig.4 The effect of chitosan dosage on the adsorption
Ca2+、Mg2+离子的初始浓度为50mg/L、pH值为5.0~5.6、吸附时间为3h时,研究壳聚糖用量对吸附性能的影响。如图4,在CS用量为0.05~0.2g时,溶液中Ca2+、Mg2+浓度随CS用量的增加而降低,分别在CS用量为0.3g与0.2g时,Ca2+、Mg2+浓度变化趋于稳定。CS用量较少时Ca2+、Mg2+浓度下降较快,是因壳聚糖引入量增多,可接触的表面积增大,螯合的氨基也就增多,使得壳聚糖对钙镁离子的吸附性能增强;但在壳聚糖引入量增加到一定量时,离子浓度趋于稳定,出现这一特殊状态,是由于壳聚糖鳌合Ca2+、Mg2+时,氨基会释放氢离子改变溶液中的pH值。随着壳聚糖引入量继续增加,可鳌合的氨基越来越多,当增加到一定量时,因鳌合作用释放出的氢离子含量很大,使得溶液pH值降低。根据本文“2.2 pH值对吸附效果的影响”,pH值变化对吸附效果的影响较大,只有在中性区域的吸附效果最好。壳聚糖因鳌合作用释放的氢离子降低了溶液pH值,使CS对钙镁离子的吸附性能下降。而壳聚糖的引入量增多,可接触的表面积增大,氨基量也会增多,使吸附性能上升。pH值与壳聚糖用量两个变量的影响达到平衡,最终使壳聚糖达到吸附平衡。Mg2+先达到吸附平衡的现象是受到诸多因素共同作用的结果,壳聚糖对Mg2+的吸附效果低于Ca2+,且pH值对Mg2+的影响略低于Ca2+。在pH值的影响因素相同时,又由“2.1吸附时间对吸附量的影响”的观点,Ca2+、Mg2+存在竞争吸附,CS对Mg2+吸附性差,先达到平衡。
2.4 粒径对吸附性能的影响
比表面积不同,壳聚糖对Ca2+、Mg2+的吸附性有很大差异。理论来说,壳聚糖目数越小,比表面积越大,吸附性越好,吸附量越大。但由图5所示,Mg2+吸附性随壳聚糖目数的增加呈上升趋势,Ca2+随壳聚糖目数增大吸附容量反而降低,变化规律与理论出现偏差。
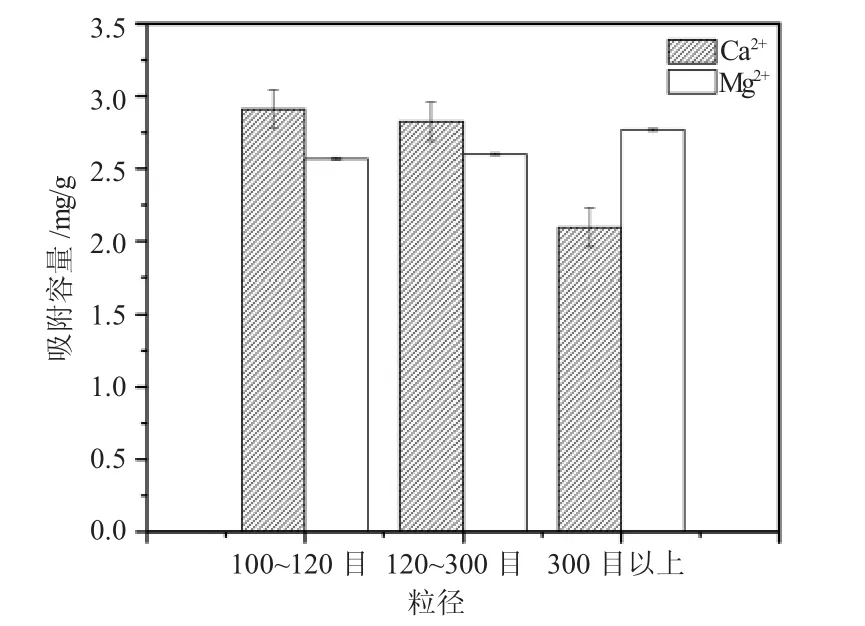
图5 壳聚糖粒径对吸附容量的影响Fig.5 The effect of chitosan particle size on the adsorption capacity
根据本文“2.2 pH值对吸附效果的影响”,很可能是由于随着比表面积的增大,吸附量增多,使得释放的H+增多,溶液达到一个新的吸附平衡,pH值进而影响了吸附性。故测试不同粒径吸附后溶液的pH值,探究其影响。

表1 粒径对吸附前后溶液pH值的影响Table 1 The effect of particle size on the pH value of solution before and after the adsorption
由表1可知,不同CS目数吸附后溶液pH值有了一定的变化。其中,Ca2+浓度吸附后变化较大。联合图2来看,CS粒径对Ca2+的影响:pH=4.8时,CS对Ca2+的吸附容量在3.2左右;pH=4.6时,Ca2+吸附容量在3.0左右,pH=4.4时Ca2+吸附容量在2.4左右;对于Mg2+,pH=5.0时CS对Mg2+吸附容量在2.7左右,pH=4.9时,Mg2+吸附容量在2.6左右,pH=4.8时,Mg2+吸附容量在2.6左右。与不同CS粒径对Ca2+吸附容量的变化规律一致。即该组实验受壳聚糖粒径与pH值共同作用影响。CS粒径大小影响其螯合作用所释放的H+含量,H+浓度又决定pH值从而反作用于CS的吸附性能。
由图2可知,Ca2+受pH值影响较大,在pH=4~5内,随pH值降低,钙离子吸附容量急剧下降,此时,虽壳聚糖比表面积增大,但pH值为主导因素,客观表现为虽然CS粒径减小,但CS对Ca2+吸附容量减小;Mg2+在该pH值变化区间内,吸附容量变化很小,CS粒径占主导因素,即Mg2+吸附容量随CS粒径的减小而增大。
3 结 论
壳聚糖作为一种生物质环保型材料对部分重金属盐离子具有良好的吸附效应,能吸附水体中的Ca2+、Mg2+。CS对Ca2+、Mg2+的吸附在3h后达到平衡,期间前1h CS对Ca2+、Mg2+吸附速率相同,之后由于Ca2+活性更大,使CS对Ca2+吸附速率比对Mg2+快,CS对Mg2+的吸附量趋于稳定;在pH=7左右时,CS对Ca2+、Mg2+的吸附性最好,且Ca2+受pH值影响很大。受盐离子的沉降作用与CS凝胶化影响,无论升高、降低pH值都会减弱CS吸附性;CS用量越多,Ca2+、Mg2+吸附量越大,CS为0.3g,Ca2+达到平衡。CS为0.2g,Mg2+达到平衡;CS粒径与pH值共同作用体现CS对Ca2+、Mg2+吸附性,Ca2+受pH值作用大,吸附容量随粒径的减小而减小,而CS对Mg2+的吸附容量,粒径占主导因素,随粒径减小而增大。壳聚糖作为可生物降解材料,不仅环保,而且耗能少,在吸附后,经过酸处理,可得到重复利用的壳聚糖,对吸附、回收钙镁离子具有很大的社会意义和经济价值,有丰富的研究前景。

