木尔坦棉花曲叶病毒“C4 ORF”编码蛋白对病毒致病性的影响
郑信诗,尚鹏祥,李景远,丁新伦,吴祖建,张洁
福建农林大学植物保护学院植物病毒研究所/闽台作物有害生物生态防控国家重点实验室/福建省植物病毒学重点实验室,福州 350002
0 引言
【研究意义】双生病毒科(Geminiviridae)病毒是一类植物单链环状 DNA病毒,世界上的热带、亚热带等地区均有分布,为典型的双联体颗粒形态,大小约22 nm×38 nm[1-2]。双生病毒的寄主范围广阔,能够侵染多种单子叶及双子叶植物,由烟粉虱、叶蝉等昆虫介体以持久性方式进行传播,对世界各地的农作物造成重大经济损失[3-5]。菜豆金黄花叶病毒属(Begomovirus)是双生病毒科最大的属,从基因结构上分成了单组分begomovirus与双组分begomovirus[1]。木尔坦棉花曲叶病毒(cotton leaf curl Multan virus,CLCuMuV)是单组分 begomovirus,基因组仅含DNA-A,伴随一个β卫星分子(betasatellite)[6-7]。自2006年在我国发现由CLCuMuV侵染引起的朱槿曲叶病以来[7],该病毒已经在我国江苏、福建、海南、广西、广东等省(自治区)多个地区发生,可侵染棉花、黄秋葵、扶桑及垂花悬铃花等多种寄主植物[8-13]。CLCuMuV可以随昆虫介体烟粉虱及带病苗木传播,对我国的棉花产区造成潜在威胁[7,12]。【前人研究进展】CLCuMuV基因组的DNA-A大约2.7—2.8 kb,含6个ORF,2个在病毒链方向,编码V1和V2蛋白,4个在互补链方向,编码C1、C2、C3和C4蛋白[6-13]。CLCuMuV伴随的β卫星分子,仅编码一个βC1蛋白,β卫星依赖DNA-A组分进行复制[11-12,14-16]。双生病毒C4编码11.3 kD蛋白,是一个症状决定因子,可编码复制或转录调控因子,影响植物正常细胞发育,引起叶脉肿大等症状,也具有沉默抑制子活性[17-20]。2018年,ISMAYIL等发现CLCuMuV C4通过抑制S-腺苷甲硫氨酸合成酶(SAMS)活性来抑制转录水平基因沉默(TGS)和转录后水平基因沉默(PTGS),从而增强植物中CLCuMuV的侵染[21]。【本研究切入点】通过对NCBI登录的多个CLCuMuV分离物的序列进行分析,发现不同CLCuMuV C4开放阅读框附近可编码不同大小的ORF,而NCBI数据库登录的C4蛋白大小也不尽相同,甚至利用NCBI ORF Finder在线分析软件在部分CLCuMuV分离物中找不到目前公认的最小ORF,鉴于此,本研究对CLCuMuV的多个假定的“C4 ORF”编码的蛋白进行分析。【拟解决的关键问题】分析C4附近不同ORF对病毒致病性的影响,为C4开放阅读框的确切定位提供依据。
1 材料与方法
试验于 2018—2019年在福建农林大学植物病毒研究所完成。
1.1 材料及主要试剂
CLCuMuV感病植株总DNA(CLCuMuV DNA-A的序列登录号为 JX861210,DNA-β序列登录号为JX861211)、PVX 载体、pDONR221载体、pEarleyGate-101载体、pBINPLUS载体、农杆菌(Agrobacterium)GV3101 感受态、大肠杆菌(Escherichiacoli)Trans1-T1 Phage Resistant感受态、YFP-C4-S载体、DNA-β侵染性克隆重组质粒农杆菌、CLCuMuV C4蛋白多克隆抗体、本氏烟(Nicotianabenthamiana)种子均由本实验室保存。
同源重组酶试剂盒(ClonExpressTMUltra One Step Cloning Kit)和高保真酶试剂盒(PhantaTMSuper-Fidelity DNA Polymerase)均购自南京诺唯赞生物科技有限公司,Gateway LR/BP Clonase II Enzyme Mix试剂盒购自Invitrogen公司。
本研究所用到的引物序列见表1。
1.2 载体构建
1.2.1 PVX载体构建 以实验室保存CLCuMuV感病植株总DNA为模板,根据NCBI登录的CLCuMuV DNA-A序列设计CLCuMuV C4 L、M、S的ORF特异性扩增引物(表1)。PCR反应条件为95℃预变性5 min,95℃变性 30 s,50℃退火 35 s,72℃延伸 30 s,30个循环后72℃继续延伸5 min。将反应产物在1%琼脂糖凝胶中电泳,目的条带经由 DNA凝胶纯化试剂盒回收纯化。通过同源重组的方法,将回收纯化的片段与线性化PVX载体(SmaI 37℃ 酶切70 min)进行连接。热激法转化大肠杆菌后利用引物PVX-F/PVX-R(表1)筛选阳性克隆,即获得最终植物表达载体 PVX-C4-L、PVX-C4-M、PVX-C4-S。测序结果正确的提取质粒电击法转化农杆菌GV3101感受态细胞,PCR检测阳性克隆。
1.2.2 亚细胞定位载体构建 利用设计的特异性引物(表 1)对所需片段进行 PCR扩增并回收。利用Gateway系统BP反应构建中间载体,将回收的片段与pDONR221载体重组,转化大肠杆菌。利用引物M13-F/M13-R(表1)筛选阳性克隆并进行测序验证,然后提取质粒,MluI酶切中间载体并回收大片段,通过LR反应将其构建至终载体pEarleyGate-101并转化大肠杆菌,利用引物Gateway-F/Gateway-R(表1)鉴定阳性克隆,即获得最终植物表达载体YFP-C4-L。将终载体用电击法转化农杆菌GV3101,PCR检测阳性克隆。
1.2.3 侵染性克隆载体构建 根据 CLCuMuV基因组的序列,设计引物CLCuMuV-R-F/R与CLCuMuVL-F/R(表1)分别扩增其全长基因组和缺失基因组,延伸时间为170 s,扩增得到均为2 700 bp左右条带,PCR产物进行回收纯化;将pBINPLUS空载用限制性内切酶Hind III和SmaI线性化,通过同源重组,将回收纯化的目的条带与回收纯化的线性化pBINPLUS克隆载体连接,获得重组质粒;将重组质粒转到大肠杆菌中,利用引物pBIN-F/pBIN-R(表1)进行阳性克隆检测,测序结果正确的克隆进行质粒提取,即为侵染性克隆重组质粒CLCuMuV。将终载体用电击法转化农杆菌GV3101,PCR检测阳性克隆。
1.2.4 侵染性克隆突变载体构建 获得的重组质粒CLCuMuV为模板,用限制性内切酶BamH I和SmaI将未缺失基因组切下,PCR产物回收纯化后作为模板,利用引物C4L-i2o-R-pBIN-F/CLCuMuV-R-R、C4L-i2o-R-pBIN-R/CLCuMuV-R-F、C4S-G2O-R-pBIN-F/CLCuMuVR-R、C4S-G2O-L-pBIN-R/CLCuMuV-R-F(表 1)分别扩增片段并回收,回收片段命名为C4-L-1、C4-L-2、C4-S-1、C4-S-2;利用引物 CLCuMuV-R-R/CLCuMuVR-F(表 1)将 C4-L-1和 C4-L-2、C4-S-1和 C4-S-2分别进行同源重组,构建C4-ΔL和C4-ΔS的突变片段,将PCR产物回收纯化;用限制性内切酶BamH I和SmaI对CLCuMuV侵染性克隆载体进行酶切,将其回收纯化;通过同源重组,使用两组引物 CLCuMuVRBamH1-pBIN-F/C4L-i2o-R-pBIN-R、CLCuMuVRBamH1-pBIN-F/C4S-G2O-L-pBIN-R 分别将 C4-ΔL和 C4-ΔS与线性化的 CLCuMuV侵染性克隆载体连接;重组质粒转到大肠杆菌中,利用引物 pBIN-F/pBIN-R(表1)进行阳性克隆检测,测序结果正确的克隆进行质粒提取,即为突变体侵染性克隆重组质粒CLCuMuV-ΔL、CLCuMuV-ΔS。其中 CLCuMuV-ΔL和CLCuMuV-ΔS分别将C4-L和C4-S ORF第2位氨基酸突变为终止密码子。将终载体用电击法转化农杆菌GV3101,PCR检测阳性克隆。
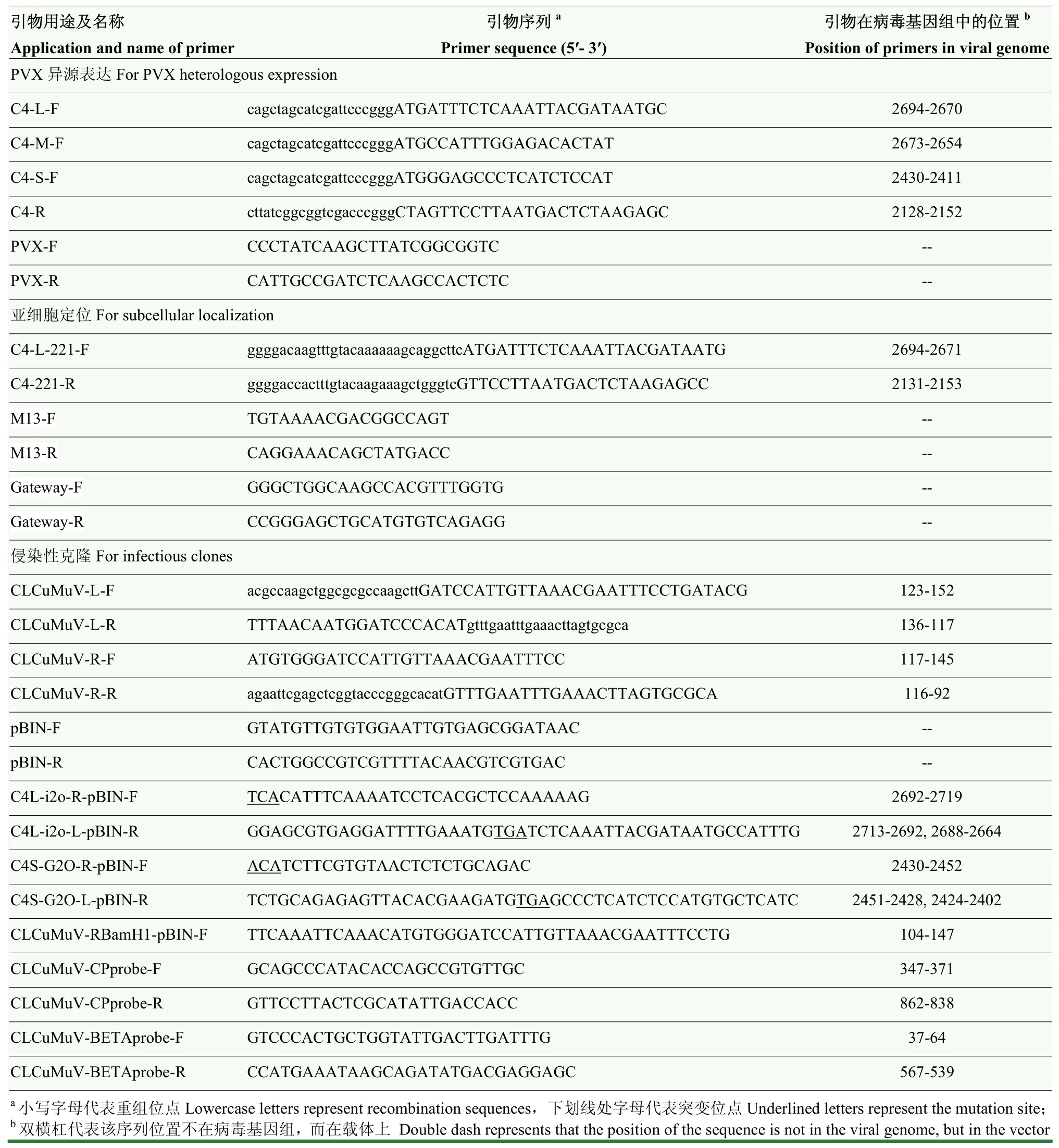
表1 本研究中所用引物序列Table 1 Primers used in this study
1.3 农杆菌介导的植物接种
将新鲜培养的阳性克隆农杆菌菌液离心去除上清后,加入新鲜配置的烟草浸润缓冲液(10 mmol·L-1MgCl2、10 mmol·L-1MES pH 5.7、200 μmol·L-1AS),调整其OD600≈1.0,室温下静置3—4 h后接种长至5—6片叶的本氏烟。接种后的植株培养于26℃、14 h光照/10 h黑暗的光照培养箱。侵染性克隆接种试验中需将重组质粒农杆菌分别与 DNA-β重组质粒农杆菌等比例混合接种本氏烟。
1.4 激光共聚焦显微镜观察
浸润48 h后,剪取浸润区叶片让其叶背朝上放置在载玻片上,滴上清水后盖上盖玻片,要注意避免产生气泡,在激光共聚焦显微镜(Leica TCS SP5 Ⅱ)下观察并拍照。
1.5 蛋白检测
取0.3 g接种后的新叶叶片组织,液氮研磨后加900 μL 蛋白抽提液(50 mmol·L-1Tris-HCl pH 8.0、150 mmol·L-1NaCl、0.2% Tween-20、2%β-巯基乙醇、蛋白酶抑制剂1片/10 mL),离心后吸上清液至新的2 mL EP管,-20℃保存。取 10 μL总蛋白与 2.5 μL蛋白Loading混匀,100℃水浴锅内煮15—20 min,12 000×g离心5 min后置于12% SDS-PAEG电泳,同时电泳两块胶。将一块凝胶泡在考马斯亮蓝染色液中置于水平摇床染色1—2 h,染色结束后加水煮胶进行脱色。将另外一块凝胶通过电转法转印到 PVDF膜上。Western blot检测方法参考文献[22]进行。其中一抗使用1∶1 000稀释的CLCuMuV C4蛋白多克隆抗体,二抗使用1∶5 000稀释的HRP标记的羊抗鼠IgG。最后将PVDF膜置于检测反应液中避光孵育1 min,于自动化学发光凝胶成像分析仪(Amershm Imager600)中曝光10 s显色。
1.6 DNA检测
植物总DNA的提取采用 CTAB法[23]。Southern blot检测采用 Roche DIG High Prime Lab/Detection Kit,详细步骤参见其说明书。
2 结果
2.1 CLCuMuV“C4 ORF”编码蛋白的致病性
2.1.1 PVX表达载体的构建 通过序列分析,对CLCuMuV C4开放阅读框附近的3个ORF(图1-A)分别设计了引物,其中片段之间重复序列完全一致,也即起始密码子均位于同一个大的开放阅读框,并且共用同一个终止密码子。PCR结果显示分别扩增到C4-L(567 bp)、C4-M(546 bp)和C4-S(303 bp)的片段(图1-B)。利用同源重组将该3个目的片段与 PVX线性化处理后的载体连接,获得重组载体PVX-C4-L、PVX-C4-M与PVX-C4-S。
2.1.2 PVX介导的3个蛋白在本氏烟表达对本氏烟症状影响比较 重组载体转化农杆菌后分别接种本氏烟,结果发现接种17 d后PVX-C4-L、PVX-C4-M与PVX-C4-S接种的植株略高于PVX空载接种对照,叶片卷曲,并且叶柄有伸长的现象,其症状严重程度由强至弱依次为 PVX-C4-S、PVX-C4-L、PVX-C4-M,接种25 d后PVX-C4-S叶片卷曲症状更加明显,值得注意的是PVX-C4-S叶片多为上卷,而PVX-C4-L和PVX-C4-M叶片下卷(图2-A),测量叶柄长后发现,PVX-C4-S、PVX-C4-L接种组的长度明显长于 PVX-C4-M及对照组(P<0.01)(图2-B)。结果表明C4-S ORF编码的蛋白致病性最强,C4-L ORF次之,而C4-M ORF编码蛋白的致病性非常弱。
2.1.3 PVX介导 C4蛋白在本氏烟植株中表达的检测 为验证C4蛋白在PVX异源载体中的表达,提取接种25 d后烟草新叶总蛋白进行Western blot检测,结果发现PVX-C4-L与PVX-C4-S接种的烟草叶片中均检测到 C4蛋白的表达,遗憾的是虽然经过多次重复,PVX-C4-M 没有检测到特异蛋白的积累(图2-C)。
2.2 CLCuMuV“C4 ORF”编码蛋白的亚细胞定位
为分析C4-L和C4-S的亚细胞定位情况,将重组表达载体YFP-C4-L和YFP-C4-S分别利用农杆菌介导的植物接种法浸润本氏烟叶片,48 h后,剪取本氏烟叶片表皮细胞于激光共聚焦显微镜下观察。结果发现YFP-C4-L主要定位在叶绿体,YFP-C4-S则是定位在细胞膜或细胞质周边,并且在细胞膜上可以观察到点状聚集体结构(图3)。
2.3 CLCuMuV及其突变体侵染性克隆接种
2.3.1 CLCuMuV及其突变体侵染性克隆接种本氏烟 为分析不同“C4 ORF”对病毒诱导寄主症状的影响,将 CLCuMuV、CLCuMuV-ΔL、CLCuMuV-ΔS分别与DNA-β侵染性克隆等比例混合接种本氏烟,以未转化质粒的农杆菌接种本氏烟为阴性对照(Mock)。结果发现接种7 d后CLCuMuV、CLCuMuV-ΔL接种的植株新叶即有向下卷曲的现象(图片未示出);接种14 d和21 d后,叶片出现明显的皱缩并且增生、叶柄和茎秆扭曲,植株的高度明显矮于Mock和CLCuMuV-ΔS,CLCuMuV-ΔS与Mock相同,没有出现症状(图4-A)。结果说明病毒对寄主症状的诱导过程中,C4-L不是必需,C4-S起到重要作用。
2.3.2 接种本氏烟植株的病毒DNA检测 为检测病毒基因组在接种烟草叶片中的复制积累情况,利用CLCuMuV的CP基因设计探针,对接种21 d后提取的叶片总 DNA进行 Southern blot检测,结果发现CLCuMuV、CLCuMuV-ΔL接种的烟草叶片中均能检测到病毒DNA-A的积累,而CLCuMuV-ΔS以及Mock没有检测到病毒DNA-A的积累(图4-B)。同时,利用DNA-β组分设计探针,对接种21 d后提取的叶片总DNA进行Southern blot检测,结果发现CLCuMuV、CLCuMuV-ΔL接种的烟草叶片中均能检测到病毒 DNA-β的积累,而 CLCuMuV-ΔS以及Mock均未检测到病毒DNA-β的积累(图4-C)。结果说明病毒对寄主症状的诱导与病毒基因组的积累成正比。
2.3.3 接种本氏烟植株的C4蛋白检测 为检测病毒C4蛋白在接种烟草叶片中的表达情况,提取接种14 d叶片总蛋白,以C4蛋白多克隆抗体为一抗进行Western blot检测。结果发现CLCuMuV和CLCuMuV-ΔL接种的烟草叶片中检测到了 C4蛋白,且蛋白积累量基本一致,而CLCuMuV-ΔS以及Mock没有检测到C4蛋白的积累。值得注意的是,CLCuMuV接种的烟草蛋白检测条带跟CLCuMuV-ΔL十分一致,即C4蛋白抗体未能够在CLCuMuV接种的烟草中检测到C4-L蛋白的表达(图 4-D)。结果说明病毒在侵染寄主过程中或许并不编码C4-L蛋白。
3 讨论
利用MEGA软件对国内外50多种CLCuMuV分离物的全基因组进行系统发育关系分析,结果发现印度、巴基斯坦、泰国、菲律宾等地的分离物亲缘关系较近,聚类为一个大分支,而所有来自中国的分离物聚类为一个大分支。值得注意的是,通过编码 ORF序列分析,发现来自中国的CLCuMuV C4 ORF均为567 nt,国外绝大部分为303 nt以及个别546 nt,而NCBI登录的C4蛋白的大小也不尽相同。本研究利用PVX异源表达载体发现PVX-C4-L和PVX-C4-S具有较强致病性,PVX-C4-M的致病性可忽略不计。更进一步利用侵染性克隆接种试验发现C4-S ORF对病毒的侵染不可或缺。然而Southern blot在CLCuMuV-ΔS突变体上检测不到病毒DNA-A和DNA-β组分,推测可能的原因之一是 C4-S ORF的缺失使病毒基因组DNA-A的复制受到了影响,而β卫星需要依赖DNA-A组分进行复制[12,14-16,24-25],所以β卫星的复制也受到了影响;再者也可能是C4-S ORF的缺失影响病毒的运动,导致病毒无法正常运动而不能进行系统侵染,这与已报道的C4蛋白参与病毒的运动[26-28]一致。
亚细胞定位被认为与蛋白质所发挥的功能有关,亚细胞定位的信息将有助于推断蛋白质功能,进而研究其作用机制。番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)C4定位在细胞周边并与胞间连丝互作[28],在病毒运动中介导细胞间的转运。同样,云南番茄曲叶病毒(tomato leaf curl Yunnan virus,TLCYnV)C4蛋白也被证实定位在细胞膜,通过增强CyclinD1.1的稳定性,抑制NbSKη介导的磷酸化而诱导细胞分裂[29]。甘薯卷叶病毒(sweet potato leaf curl virus,SPLCV)的 C4蛋白主要与质膜中的 AtBIN2相互作用,激活 AtBES1/AtBZR1成分,从而使它们可以进入细胞核并激活BR反应基因的转录[30]。这些说明 C4蛋白的膜定位与其功能的发挥存在密切的联系。本研究结合之前的研究[31]发现YFP-C4-S蛋白主要定位在细胞膜上或细胞质周边,并且在细胞膜上可以观察到点状聚集体结构,推测其与胞间连丝相关,与前人的研究结果一致。而YFP-C4-L主要定位在叶绿体,结合病毒侵染寄主后 C4蛋白的 Western blot检测结果,或许暗示了其不作为CLCuMuV致病ORF而存在。
4 结论
CLCuMuV的3个假定的“C4 ORF”编码蛋白中,C4-S对CLCuMuV的侵染必不可少,而C4-L和C4-M对CLCuMuV的侵染不是必需。
——一道江苏高考题的奥秘解读和拓展

