番茄SlSIP1L12基因负调控种子萌发的研究
崔宝禄,陈国平
(1. 黔南民族师范学院,贵州 都匀 558000;2. 重庆大学,重庆 沙坪坝 400044)
0 引言
【研究意义】Trihelix转录因子属植物特有,其SIP1亚家族基因调控植物生长发育的研究还不成熟。番茄作为双子叶模式植物和重要的蔬菜作物,其SIP1亚家族基因的研究更是被边缘化。因此,研究SIP1亚家族基因的功能与调控模式,对提高该家族基因的认识、增强作物改良的力度具有重要意义。【前人研究进展】农杆菌Ti质粒特定区域含有生长素或细胞分裂素的编码基因,其中tml位点(6b基因)参与了植物器官肿瘤的形成。部分植物Trihelix转录因子可与6b编码的蛋白质互作,被称为Nicotiana tabacum 6b-interacting protein 1(NtSIP1),其编码基因主要在根、茎、成熟叶和植物顶端区均有表达;NtSIP1包含2个保守域,核定位信号区和DNA结合区;NtSIP1可促进6b蛋白与下游基因启动子的结合,从而实现植物细胞的增殖;NtSIP1 对6b蛋白进入细胞核有促进作用,并通过转基因试验证实,NtSIP1与植物细胞增殖、细胞分裂等功能有关[1]。拟南芥中,与6b互作的蛋白Arabidopsis 6binteracting protein 1-like 1(ASIL1)属于Trihelix转录因子,突变体asil1子叶性状发生改变:幼苗积累白蛋白、脂肪酸等代谢物质,重要的是ASIL1可识别GT-box[2]。蛋白质结构分析表明:ASIL1的N末端和中心结构域变化较大,氨基酸序列中含有核定位信号和甘氨酸/脯氨酸富集区[2]。以上分析表明,Trihelix转录因家SIP1亚家族蛋白可与6b蛋白互作,其功能研究多见于植物种子。许多植物的基因组中均发现了SIP1亚家族的基因信息。禾本科植物谷子(Setaria italia)中含有10个基因[3];苦荞麦(Fagopyrum tataricum)中有9个假定的SIP1基因[4];而十字花科大白菜(Brassica Rapa)中,发现19个假定的SIP1基因[5]。除此之外,yu等[6]研究证实,茄科植物番茄基因组中含有12个假定的SIP1亚家族基因,11个基因含有0~1个内含子,Solyc09g008850含有6个内含子,编码256~532个氨基酸;在非生物胁迫和激素诱导下,利用转录组测序技术,初步分析了Solyc12g010890和Solyc07g055100基因响应外源因素的情况。【本研究切入点】虽然多种植物的SIP1亚家族基因被发现,但其生物功能的研究还不尽人意,有待进一步深入。番茄作为重要的模式植物,具有基因组小、基因组测序完整、遗传转化效率高且稳定等诸多优点,但番茄中SIP1亚家族基因的功能尚不明晰。【拟解决的关键问题】本研究以番茄自交品种AC++为研究对象,利用RNAi干扰技术抑制了番茄体内SLSIP1L12基因的表达,鉴定了番茄中SLSIP1L12基因的生物功能,为丰富Trihelix转录家族SIP1亚家族基因的遗传信息提供了参考,更为茄科植物的新品种选育提供理论基础。
1 材料与方法
1.1 试验材料
本研究采用番茄野生品种AC++(Solanum lycopersicom Mill. cv. Ailsa Craig,引自重庆大学,属于高度自交品种,遗传性状稳定、适应性强),种植在黔南民族师范学院温室大棚中,光照16 h(27 ℃)和黑暗8 h(19 ℃)。待植株开花结果后,分别选取成熟植株的根、茎、叶、花,果实分为未成熟果实(Immature green,IMG)、成熟果实(Mature green,MG)、破色果实(Breaker, B)、破色后4 d(B+4)、破色后7 d(B+7),见图1所示。所有材料液氮速冻后,存放于−80 ℃冰箱。
1.2 番茄SlSIP1蛋白的生物信息学分析
将拟南芥、番茄等已知物种报道的基因序列在茄科基因组数据库SGN中搜索番茄所有SlSIP1蛋白的氨基酸序列。将检索的氨基酸序列进行多重序列比对,根据比对的结果确定该基因编码的氨基酸序列可能的保守结构域。利用氨基酸序列进行生物进化分析,预测该基因的生物功能。cDNA和基因组的比对采用网站(http://multalin.toulouse.inra.fr/multalin/multalin.html)完成;保守区预测采用网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)完成;多重序列比对采用软件ClustalX 和DNAMAN,进化树分析采用软件MEGA10。
1.3 基因克隆
利用RNAiso Plus提取试剂提取番茄材料RNA,利用M-MLV反转录酶对RNA进行反转录,获得组织材料的cDNA作为基因克隆模板。搜索NCBI和SGN数据库,设计引物cSlSIP1L12-F和cSlSIP1L12-R,扩增出编码序列,连接到pMD19-T载体上测序。
1.4 植物激素和非生物胁迫处理
番茄AC++种子播种于营养钵中,生长35 d后用于外源激素的处理和非生物胁迫[7]。
生长35 d的番茄幼苗,分别接受喷水(一次性喷水,直到所有叶片滴水为止)、脱水(在水中清洗幼苗根系,直至土壤清洗干净。放于室温后,开始取样,取处理的幼苗中部叶片)、机械损伤(取幼苗中部叶片,用剪刀剪碎叶片至长宽约为1 cm)处理0、1、2、4、8、12、24、36 h后,将处理材料放入液氮速冻后,存放于−80 ℃冰箱[8]。
生长35 d的番茄幼苗,分别采用喷水(对照,CK)、50 μmol·L−1IAA、50 μmol·L−1GA3、50 μmol·L−1茉莉酸 甲 酯(MeJA)、100 μmol·L−1ABA、100 μmol·L−1ACC喷淋1次,直到所有叶片开始滴水为止,分别于0、1、2、4、8、12、24 h后,取幼苗中部叶片放入液氮速冻后,存放于−80 ℃冰箱[9]。
1.5 RT-PCR分析
所有材料采用Trizol试剂提取总RNA,定量PCR采 用SYBR Premix Ex Taq II kit(Promega)体系:5.0 μL 2×SYBR Premix酶、0.5 μL引物、1.0 μL cDNA、3.5 μL去离子水。表达模式分析和转基因沉默效率鉴定采用基因SlCAC为内参,处理采用基因SlEF1a为内参[10],具体引物见表1。

表 1 引物设计Table 1 Primers applied
1.6 SlSIP1L12基因沉默株系的建立
以cDNA为模板,以SlSIP1L12-F和SlSIP1L12-R为引物,以Primer Star mix酶高保真扩增后,连接到pMD19-T载体上测序,序列比对分析后得到片段大小为455 bp的基因特异序列。采用双酶切方式以正、反向的方式连接到中间载体pHANNIBAL,再连接到终载体pBI19上。然后,通过将质粒转移至农杆菌LBA4404中,侵染番茄子叶,诱导愈伤组织,获得转基因幼苗,诱导生根,利用卡那霉素编码基因NPTII设计引物,鉴定转基因阳性植株。以 qSlSIP1L12为引物,利用qRT-PCR检测转基因株系的沉默效率。
1.7 种子发芽试验
50粒均匀的转基因和AC++种子播种在含有2层湿润滤纸的培养皿中(蒸馏水或加入了消毒剂硫柳汞),黑暗条件下,放入(15±1) ℃的培养箱中培养,以胚根突出种皮2 mm作为萌发的标准,检测种子 的发芽率,试验重复3~5次[11]。
1.8 种子体内ABA总含量检测
ABA含量的测定采用ABA的ELISA试剂盒(上海生工)[12],试验方法是:0.1 g发芽种子(转基因和AC++种子在发芽7 d后),用滤纸吸水后,用液氮研磨,80%的甲醇抽提,1 000 r·min−1离心20 min,取上清液,用孔径为0.45 μm的滤膜清除杂质后,按照ELISA说明书进行操作,在波长450 nm下检测结果,并利用标准曲线鉴定ABA含量。
2 结果与分析
2.1 SlSIP1L12基因生物信息分析
以番茄AC++的cDNA为模板,扩增SlSIP1L12基因(基因ID:Solyc12g043090)的编码序列。经测序证实,总长为1 125个碱基,编码374个氨基酸,比报道的番茄品种1 706少3个碱基/1个氨基酸[6],缺少的氨基酸是N末端第61位的谷氨酸,这可能与所用番茄的品种有关。进一步分析表明,该氨基酸序列的保守区位为135~222和302~358区段,保守区可形成Trihelix结构域、第四螺旋和一个保守中央结构域(图2);核定位单元信号为193~203和212~221区段。图3进化分析表明,番茄SlSIP1L12与SlSIP1L5位于同一分枝,但SlSIP1L12与所有检测蛋白序列的一致性均低于47.2%(表2),说明,番茄内部SIP1亚家族进化较明显。
2.2 SlSIP1L12基因表达模式分析
为进一步预测基因的生物学功能,利用RTPCR检测了SlSIP1L12基因在番茄品种AC++不同组织中的表达水平。结果表明,基因SlSIP1L12在茎、成熟叶中表达量最高,在花、果实等生殖器官和组织中次之,在根、幼叶中表达量最低(图4)。
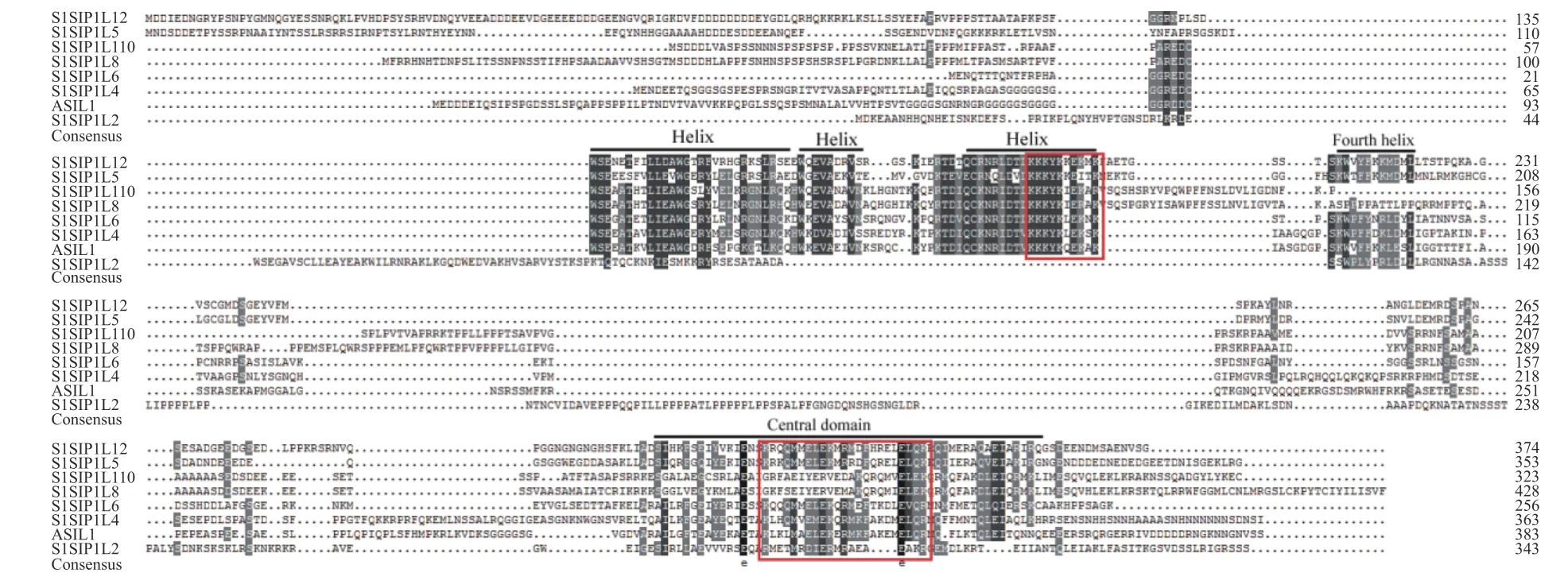
图 2 SIP1亚家族蛋白结构Fig. 2 The structure of SIP1 proteins

图 3 生物进化分析SIP1亚家族蛋白质Fig. 3 Phylogenetic analysis of SIP1 proteins

表 2 氨基酸序列一致性分析Table 2 The similarity of SIP1 proteins
2.3 SlSIP1L12对外源植物激素和非生物胁迫的响应
图5-A表明,IAA、GA3、MeJA和ACC(乙烯合成的前体)等4种激素处理24 h后,SlSIP1L12基因表达水平并未发生显著变化,而接受ABA处理时,SlSIP1L12基因的表达水平出现明显变化:2 h后SlSIP1L12表达水平逐步提高,8 h后达到最高,为初始表达量的4.6倍。初步预测,SlSIP1L12是ABA下游的响应基因。图5-B显示,在接受机械损伤诱导时,SlSIP1L12的表达水平相比对照较稳定;而脱水胁迫时,SlSIP1L12的表达受到显著诱导,处理2 h后,SlSIP1L12基因的表达水平开始提高,36 h后,它的表达量最高,是初始水平的8.9倍。综上所述,SlSIP1L12基因的功能可能与ABA的响应有关。
2.4 转基因株系的鉴定
经转基因鉴定,获得6个沉默株系(图6),沉默效率为64%~83%,而沉默效率最高的株系RNAi-13未结出果实。因此选择沉默效率相对较高的2个株系RNAi-4和RNAi-5作为进一步研究对象。

图 4 AC++不同组织中SlSIP1L12的表达模式Fig. 4 Expressions of SlSIP1L12 in different tissues of AC++
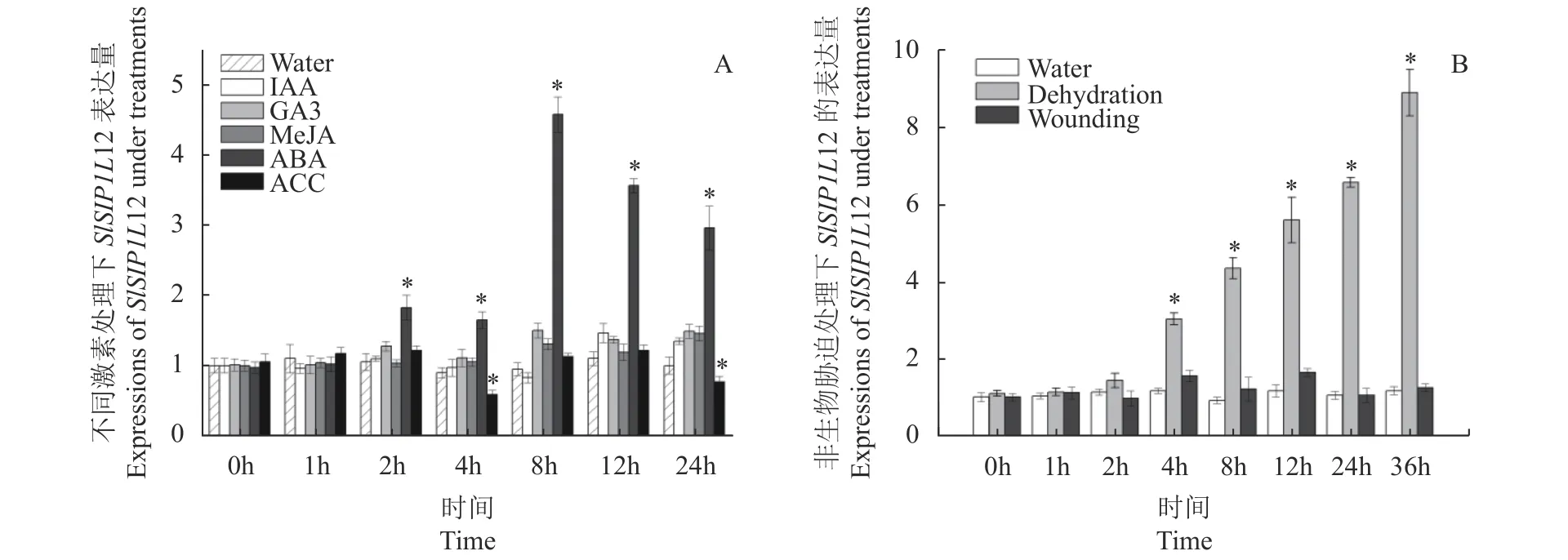
图 5 不同处理下SlSIP1L12基因的表达模式分析Fig. 5 Expressions of SlSIP1L12 under treatments by different stimuli

图 6 转基因不同株系中SlSIP1L12的表达水平Fig. 6 Expressions of SlSIP1L12 in RNAi-SlSIP1L12 lines
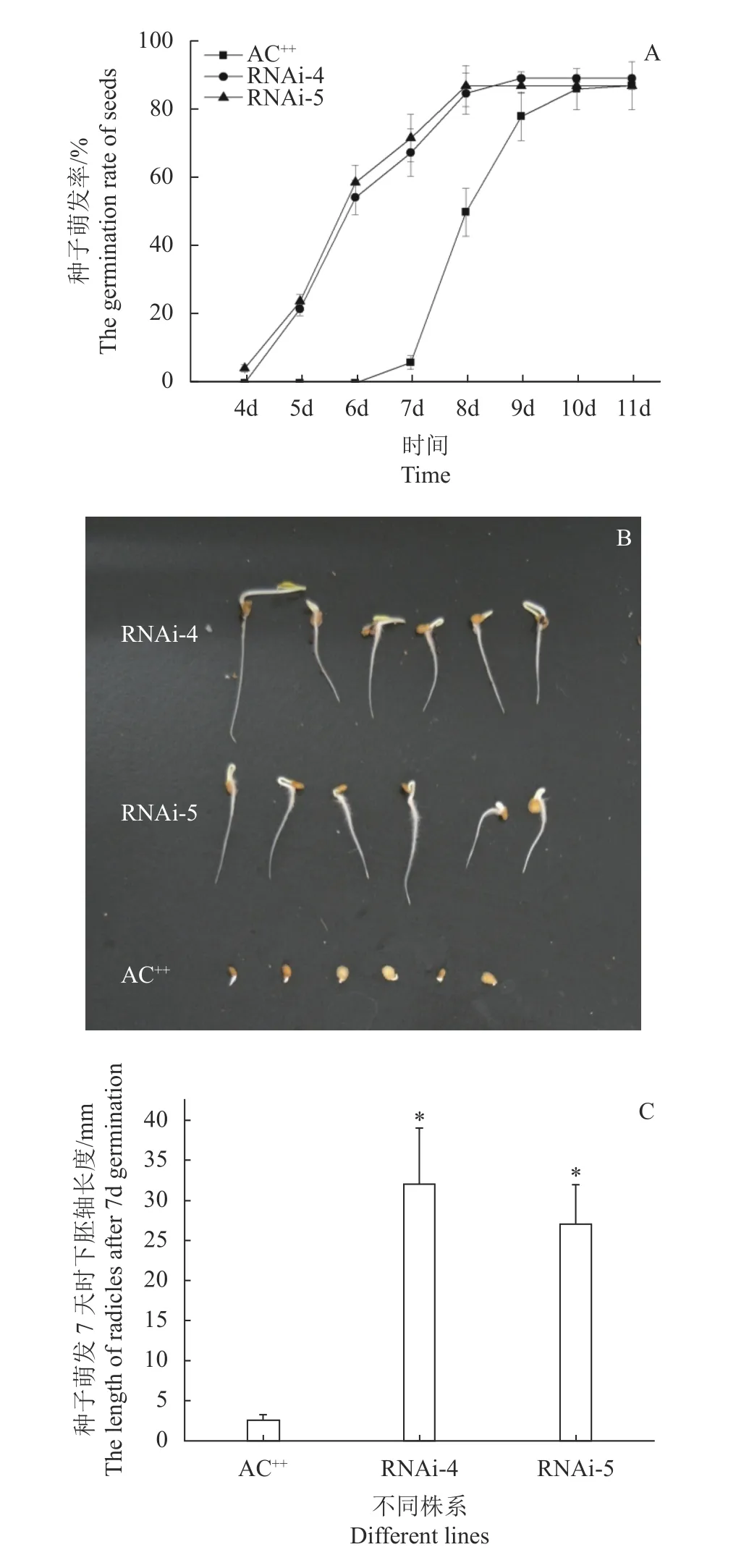
图 7 转基因植株和AC++种子的发芽试验 Fig. 7 Seed germination of transgenic and control plants
2.5 种子发芽情况的鉴定
本研究证实SlSIP1L12基因的表达受ABA诱导,而ABA对种子萌发有显著的抑制作用,推测抑制SlSIP1L12表达可提高种子萌发速度。转基因及对照番茄种子培养4 d后,RNAi-4和RNAi-5株系种子开始萌发,5~7 d时,转基因株系种子的胚根进入迅速萌发期,9 d后发芽率趋于稳定。而番茄AC++种子7 d后才开始萌发,7~9 d为快速萌发期,10 d后发芽率趋于稳定(图7-A)。在种子萌发7 d时,转基因株系的胚根长度是对照的10~15倍(图7-B、7-C)。以上试验结果表明,转基因株系的种子萌发速度比对照快2 d左右。
2.6 转基因植株发芽速度快的机理研究
为进一步分析转基因植株种子萌发速度快的原因,本研究检测了依赖于ABA信号途径的AREB基因和不依赖于ABA的DREB基因的表达水平[13]。图8-A证实,2个基因表达均受到了抑制,说明SlSIP1L12基因的沉默抑制了植株体内ABA响应。进一步分析种子萌发7 d后ABA的含量,发现转基因种子体内ABA的含量显著降低(图8-B)。因此,进一步证实了SlSIP1L12基因调控种子萌发的机理与ABA响应有关。
3 讨论与结论
Trihelix转录因子SIP1亚家族含有保守的Trihelix结构域(前2个螺旋结构的N端是保守的色氨酸,第三个螺旋的保守色氨酸被异亮氨酸取代)、第四螺旋和α-螺旋中心结构域[14]。SIP1蛋白保守区比对结果显示,SlSIP1L12属于SIP1亚家族(图2),但序列一致性分析证实,SIP1亚家族蛋白间的氨基酸一致性较低,说明了SIP1蛋白间保守区的序列一致性较强,但保守区以外的序列分化较明显。沉默株系植株的表型分析说明,该基因与NtSIP1的功能相似[1]。而SlSIP1L12是否为6b的互作因子待进一步证实。
植物激素ABA诱导或抑制了许多下游基因的表达变化,而下游基因转录水平的改变对ABA响应及其相关生理作用有一定的干扰或促进作用,进而改变植物的生长或适应能力[15−16]。本研究在进行激素和非生物胁迫处理时,发现SlSIP1L12响应ABA和脱水胁迫的诱导(图5)。因此推测,SlSIP1L12是ABA下游的响应基因,沉默SlSIP1L12的表达可能抑制植物对ABA响应。转基因试验证实,沉默株系的种子萌发速度比对照快2 d左右;发芽7 d后,转基因株系胚根的长度是对照的10倍左右(图7)。通常种子的萌发分为三个阶段:吸水期、代谢期和萌发期。后两个发育阶段必然会受到激素的调控作用[17-18]。DREB为不依赖于ABA的胁迫诱导基因,AREB为依赖于ABA的胁迫诱导基因[19]。而试验结果表明,AREB和DREB的表达水平均受到显著抑制,说明抑制SlSIP1L12的表达除了降低ABA响应外,还改变了非ABA响应,其调控作用有待深入探索(图8)。此外,相同条件下,转基因株系的种子萌发速度快于AC++的原因可能与ABA的响应受到抑制有关。进一步试验证实,发芽期间ABA的含量显著低于对照(图8),说明SlSIP1L12正调控了ABA的合成,但SlSIP1L12基因参与ABA信号途径的机制,还有待进一步试验验证。
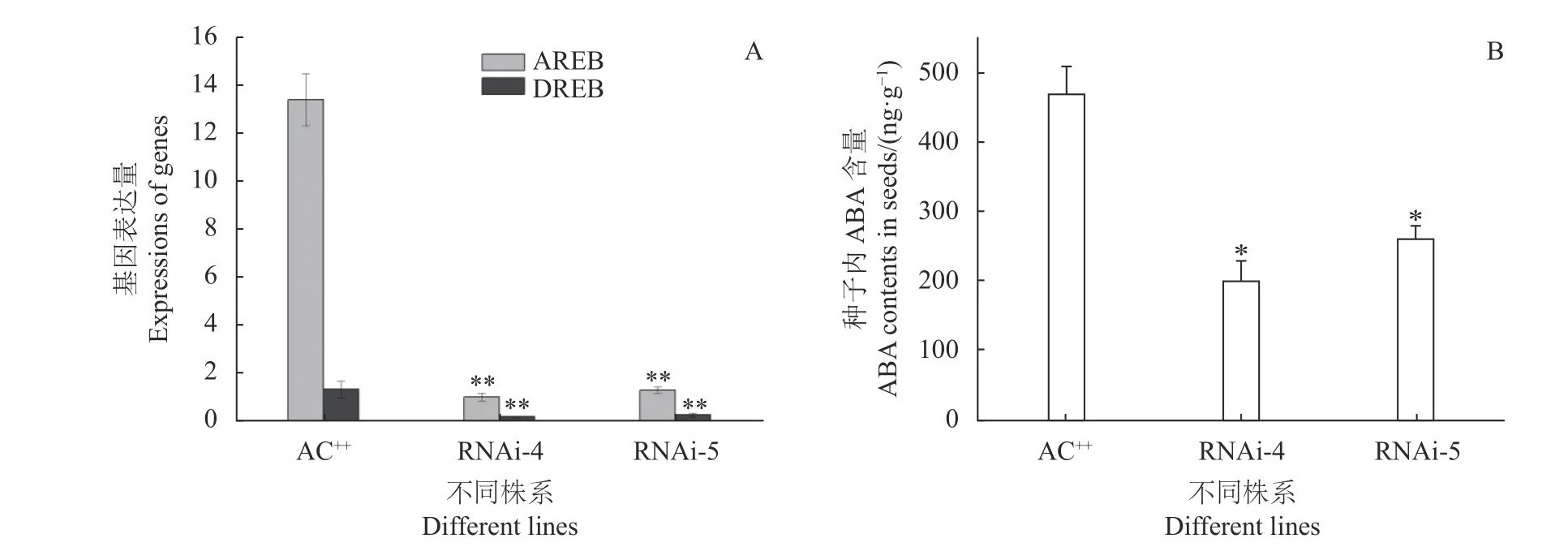
图 8 沉默株系内下游基因与相关激素的检测Fig. 8 Expressions of downstream genes in transgenic and control plants
种子萌发与否与内源激素ABA和GA的平衡密切相关,ABA促进种子营养物质的合成与脱水耐性,而GA促进营养成分的分解[20]。本研究中,SlSIP1L12基因的表达受到ABA和脱水胁迫的双重诱导,而不响应GA3的诱导(图5),因此推测,SlSIP1L12的基因功能与ABA途径关系较密切。然而,GA与ABA存在许多交互作用,且乙烯、油菜素内酯、含氮化合物等激素也经常贯穿其中,并影响二者的作用[20],因此,转基因植株体内ABA响应基因表达或种子体内ABA含量的变化只是初步的验证,ABA与GA激素的互作机制将在后续的研究中深入分析。
本研究克隆到Trihelix转录因子SIP1亚家族基因SlSIP1L12全长为1 125 bp。该基因主要在地上部分表达,可受ABA与脱水胁迫诱导。利用RNAi技术获得的转基因植株 叶片中,ABA响应基因的表达显著受到抑制;转基因植株种子的发芽速度快于对照,且发芽7 d时,转基因种子体内ABA含量明显小于对照。

