一株生防烟管菌几丁质酶表达及抗真菌活性
万云宝, 陈宇红, 蒋学飞, 朱芮佳, 魏 涛, 王茂林
(四川大学生命科学学院 教育部生物资源与生态环境重点实验室, 成都 610065)
1 引 言
植物真菌病害是造成农产品损耗的主要原因之一,在实际生产中造成了不可估量的经济损失. 病原菌侵染植株后,使农作物局部或整株感病,影响作物生长,严重时造成植株死亡,导致农产品产量降低,品质下降. 多数病原菌不仅能在作物生长过程中影响植株状态,还在农产品的运输过程中造成产品腐烂变质,是造成果蔬运输损耗的主要原因[1]. 此外,部分真菌病原菌能够分泌真菌毒素,食用含有真菌毒素的果蔬能够导致畸胎或诱发癌症,威胁人类健康. 如多种链格孢产生的链格孢毒素[2]以及多种曲霉产生的伏马霉素B[3-4].
几丁质,是由N-乙酰基-D-葡萄糖胺(N-acetyl-D-glucosamine, GlcNAc)单体通过β-1,4-糖苷键连接的聚合物,也是病原真菌细胞壁的主要成分. 在丝状真菌中,几丁质和其他葡聚糖含量占细胞壁成分的70%以上[5],在部分酵母中,几丁质含量甚至达到细胞干重的10%~20%[6-7]. 几丁质酶可以通过外切和/或内切水解酶作用将几丁质裂解为GlcNAc或GlcNAc的可溶性寡聚体. 因此,以几丁质作为分子靶标,通过几丁质酶的水解作用来实现植物病害防治是植物病害控制的有效途径. 而生物防治因子分泌细胞壁裂解酶,裂解病原真菌细胞壁,也成为生物防治微生物拮抗植物病原真菌的主要机制之一[1,8].
烟管菌(Bjerkanderaadusta)属于非褶菌目,多孔菌科,烟管菌属. 目前,对于烟管菌(Bjerkanderaadusta)的研究主要集中在环境科学领域[9-10],但仍不乏烟管菌对植物真菌病害治理的研究报道. 1982年,Dománski[11]发现烟管菌能够抑制栎树(Quercusrobur)褐腐病的发生. 2011年,Bak等[12]研究发现了烟管菌对欧美黑杨(Populuseuramericana)干腐病具有防控能力;2015年,汪华等人[13]筛选出一株对水稻纹枯病菌或瓜亡革菌(Thanatephoruscucumeris)、大丽轮枝菌(Verticilliumdahliae)、茄科罗尔氏菌(Ralstoniasolanacearum)等引起的植物病害具有很好防治效果的烟管菌M-1;2017年,Zhang等人[14]研究发现烟管菌能够有效的抑制西瓜蔓枯病菌(Didymellabryoniae),并在2018年首次探究了烟管菌对核盘菌的抑制作用及其对油菜菌核病(Sclerotiniasclerotiorum)的防治效果[15]. 但目前,仍然缺乏烟管菌生物防治机制研究. 本研究结合抗病效果和RT-qPCR分析,首次从烟管菌中筛选并克隆出一个几丁质酶基因,并通过外源表达证明了该酶的抗真菌活性. 推测该基因是烟管菌发挥生防作用过程中的细胞壁裂解酶基因.
2 材料与方法
2.1 材 料
本氏烟(Nicotianabenthamiana).
烟管菌(Bjerkanderaadusta)菌株BK-1从四川省马尔康市土壤中获得,保藏于本实验室,ITS序列号为MW182414(NCBI). 链格孢(Alternariaalternata)菌株CD-1,链格孢苹果专化型(Alternariaalternataf. sp.mali)L-1,细极链格孢(Alternariatenuissima)SCAU-1和灰葡萄孢(Botrytiscinerea)DY-1均为本实验室保藏菌种.尖孢镰刀菌(Fusariumoxysporum)(BNCC NO. 143078),茄链格孢(Alternariasolani)(BNCC NO. 337910)购自北纳生物(BeNa Culture Collection,BNCC).
PCR引物见表1及表2.

表1 细胞壁裂解酶基因荧光定量PCR引物
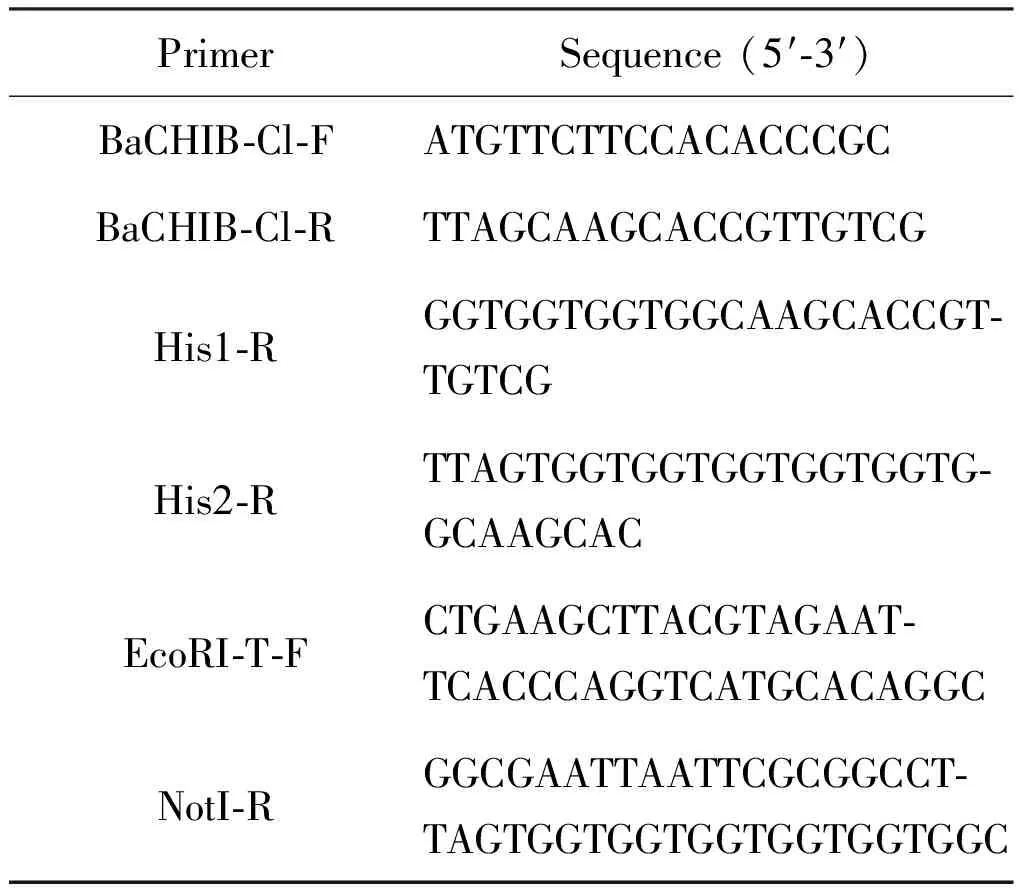
表2 几丁质酶BaCHIB克隆引物
2.2 方 法
2.2.1 烟管菌抗病能力分析 将灰葡萄孢,链格孢和细极链格孢转接到PDA培养基中25 ℃活化培养7 d,使用直径为5 mm的打孔器切取菌丝琼脂块作为接种物;烟管菌活化培养7 d后,将5个直径为5 mm的烟管菌菌丝琼脂块接种至液体的100 mL PDB培养基中25 ℃,180 r/min活化培养7 d后使用粉碎机打碎,制成烟管菌菌丝悬液作为抗菌液(AntiL)备用.
离体实验:从生长30 d的烟草植株上剪取健康的烟草叶片流水冲洗10 min,使用保鲜膜封住叶柄切口处,放置于无菌水浸湿的三层滤纸上,在主叶脉两侧对称位置分别涂抹50 μL无菌水和烟管菌菌丝悬液后接种病原菌菌丝琼脂块作为对照组和实验组,每组6重复. 再将叶片和滤纸放入上层开口的塑料盒中,上层使用保鲜膜封口保持盒内湿润. 将其置于温室内(23 ℃,16 h光照;18 ℃,8 h黑暗),保持48 h(细极链格孢侵染96 h)后对烟草叶片进行拍照记录.
活体实验:选取健康的烟草植株,将从上至下第4片叶片作为接种对象,接种方法同离体实验.将接种后的植株放置在密闭,透光且湿润的育苗盆内,温室培养48 h(细极链格孢侵染96 h)后拍照记录.
上述实验至少重复两次,并使用ImageJ进行叶片感病面积统计.
2.2.2 生物信息学分析 参考该菌株基因组相关信息(NCBI BioProject ID: PRJNA667319),使用SignalP v5.0(http://www.cbs.dtu.dk/services/SignalP/)对其几丁质酶基因和β-1,3-糖苷酶基因进行信号肽预测;并在NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对几丁质酶的保守结构域进行比对.
2.2.3 对峙培养及RT-qPCR分析 将6种病原真菌和烟管菌接种到PDA培养基中,25 ℃避光条件下活化培养5 d,使用打孔器取各菌落边缘处直径为5 mm的菌块. 分别将烟管菌和一种病原菌接种到新的PDA培养基中,各距离平板边缘2 cm,并使两菌块保持在同一直径线上. 25 ℃避光培养.
使用真菌RNA快速抽提试剂盒(生工),提取对峙培养实验中接种后第6 d相互接触区域菌丝的RNA,使用EasyScript©One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)进行反转录获取cDNA.以cDNA为模板,以18S rRNA作为参考基因,使用2× T5 Fast qPCR Mix(SYBRGreenII)试剂盒(擎科)对预测具有信号肽结构的几丁质酶基因和β-1,3-糖苷酶基因进行表达量测定.
2.2.4 烟管菌几丁质酶基因BaCHIB克隆 使用高保真酶1-5TM2× Hight-Fidelity Master Mix(MCLAB)扩增去除信号肽区段的几丁质酶基因BaCHIB-T,并在C端添加6×His蛋白纯化标签. 以烟管菌cDNA为初始模板,后续PCR过程依次使用上一步扩增产物为模板,得到目的片段BaCHIB-T,具体引物如下:①. BaCHIB-Cl-F/R;②. BaCHIB-Cl-F和His1-R;③. BaCHIB-Cl-F和His2-R;④.EcoRⅠ-T-F和NotⅠ-R.
使用限制性内切酶EcoRⅠ和NotI处理载体pPIC9K. 利用同源重组试剂盒(诺唯赞)将BaCHIB-T与线性化的载体同源重组得到重组载体pPIC9K-BaCHIB-T(图1),测序正确的表达载体使用限制性内切酶salⅠ线性化,醋酸锂转化法[16]转化毕赤酵母(Pichiapastoris)GS115菌株.

图1 重组载体pPIC9K-BaCHIB-T结构
2.2.5 重组蛋白的表达和纯化及抗真菌活性 蛋白的表达和纯化按照Deng等[17]的方法进行,并进行改进. 重组载体的表达菌株经0.5%的甲醇诱导5 d,相同处理的空载转化菌株用于对照组. 依次使用含有80,100,120,140 mmol/L咪唑的磷酸盐缓冲液(PBS)洗脱与柱结合的目标蛋白. 目的条带经SDS-PAGE电泳检测. 几丁质酶活性测定使用几丁质酶活性检测试剂盒(索莱宝).
纯化后的重组蛋白,浓度调整为200 μg/mL进行抗真菌活性检测. 从活化5 d的链格孢,茄链格孢和灰葡萄孢的平板边缘切取两块边长约为5~10 mm的正方形菌丝琼脂块,并将其置于2 mL离心管中. 每管加入400 μL纯化蛋白溶液作为实验组,等量蛋白洗脱液作为对照组. 25 ℃暗培养48 h后,观察菌丝生长状况.
3 结果与分析
3.1 烟管菌的抗病能力分析
以烟草为寄主,检验烟管菌对由灰葡萄孢引起的灰霉病,由链格孢引起的赤星病和黑斑病的抑制效果进行抗病表型实验(表3). 结果表明,在离体和活体条件下,烟管菌能够使灰霉病病斑面积分别减少91.97%和100%;使赤星病病斑面积减少77.12%和75.03%. 而在黑斑病的实验组中,离体条件下并未观察到明显的抗病效果;活体接种病原菌时,多次重复未检测到明显发病迹象.

表3 烟管菌对烟草真菌病害的抗病能力
烟草灰霉病、烟草赤星病和烟草黑斑病分别由灰葡萄孢、链格孢和细极链格孢引起.烟草叶片的病斑面积测量后,被用以比较烟管菌对上述三种病害的抗病能力.数据使用单因素方差分析,“*”表示差异显著(P< 0.001).
3.2 生物信息学分析
对该菌株的基因组进行分析,发现烟管菌该菌株具有11个几丁质酶基因,12个β-1,3-糖苷酶基因. 其中5个几丁质酶基因(EVM0010419;EVM0005032;EVM0003995;EVM0003825;EVM0009013)和3个β-1,3-糖苷酶基因(EVM0006890;EVM0003791;EVM00010135)所对应的蛋白序列N端具有信号肽结构. 烟管菌几丁质酶基因的保守结构域分析表明,烟管菌几丁质酶基因均属于GH 18基因家族. 此外,EVM0005032和EVM0003825末端带有Chic_BD(aromatic chitin/cellulose binding site residues)结构,属于B类几丁质酶(CHIB).
3.3 几丁质酶基因和β-1,3-糖苷酶基因的表达谱分析
RT-qPCR分析对峙培养第6 d的烟管菌细胞壁裂解酶基因的表达水平. 结果表明在该阶段,多个基因表达量上调,如几丁质酶基因EVM0005032,EVM0003825和EVM0009013,β-1,3-糖苷酶基因EVM0006890(图2). 尤其是几丁质酶基因EVM60005032(BaCHIB),在与链格孢、茄链格孢、灰葡萄孢和尖孢镰刀菌的对峙培养时,该基因分别上调表达27.3倍、31.7倍、50.3倍和41.3倍(图2B),但在与链格孢苹果专化型和细极链格孢相互作用时,该基因未发生相应的上调表达. 总体上来看,除基因EVM0005032外,其它基因上调的情况主要集中在烟管菌与茄链格孢和尖孢镰刀菌的对峙培养中. 如基因EVM0009013和EVM0006890在应对茄链格孢时表达上调(图2e,2f). 另外,同属B类几丁质酶基因的EVM0003825仅在与尖孢镰刀菌的对峙培养中出现明显的上调表达(图2d).
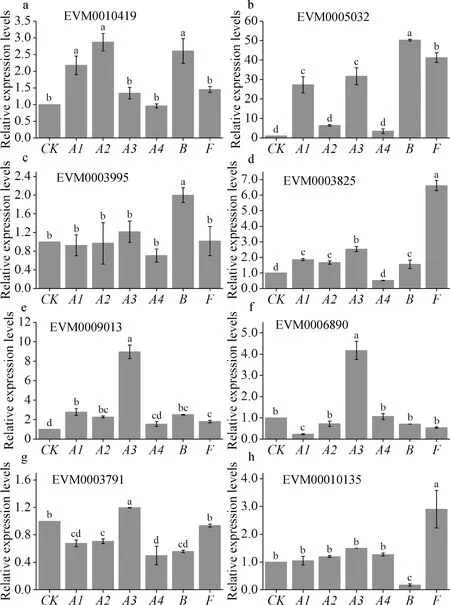
图2 接种6d后烟管菌预测具有信号肽结构的细胞壁裂解酶基因相对表达量分析
3.4 几丁质酶BaCHIB的抗真菌活性
使用镍柱对重组蛋白BaCHIB进行了分离纯化,在咪唑浓度为80 mmol/L时目的蛋白能被高效洗脱,并在后续的SDS-PAGE中显示为单一条带(图3). 大小在50~70 kD之间,与预测分子大小63.6 kD相近. 对纯化后的重组蛋白进行活性测定,在37 ℃下几丁质酶活性约为17.7 U/mg.

图3 重组蛋白BaCHIB的纯化
对几丁质酶BaCHIB进行抗真菌活性测试,经48 h温育,相较于对照组,添加BaCHIB的实验组中,链格孢、茄链格孢和灰葡萄孢均无新生菌丝生长的痕迹,表现出明显的生长抑制作用.
将烟管菌单独培养作为对照组;A1为链格孢;A2为链格孢苹果专化型;A3为茄链格孢;A4为细极链格孢;B灰葡萄孢;F为尖孢镰刀菌.根据多重比较结果,不同字母表示差异显著(P≤ 0.05).
Fig.2 Relative expression levels of cell-wall lyase genes with a signal peptide at 6 days after inoculation (DAI)
CK isBjerkanderaadustaonly;A1 isAlternariaalternata;A2 isAlternariaalternataf. sp.mali;A3 isAlternariasolani;A4 isAlternariatenuissima;BisBotrytiscinerea;FisFusariumoxysporum. Different letters show significant differences based on Duncan’s Multiple Range Test (P≤ 0.05).
4 讨 论
本研究通过离体和活体实验,证明了烟管菌对烟草灰霉病和赤星病具有良好的抗病效果. 但在烟草黑斑病的离体侵染4 d后,烟管菌施用与否对发病面积并无明显影响,说明在离体条件下烟管菌对烟草黑斑病没有抗病效果,而在活体实验中,实验组和对照组均无病斑的发生,该现象可能由于使用的细极链格孢菌株侵染能力较弱,导致侵染后无感病表型出现.
生防微生物通过分泌细胞壁裂解酶抑制病原菌的生长是其发挥生防作用的主要机制之一,如几丁质酶,β-1,3-糖苷酶,脂肪酶和蛋白酶,这些酶体通常在破坏病原体的细胞壁中起着至关重要的作用. 为了初步探究烟管菌细胞壁裂解酶在烟管菌抗病中的作用,本研究通过生物信息学和RT-qPCR的角度出发,对烟管菌部分细胞壁裂解酶进行分析.
GH 18家族广泛存在于原核生物,真核生物乃至病毒中. 按照结构域差异可分为两大类[18]:Class III(B类)和Class V(A类). 其中B类几丁质酶含有几丁质或多糖结合位点,这类几丁质酶主要参与真菌生长发育过程中的营养吸收,并在线虫和部分真菌寄生昆虫的过程中发挥重要作用[18-21]. 此外,该类几丁质酶基因结构与植物几丁质酶基因相似,而后者通常与寄主植物对病原细菌,真菌及线虫的抗性相关[22-24]. 由此可推测,烟管菌几丁质酶基因EVM0005032(BaCHIB)和EVM0003825可能在烟管菌对病原真菌的生物防治中发挥重要的生物学作用.

图4 重组几丁质酶BaCHIB的抗真菌活性
使用RT-qPCR对预测具有信号肽结构的几丁质酶基因和β-1,3-糖苷酶基因的表达谱进行分析测定,借此筛选出可能具有抗真菌活性的细胞壁裂解酶基因. 在对峙培养过程中,多个基因在接种6 d后表达量上调,特别是,几丁质酶基因EVM0005032. 结果表明部分植物真菌性病原,如链格孢,茄链格孢,尖孢镰刀菌和灰葡萄孢,能够直接诱导烟管菌细胞壁裂解酶基因的表达. 这一结果与Banani等[25]的研究相似,桃梅奇酵母(Metschnikowiafructicola)菌株AP47在桃褐腐病菌(Moniliniafructicola)细胞壁提取物诱导下,其几丁质酶基因MfChi上调表达14倍,并在后续的实验中表现出对桃子褐腐病的显著抑制能力. 此外,Essghaier等[26]在研究一种嗜盐菌对草莓灰霉病的防治过程中,发现枯草芽孢杆菌能够分泌多种具有抗真菌活性的酶类:几丁质酶,β-1,3-糖苷酶,纤维素酶和蛋白酶;Urbina等[27]在其研究中也发现橄榄假丝酵母分泌的一种β-1,3-糖苷酶对苹果病原菌扩展青霉具有拮抗能力. 上述研究为烟管菌几丁质酶BaCHIB具有抗真菌活性的假设提供了相应的依据. 另一方面,同属于B类几丁质酶的基因EVM0003825,仅在烟管菌与尖孢镰刀菌的对峙培养中出现上调表达,而未出现类似于BaCHIB在应对多种病原真菌时的高表达现象,这一结果说明,几丁质酶基因BaCHIB可能在应对病原真菌具有一定的特异性.
结合抗病效果与几丁质酶基因BaCHIB的诱导表达分析,表明烟管菌对植物真菌病害抗病表现与BaCHIB的诱导表达情况的出现高度同步. 如烟管菌对烟草灰霉病和赤星病具有抗病能力,几丁质酶基因BaCHIB在与灰葡萄孢和链格孢的对峙培养中出现诱导表达;对烟草黑斑病没有显著的抗病效果,BaCHIB不出现显著的诱导表达. 这一结果为几丁质酶基因BaCHIB在烟管菌的生物防治中发挥重要作用提供了又一关键证据.
通过真核外源表达系统,烟管菌几丁质酶BaCHIB能够被成功表达和纯化. 并表现出几丁质酶活性和良好的抗真菌活性. 这一结果验证了几丁质酶BaCHIB具有抗真菌能力. 在Ahmed等[28]的研究中,绿色木霉几丁质酶在浓度为2.23 mg/mL时,对尖孢镰刀菌培养5 d后的抑菌能力为45%;而另一种来自珊瑚球菌的几丁质酶,在浓度为0.15 mg/mL和0.75 mg/mL时,对稻瘟病菌分生孢子萌发抑制率分别在40%和10%左右[29];而来源于哈茨木霉的几丁质酶Chit46,在浓度为3.9 μg/mL时,对灰葡萄孢培养5 d后的生长抑制能力为76%,表现出较上述两种几丁质酶更为高效的抑菌能力[17].在本研究中,三种病原真菌在0.2 mg/mL的几丁质酶溶液中培养2 d后,新生菌丝生长被强烈抑制,证明烟管菌几丁质酶BaCHIB同样具有较好的抗真菌能力.
本实验结果表明,具有生防能力的烟管菌BK-1可能是通过分泌几丁质酶BaCHIB实现其对一些植物真菌病害的抑制,但具体的生物防治机制,仍然需要在此基础上进行更加深入的研究.

