太子参根际土壤微生物多样性及其与土壤主要理化因子的相关性
高慧芳,许佳音,孟 婷,陈金绍,邱君志,张重义,张燎原
(1. 福建农林大学生命科学学院,福建 福州 350002;2. 厦门大学附属第一医院药剂科,福建 厦门 361022;3. 厦门中药厂有限公司,福建 厦门 361002;4. 福建农林大学农学院,福建 福州 350002)
0 引言
【研究意义】太子参(Pseudostellaria heterophylla)别名孩儿参、童参,为石竹科多年生草本植物,以根部入药,具有抗疲劳、抗衰老、调脾虚体倦等功效[1]。太子参以福建省柘荣县栽培历史最为悠久,其品质优良,年产量约占全国总产量的60%,素有“中国太子参之乡”的美誉,并于1987年列为太子参的最佳生长适宜区、中国太子参生产基地[2]。近年来,太子参医药价值开发日益深入,其原药材的需求量迅速增加,价格不断攀升,给太子参产业化发展带来重要机遇。但由于太子参在栽培过程中存在的连作障碍问题,严重影响其产量和品质[3−4]。太子参连作障碍主要表现为块根重下降、分根数减少特别是地下部位不能正常膨大,从而不能形成具有商品价值的块根。【前人研究进展】前期研究发现,土壤肥力、植物根系分泌物和根际微生物种群的失衡,是导致太子参连作障碍的主要原因[5]。而根系分泌物介导的根际微生物种群失衡,尤其是病原微生物的增多,成为太子参连作效应发生的重要原因[6−8]。微生物与土壤生态功能是相辅相成、息息相关的,并且跟植物之间有着紧密关联。微生物群落的组成及其多样性是衡量土壤性质和功能的一个重要指标。有研究发现[9],太子参连作及菌肥处理会显著影响太子参根际土壤微生物的群落结构与功能多样性,推测微生态结构失衡是导致太子参连作效应形成的根本原因。而不同产地的太子参根际土壤微生物的含量及群落结构存在较大差异性[10]。【本研究切入点】柘荣县由于特殊的地理位置,不同太子参种植地土壤性质、气候环境、海拔等因素有所差别,但栽培过程中都存在不同程度的连作问题。不同的栽培过程是否导致菌群结构的变化,存在哪些共性和差异性,这些共性是否是引起连作问题、病害增多的原因。【拟解决的关键问题】本研究基于高通量测序技术,研究柘荣县5个不同样地太子参根际土壤微生物群落结构及多样性,并分析土壤pH值和主要化学性质及太子参根系分泌物酚酸类物质对其的影响,以期揭示太子参栽培过程中病害形成存在的共性及差异性问题,为科学种植太子参并提高其产量及品质提供理论依据。
1 材料与方法
1.1 研究区概况
福建省宁德市柘荣县,地理位置为N27°05′~N27°19′,E119°43′~E120°04′,属于亚热带季风气候,温和湿润,年平均气温15.5 ℃,雨量充沛,年平均降水量为1 600~2 400 mm,平均相对湿度约为85.00%,雨日多雨区广,11~2月少雨,3~6月多雨[2],为 太子参提供良好的种植条件。
1.2 试验样品采集
于2018年6月25日进行柘荣县太子参根际土壤的采集:选择植株健壮的太子参,除去表层土壤,找到植物根系,轻轻抖落根系上的土壤于无菌采集袋中,做好采样记录。将每个样地的太子参根际土壤取5组混为1个样品,每处样地设3次重复,分别进行理化性质的测定、根系分泌物的检测和土壤宏基因组DNA的提取。5个样地序号为:Ⅰ(英山乡油麻厝村);Ⅱ(东源乡鸳鸯头村);Ⅲ(东源乡绸岭村);Ⅳ(东源乡东源村);Ⅴ(乍洋乡束刘厝村)。5个样地的地形为中山丘陵,成土母质为坡积母 质,质地是中壤类型[11],详细信息如表1所示。
1.3 高通量测序及分类注释
以提取的宏基因组DNA为模板,分别扩增真菌ITS1区和细菌16S rDNA V3~V4区,基于Miseq平台进行高通量测序,测序工作由杭州联川生物技术股份有限公司完成。根据测序下机数据,进行质量控制,采用PEAR(Paired-End reAd mergeR,version 0.9.6)和Vsearch(version 2.3.4)软件过滤原始的测序数据,得到有效序列(Valid_Data),并将有效序列在大于97.00%相似性条件下进行聚类OTU(Operational Taxonomic Units,操作分类单元),通过RDP数据库进行物种注释,并得到每个物种在该样品中的丰度。利用QIIME软件计算样品中的Alpha多样性值和Beta多样性值,并进行聚类分析。计算差异种群两两间的Spearman秩相关系数,借助Gephi(Version 0.9.2)软件构建差异种群共变化网络,进一步探究差 异种群间的相互关系。
1.4 土壤pH值及主要化学性质的测定
测定采集土样的理化性质,土壤pH值采用电位计法(水土质量比2.5∶1);土壤有机质(Organic Matter,OM)采用外加热重铬酸钾氧化-容量法;土壤全氮(total nitrogen, TN)采用碳氮元素分析仪(VARIO MAX, 德国ELEMENTAR)测定[12];土壤铵态氮(ammonium nitrogen, NH4+)采用靛酚蓝比色法;土壤全磷(total phosphorus, TP)采用氢氧化钠熔融-钼锑抗比色法;土壤有效磷(available phosphorus, AP)采用碳酸氢钠浸提-钼锑抗比色法;土壤全钾(total potassium, TK)采用碱熔-火焰光度法;土壤速效钾(available potassium, AK)采用乙酸铵浸提-火焰光度法[13]。

表 1 太子参根际土壤样品信息Table 1 Information on soils sampled from rhizosphere of P. heterophylla habitats
土壤中有效态铜、有效态锌和有效态铁用0.10%HCl浸提,土壤中有效态锰采用醋酸铵浸提法,并使用电感耦合等离子质谱(ICP-MS,NexION 300X,PerkinElmer)测定[14]。条件参数:功率为1 300 W,等离子气流量为13.00 L·min−1,辅助气流速为1.40 L·min−1,氦气流量为5.20 L·min−1,氢气流速为5.80 L ·min−1,采用深度为7.80 mm,重复采样3次。
1.5 土壤酚酸类物质的检测
土样的前期处理参考吴丹等[15]的相关方法,样品旋蒸后用甲醇定容至5 mL后用高效液相色谱进行检测。9种常见酚酸为对羟基苯甲酸、香草酸、丁香酸、香兰素、香豆酸、阿魏酸、苯甲酸、水杨酸及肉桂酸,溶解于甲醇作为标品进行HPLC检测。前期实验优化后的色谱条件:色谱柱(SunFire C18 5 μm,4.6 mm×250 mm Column),流动相A为0.1%磷酸,流动相B为甲醇,0~6 min(A:73.00%;B:27.00%),6~22 min(A:50.00%;B:50.00%)检测波长280 nm,进样量10 μL,柱温30℃。仪器为Waters e2695-Model C ode 998。
1.6 数据处理
采用Excel 2016和SPSS 17.0软件对数据进行单因素(one-way ANOVA)方差分析和Duncan法多重比较分析(a=0.05)。采用Adobe Photoshop CS6软件作 图。采用Canoco 5软件进行典范对应(CCA)分析。
2 结果与分析
2.1 太子参根际土壤测序的有效数据
5个样地的太子参根际土壤经测序后共得到744 331条真菌基因优化序列,按照97.00%序列相似性基础,可划分为1 314个真菌分类单元(OTU):14门(Phylum),44纲(Class),87目(Order),157科(Family),275属(Genus),396种(Species);共得到1 032 029条细菌基因优化序列,按照97.00%序列相似性划分10 310个细菌分类单元(OTU):38门(Phylum),101 纲(Class),160 目(Order),263科(Family),484属(Genus),554种(Species)。如图1-A和1-B所示,真菌和细菌的OTU丰度存在不同程度的差异。1-A所示,5组之间只有Ⅰ组和Ⅱ组真菌OTU丰度呈显著差异性;1-B所示,Ⅳ组的细菌OTU丰度最高;Ⅲ组的细菌OTU丰度最低,与Ⅰ、Ⅱ组的细菌OTU丰度有显著差异性;而Ⅲ组和Ⅳ组的细菌OTU丰度呈极显著差异。不同样地的真菌OTU丰度与细菌OTU相比,5组之间的细菌OTU丰度呈现更明显的差异性。说明不同栽培地对太子参根际土壤细菌的影响大于对其真菌的影响,且太子参根际土壤微生物以细菌为主。
通过对韦恩图中各样品特有的或共有的真菌OTU数进行分析,如图1-C所示,5个样地的样品中真菌共有OTU数达到264个。其中,Ⅰ、Ⅱ、Ⅳ、Ⅴ4组的共有真菌OTU为99,说明这4组的真菌群落结构相似性高;Ⅰ、Ⅱ 和Ⅳ三者共有的真菌OTU为40,说明这3组的真菌群落结构相似性较高;Ⅲ和Ⅳ这两者的共有真菌OTU为64,说明这2组的真菌群落结构相似性较高;Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ特有真菌OTU分别为31、22、121、45、72,分别占其OTU总数的4.03%、3.12%、16.31%、5.45%、9.36%。而5个样地共有真菌OTU数均高于其他的随机组合共有真菌OTU,表明不同样地的微生物物种相近。
从图1-D可以看出,5个样地土壤细菌共有OTU数为2 044;Ⅰ、Ⅱ、Ⅳ和Ⅴ四组的共有细菌OTU为2 109,说明这4组的细菌群落结构相似性高;Ⅰ、Ⅱ和Ⅳ三者共有的细菌OTU为873,说明这3组的细菌群落结构相似性较高;Ⅰ和Ⅳ这两者的共有细菌OTU为250,说明这2组的细菌群落结构相似性较高;Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ特有细菌OTU分别为140、49、396、311、161,分别占各太子参细菌OTU总数的1.87%、0.66%、8.68%、3.81%、2.37%。
从图1综合分析,单个样地的OTU数均不同,其中单个样地的OTU数Ⅲ为最多(真菌121个,细菌396个),Ⅱ最少(真菌22个,细菌49个),说明不同样地太子参根际土壤中各自特有的微生物不同,存在差异性;而5个样地的共有OTU数明显多于特有的数量,说明5个样地的根际土壤微生物组成 趋势相似。

图 1 真菌和细菌的OTU丰度及韦恩图(AB:箱线图;CD:韦恩图)Fig. 1 OTU richness and Venn diagrams on fungi and bacteria in rhizosphere soil (AB: Box-plot; CD: Venn diagrams)
2.2 5个样地太子参根际土壤微生物群落丰度与多样性
比较5个样地太子参根际土壤微生物群落的α多样性,其中Observed-species指数、Chao1指数越高,说明物种多样性越好,物种越丰富;Simpson指数和Shannon指数越高,说明物种丰富度和均匀度越好。如表2所示,结果发现,太子参根际土壤细菌群落的Observed-species指数和Chao1指数呈明显的差异性。其中Ⅳ、Ⅱ土壤中细菌有着较高的Observed_species指数、Chao1指数和Shannon指数,说明样地Ⅳ、Ⅱ土壤的细菌群落丰富度和多样性高于其他3个样地;Ⅲ土壤的多样性指数均呈现较低值,说明此样地土壤菌群丰富度和多样性较低。总之太子参根际土壤中细菌群落多样性呈现趋势为:Ⅳ>Ⅱ>Ⅰ>Ⅴ>Ⅲ,5个样地太子参根际土壤的细菌群落丰富度及均匀性存在显著差异,而真菌群落差异不明显。
主坐标分析图上点与点之间的距离越近,说明样品之间的微生物群落差异越小。由图2可以看出,真菌第一轴的解释量为27.25%,第二轴的解释量为13.95%,第一、二两轴的累积贡献率达到41.20%;细菌第一轴的解释量为38.67%,第二轴的解释量为12.80%,第一、二两轴的累积贡献率达51.47%,可以较为全面反映样本信息。图2-A中,其中Ⅳ、Ⅰ、Ⅱ之间的点距离较近,说明3个样地的微生物群落构成相似。而Ⅲ、Ⅴ的3个点与其他样地的点之间距离较远,说明Ⅲ、Ⅴ与其他样地的微生物群落构成差异较大。从图中可以看出,无论是真菌或者细菌群落,Ⅳ、Ⅰ、Ⅱ这3个样地之间距离较近,说明每组内的群落构成相似性较高;而Ⅲ与其他样地距离较远,说明该样地的微生物群落与其他样地的微生物群落构成相似性较低。
基于Unifrac距离矩阵进行UPGMA聚类分析,如图3所示,将5组样品划分为2个类群。第一类群包括Ⅰ、Ⅱ、Ⅳ、Ⅴ四组样品,说明这4个样地太子参根际土壤微生物群落相似性较高;第二类为Ⅲ样地样品,与第一类样品整体距离较远,说明Ⅲ样地样品与其他4组样地太子参根际土壤微生物群 落差异较大。
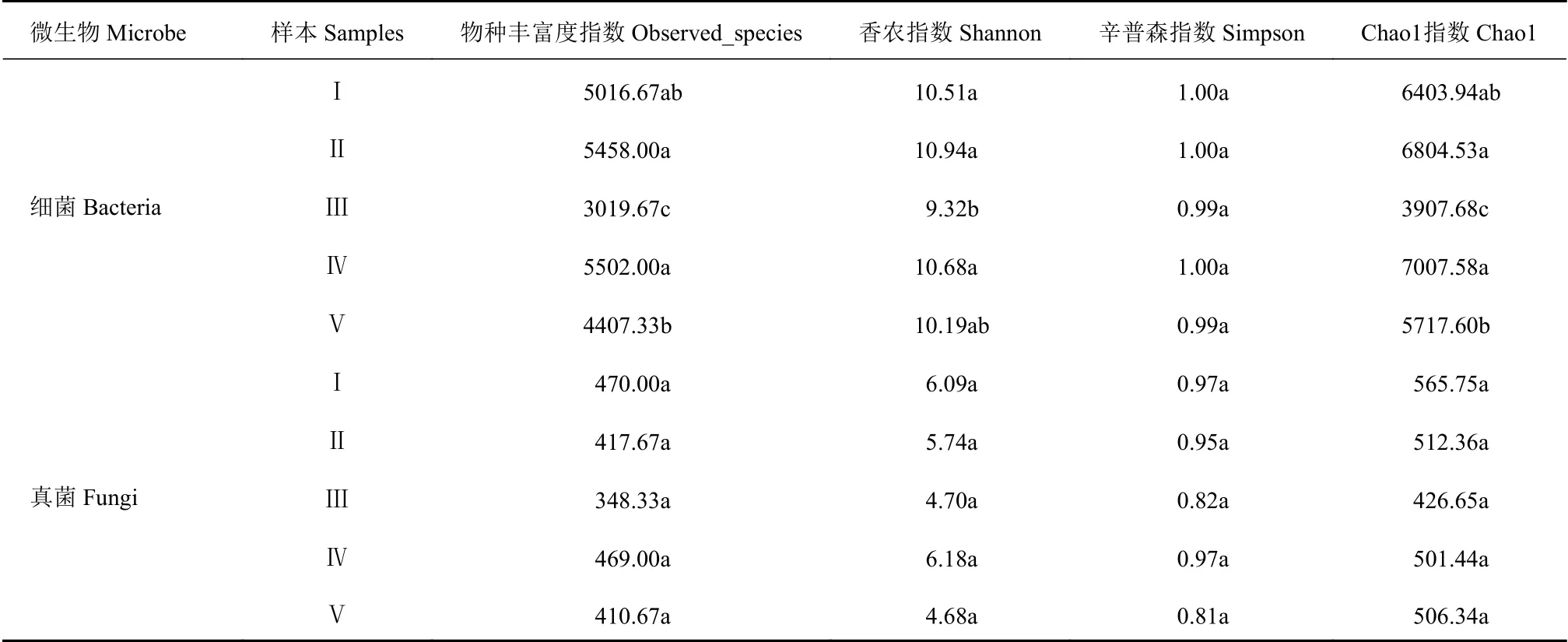
表 2 样品α多样性指数Table 2 α diversity indices on 5 rhizosphere soil samples at P. heterophylla habitats
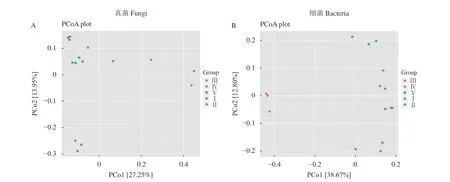
图 2 主坐标分析太子参根际土壤真菌和细菌群落差异Fig. 2 Principal coordinates analysis on fungi and bacteria communities in rhizosphere soil of P. heterophylla habitats
2.3 微生物群落结构分析
为了反映太子参根际土壤微生物群落组成的相似性和差异性,对OTU进行物种分类后首先在“门”分类等级对5个样地的菌群结构进行分析。如图4-A所示,聚类后OTU对应的真菌类群涉及子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、被孢菌门(Mortierellomycota)、毛霉门(Mucoromycota)、类原生动物门(Rozellomybota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、芽枝菌门(Blastocladiomycota)、油壶菌门(Olpidiomycota)、Aphelidiomycota、捕 虫 菌 门(Zoopagomycota),一个门未被鉴定unidentified,一个门未被分类fungi_unclassitied。其中子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)在5个样地的含量都很高;子囊菌门(Ascomycota)在Ⅴ根际土壤中的含量为最高,在Ⅲ根际土壤中含量较低;担子菌门(Basidiomycota)在Ⅲ根际土壤中的含量为最高,在Ⅴ根际土壤中含量较低;接合菌门(Zygomycota)在 Ⅰ 根际土壤中含量为最高,在Ⅴ根际土壤中的含量较低,说明不同样地的微生物群落丰度存在差异。

图 3 UPGMA 聚类分析Fig. 3 Cluster analysis of UPGMA

图 4 太子参根际土壤优势微生物群落组成Fig. 4 Compositions of dominant microbial communities in rhizosphere soil of P. heterophylla habitats
如图4-B所示,在细菌“门”的分类水平上,5个样地太子参根际土壤在细菌菌落的组成上并无较大差别,且在细菌菌群结构和相对丰度上差异也较小。在5个样地的太子参根际土壤中有6个“门”的细菌菌群分布最多:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、后壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)。其中变形菌门(Proteobacteria)在5个样地的丰度最高,并在Ⅲ的太子参根际土壤中含量占据首位。酸杆菌门(Acidobacteria)在5个样地的丰度有所差异,其中在Ⅳ和Ⅱ的太子参根际土壤中含量相似且丰度较高,在Ⅲ土壤中的含量为最少。而放线菌门(Actinobacteria)在Ⅲ土壤中含量最高,在Ⅳ和Ⅱ的土壤中含量相对较低。绿弯菌门(Chloroflexi)和后壁菌门(Firmicutes)在5个样地的土壤中含量基本持平。总的来说,在“门”分类水平上,5个样地的优势菌群保持一致,说明在“门”水平,太子参根际土壤微生物群落组成具有相似性。
丰度热图是对丰度最高的前20种物种分类信息进行相似性聚类,比较在不同样地之间“属”的含量差异,从图4-C中可以看出,正青霉属(Eupenicillium)、隐球菌属(Cryptococcus)、柄孢壳属(Podospora)、被孢霉菌属(Mortierella)、田头菇属(Agrocybe)在样地Ⅰ中丰度较高,腐质霉属(Humicola)、Ascomycota_unclassified、肉座菌属(Hypocrea)在样地Ⅴ中丰度较高,粉褶蕈属(Entoloma)在样地Ⅱ丰度较高,双担菌属(Geminibasidium)、瘦脐菇属(Rickenella)在样地Ⅲ中丰度较高,赤霉属(Gibberella)、毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)、捷别尔达孢属(Teberdinia)在Ⅳ中丰度较高。由此可见,同一菌属在不同样地的丰度存在差异性。如图4-D所示,同一细菌物种在不同样地间的丰度亦存在差异,如Gp2、Gp3在样地Ⅳ中丰度较高,芽单孢菌属(Gemmatimonas)在样地Ⅱ中丰度较高,但是它们在其他样地中丰度均较低;对各样品进行聚类发现,Ⅱ和Ⅳ为一类,此结果与细菌群落组成及分布图一致。
表3展示的是不同样地间太子参根际土壤真菌群落中前20种优势分类单元及其相对丰度。可以看出,Ⅰ样地的优势“属”是被孢霉属(Mortierella)、腐质霉属(Humicola)、柄孢壳属(Podospora)等;Ⅱ样地的优势“属”是被孢霉属(Mortierella)、粉褶蕈属(Entoloma)、腐质霉属(Humicola)等;Ⅲ样地的优势“属”是瘦脐菇属(Rickenella)、双担菌属(Geminibasidium)、被孢霉属(Mortierella)等;Ⅳ样地的优势“属”是被孢霉属(Mortierella)、赤霉属(Gibberella)、捷别尔达孢属(Teberdinia)等;Ⅴ样地的优势“属”是腐质霉属(Humicola)、被孢霉属(Mortierella)等。总体来看,不同样地的优势“属”不同,同种“属”在不同样地间的丰度不同,但差异不明显,说明不同样地的太子参根际土壤的微生物真菌群落趋于一致。
如表4所示,在细菌“属”水平,可能是测序原因(由于微生物种类繁多,加之受到测序读长的显示,所以在实际分析过程中,并非所有的OTU代表序列都能获得“属”水平的分类学信息),在前20个优势属中,只鉴定得到7种,它们为酸杆菌(Gp1、Gp2、Gp3),罗河杆菌属(Rhodanobacter)、芽单胞菌属(Gemmatimonas)、纤线杆菌属(Ktedonobacter)、勒氏菌属(Gaiella);将每个菌属在不同样地进行比较可以看出,芽单胞菌属(Gemmatimonas)在Ⅱ的含量多于其他样地;罗河杆菌属(Rhodanobacter)在Ⅲ的含量明显多于其他样地;酸杆菌(Gp1)在5个样地的含量均较高,而酸杆菌(Gp2、Gp3)在Ⅳ的含量高于其他4个样地;纤线杆菌属(Ktedonobacter)在Ⅴ、Ⅰ的含量较高,在Ⅲ的含量较低。同种“属”在不同样地间的丰度不同,结果表明,5个样地的微生物菌属丰度存在差异性,说明不同样地太子参根际 土壤微生物群落结构不同。
2.4 5个样地太子参土壤化学性质和酚酸含量分析
从表5看出,不同样地太子参根际土壤化学性质均存在差异性。太子参根际土壤偏酸性,pH值为4.8~5.3。在Ⅱ和Ⅴ2个样地,土壤有机质、全氮、全钾含量均较高;在样地Ⅲ中全磷、速效钾含量最高,而有机质、全钾指标与其他4个样地相比含量较低。从表6得出,有效态微量元素在样地Ⅲ中的含量均较低。其中:有效态锰在Ⅳ中含量最高,为23.14 mg·kg−1;有效态铜、有效态铁在Ⅰ中含量最高,分别为4.18 mg·kg−1和151.94 mg·kg−1;有效态锌在Ⅱ中含量最高,为13.19 mg·kg−1;其中有效态锰和有效态铜含量不同样地差异显著。表明不同样地太子参根际土壤化学性质存在差异性,说明不同样地太子参的种植会对太子参根际土壤的化学性质产生影响。
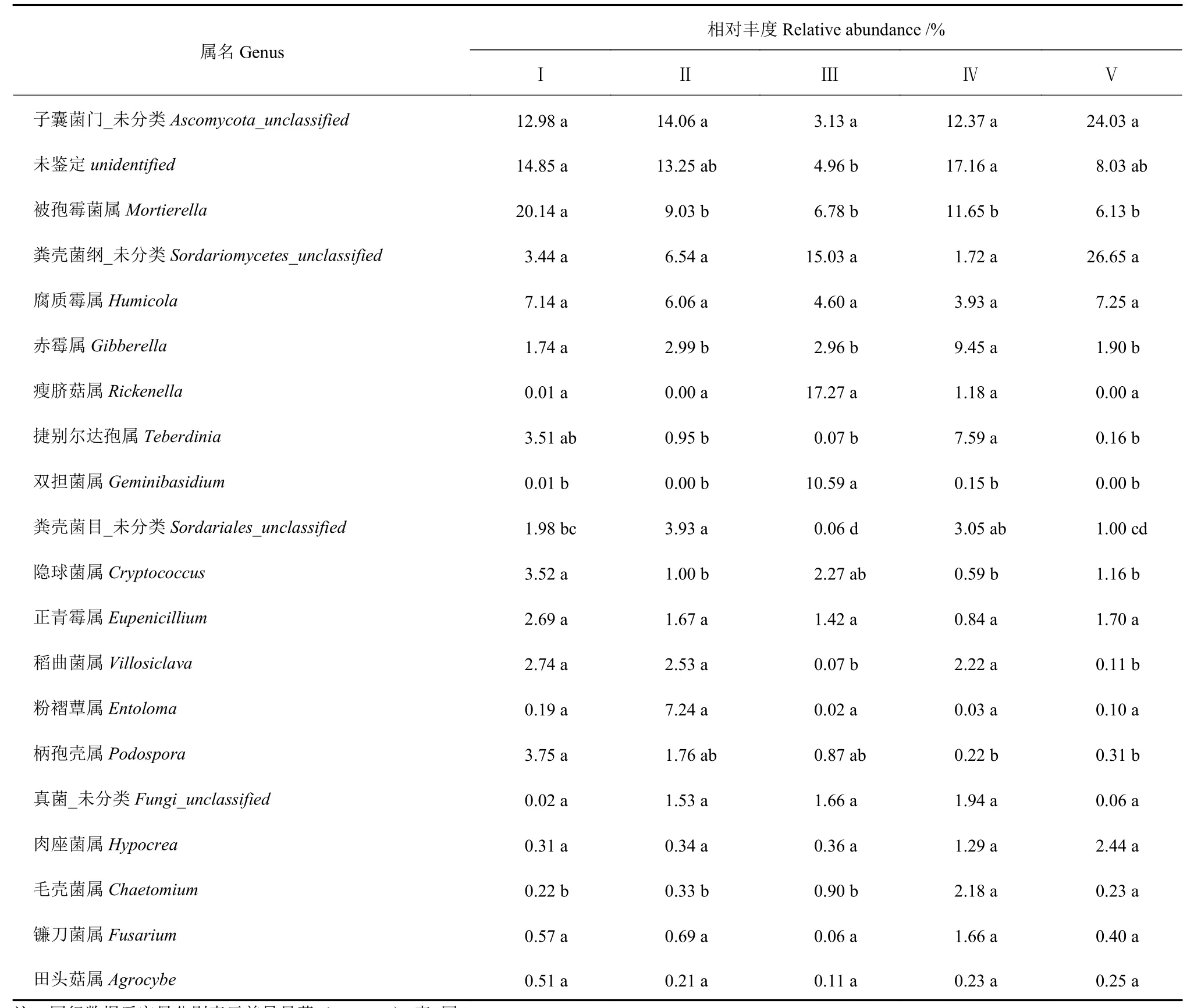
表 3 不同样地太子参根际土壤真菌群落中前20种优势分类单元及其相对丰度Table 3 Top 20 dominant taxa and their relative abundance of fungi community in rhizosphere soil of P. heterophylla habitats
如表7、8所示,5个样地太子参根系分泌物中均含有对羟基苯甲酸、香草酸、丁香酸、香兰素、香豆酸、阿魏酸、苯甲酸、水杨酸和肉桂酸。其中,5个样地中对香豆酸、安息香酸、丁香酸的总含量高于其他6种,肉桂酸的含量最低;丁香酸、对羟基苯甲酸、对香豆酸、香兰素在5个样地中含量差异明显。总之,同一酚酸在不同样地含量不同,同一样地的不同酚酸含量也存在差异性。说明不同样地太子参根系分泌物中酚酸种类相同,但含量会有 所差异。
2.5 网络关系图
网络关系图被广泛应用于复杂微生物群落的探究中。以上研究表明:不同样地太子参根际土壤的微生物菌属分布及丰度差异显著。为进一步探究太子参根际微生态环境中微生物间的相互作用,本研究通过对差异菌属两两间相关系数的计算,构建共变化网络(图5),在真菌菌属共变化网络中,核心菌属是捷别尔达孢属(Teberdinia)、稻曲菌属(Villosiclava);在细菌的共变化网络系统中,核心菌属是酸杆菌(Gp1、Gp3)和罗思河小杆菌属( Rhodanobacter)。
2.6 不同样地太子参根际土壤微生物群落分布、土壤化学性质及酚酸典范对应分析
选取真菌的前3优势“门”-子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和细菌的前4优势“门”-变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi),探讨太子参根际土壤微生物丰度、根际土壤化学性质及酚酸类物质的典范对应分析。如图6-A、6-B所示,子囊菌门(Ascomycota)丰度与根际土壤大部分化学性质、酚酸物质呈正相关关系,与全磷、有效磷、对羟基苯甲酸、香草酸呈负相关关系;而担子菌门(Basidiomycota)丰度与大部分根际土壤化学性质、酚酸物质呈负相关关系,与全磷、有效磷、对羟基苯甲酸、香草酸呈正相关关系;接合菌门(Zygomycota)丰度与有效态铜、铵态氮、对羟基苯甲酸、丁香酸、安息香酸呈正相关关系。图6-C和6-D所示,放线菌门(Actinobacteria)丰度与速效钾、全磷呈正相关关系,与酚酸物质呈负相关关系;绿弯菌门(Chloroflexi)丰度与有效态铁、对羟基苯甲酸呈正相关关系;变形菌门(Proteobacteria)丰度与铵态氮、有效磷、水杨酸呈正相关关系;酸杆菌门(Acidobacteria)丰度与根际土壤大部分化学性质和酚酸物质呈正相关关系,与全磷、有效磷、速效钾、水杨酸呈负相关关系。典范对应分析表明太子根际土壤微生物群落分布受土壤理化性质及酚酸类物质的影响,说明太子参土壤化学性质及酚酸类物质参与了根际微生物群落结构及多样性的演变。
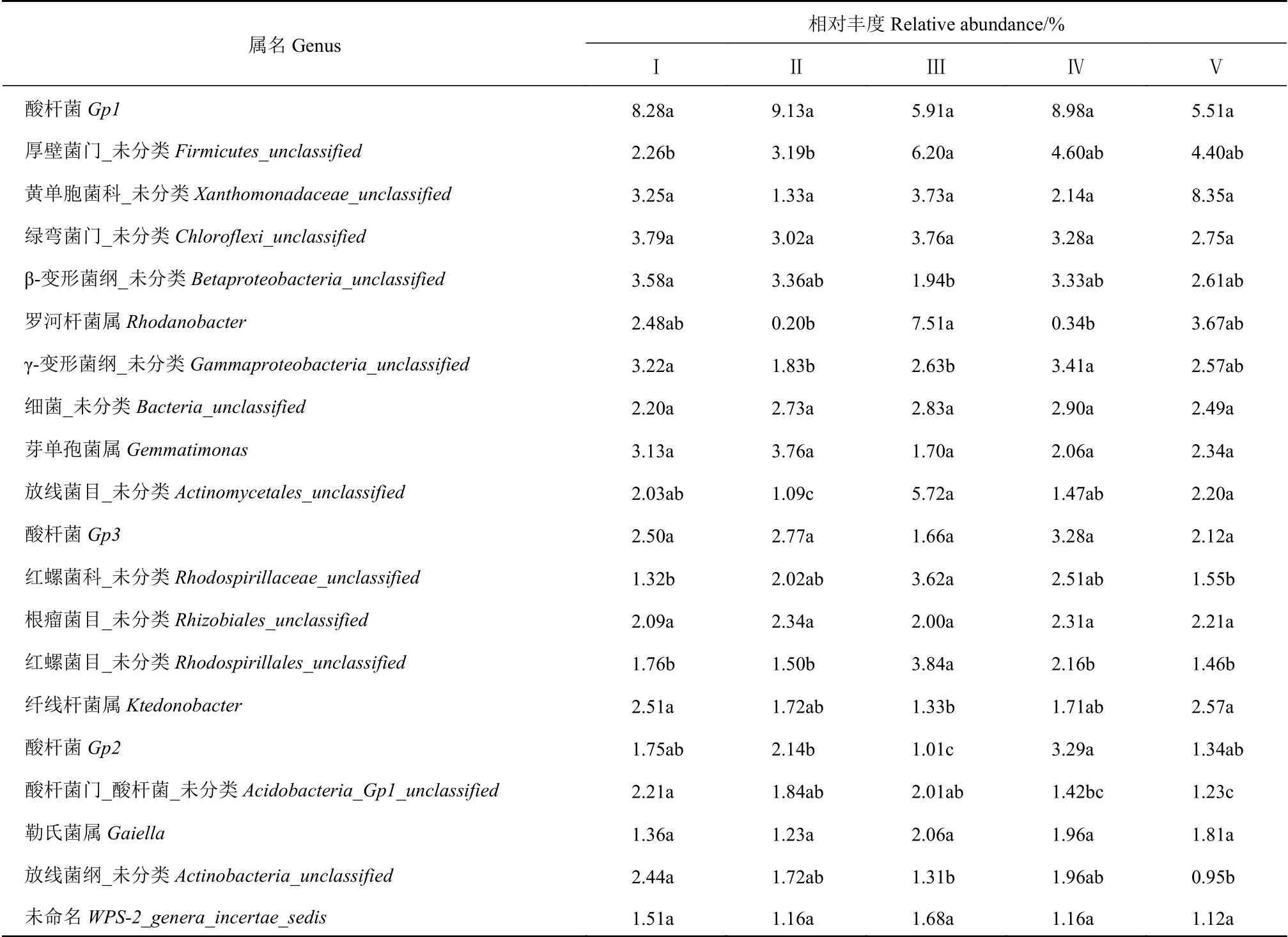
表 4 不同样地太子参根际土壤细菌群落中前20种优势分类单元及其相对丰度Table 4 Top 20 dominant taxa and their relative abundance of bacteria community in rhizosphere soil of P. heterophylla habitats
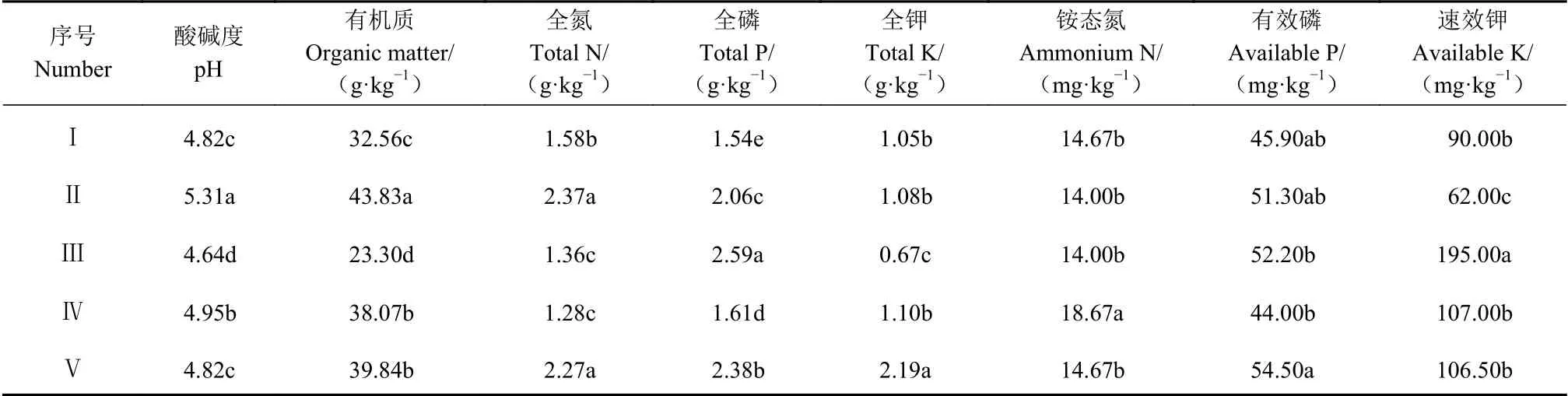
表 5 不同样地太子参根际土壤化学性质Table 5 Chemical properties of rhizosphere soil from P. heterophylla habitats
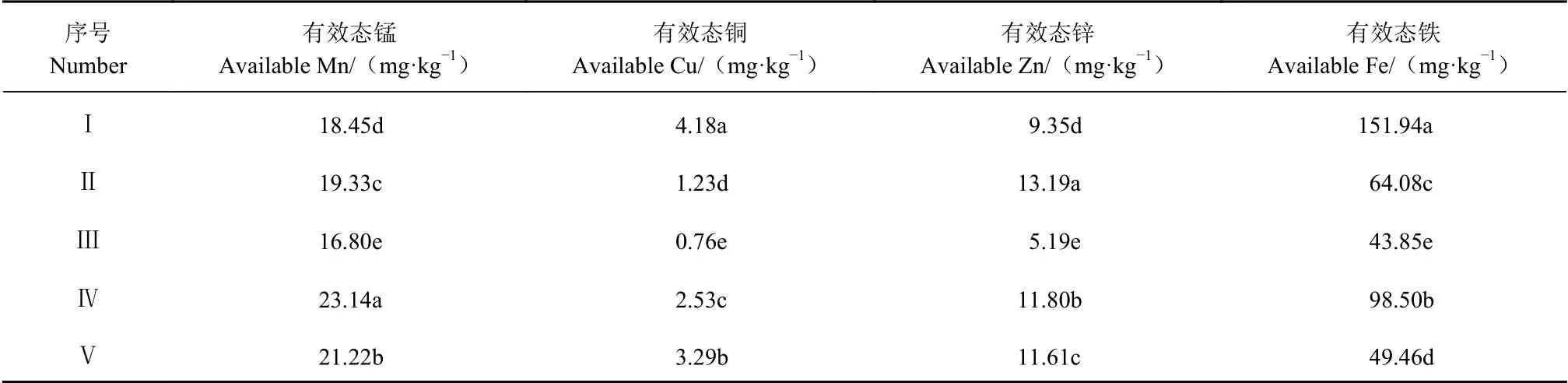
表 6 不同样地太子参根际土壤中有效态微量元素的含量Table 6 Content of available trace elements in rhizosphere soil of P. heterophylla habitats

表 7 不同样地太子参根系分泌物酚酸的含量Table 7 Content of phenolic acids in root exudates of P. heterophylla at different locations
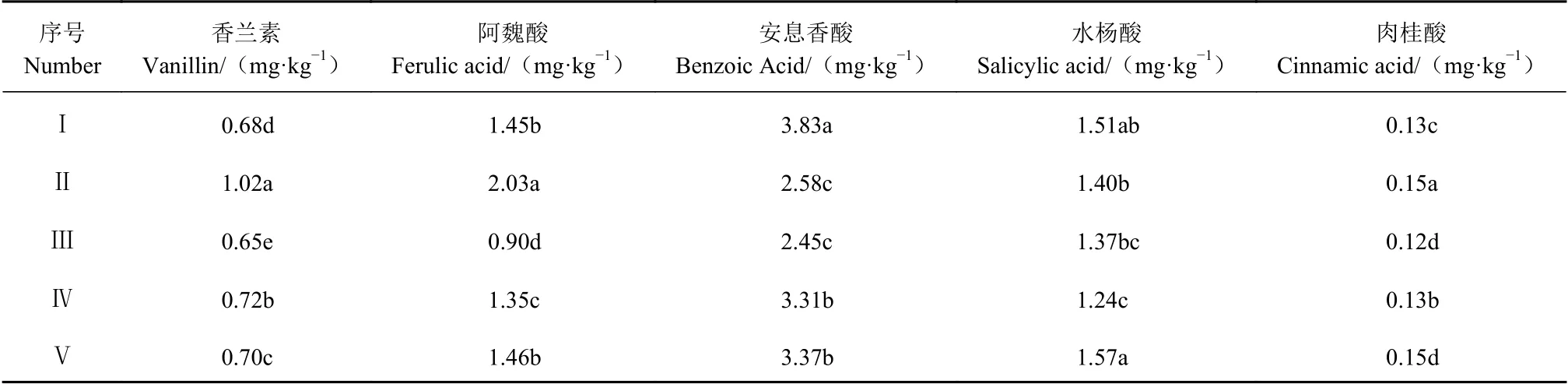
表 8 不同样地太子参根系分泌物酚酸的含量Table 8 Content of phenolic acids in root exudates of P. heterophylla at different locations
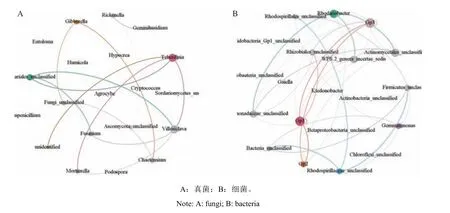
图 5 太子参根际差异微生物共变化网络图Fig. 5 Co-occurrent network of microorganisms in rhizosphere soil of P. heterophylla habitats

图 6 太子参根际土壤微生物群落分布、化学性质和酚酸物质的典范对应分析Fig. 6 Canonical correspondence analysis on community distribution, chemical properties and phenolic acids in rhizosphere soil of P. heterophylla habitats
3 讨论与结论
许多作物都存在连作效应,尤以药用植物表现最为突出,约占70.00%的以根部入药的药用植物存在不同程度的连作效应,如太子参、泽泻、三七、地黄等均存在严重的连作效应问题[16]。根际是土壤与植物根系之间紧密结合的环境,同时也是土壤-根系-微生物三者紧密结合、相互影响的场所[17]。邹立思[10]等研究发现,太子参根际土壤微生物以细菌为主,还包含放线菌及真菌,这与本研究不同样地太子参根际土壤的细菌数目明显多于真菌结论一致。5个样地的优势属中的镰刀菌属(Fusarium)和赤霉属(Gibberella)为常见的真菌致病菌。在药用植物中,镰刀菌成为主要的致病菌对象[18]。薛彩云等[19]研究发现,镰刀菌属对二年生的五味子造成严重的茎基腐病病害,会在生产上造成严重的经济损失。刘西莉等[20]研究发现,镰刀菌可引起严重的根腐病,直接影响麻黄的产量和品质。Chen等[21]、Wu等[22]研究发现,连作太子参根际土壤随着连作年限增加,致病菌镰刀菌数量增高,酚酸混合物可促进镰刀菌菌丝和孢子生长。说明镰刀菌属是引起太子参连作效应的一类致病真菌。如表3所示,5个地区均含有镰刀菌属,但每个地区的镰刀菌丰度有所差别,其中Ⅳ样地的镰刀菌丰度最高,其后依次为Ⅱ、Ⅰ、Ⅴ,Ⅲ样地的镰刀菌丰度最低,且每个样地的镰刀菌含量与其根际土壤其他微生物物种数呈反比,暗示镰刀菌影响太子参根际土壤其他微生物物种数组成,响应太子参的连作效应。赤霉菌属是玉米、水稻和小麦等禾本科植株的主要致病真菌,可导致作物严重减产[23]。目前太子参的连作过程中关于赤霉菌的研究较少,对引起太子参连作效应的致病真菌应引起关注。被孢霉属(Mortierella)和腐质霉属(Humicola)是一种常见的腐生真菌。稻曲菌属(Villosiclava)可侵染水稻小穗引起穗部病害[24]。试验发现5个样地的差异性真菌属为毛壳菌属(Chaetomium)、捷 别 尔 达 孢 属(Teberdinia)、Sordariales_unclassified、田头菇属(Agrocybe)、稻曲菌属(Villosiclava)等。而在真菌菌属共变化网络中,核心菌属是捷别尔达孢属(Teberdinia)、稻曲菌属(Villosiclava)。说明差异菌属在太子参根际微生态环境中起到一定的作用。5个样地太子参根际土壤细菌群落在“属”分类水平的前20种优势菌属中,酸杆菌门的酸杆菌(Gp1、Gp2、Gp3),可以降解植物残体多聚物,参与铁循环和光合作用等,是具有促进作用潜力的一类菌[25]。芽单孢菌属(Gemmatimonas)参与固氮过程[26]。
植物根际微生物的群落构建受到根系分泌物、土壤化学性质等的影响[27]。花生根系分泌物中的苯甲酸增加了根际土壤中伯克霍氏菌的相对丰度[28]。Wu等[29]研究发现,太子参根系分泌物酚酸和有机酸等物质对于其根际土壤微生物群落结构有重要影响。本研究中5个样地的太子参根际土壤微生物群落分布与根际土壤化学性质、根系分泌物酚酸类物质都有一定的相关性。有研究表明,黏质沙雷氏菌可对太子参组培苗产生致害作用,导致根部腐烂和叶片枯萎[30];太子参根系分泌物酚酸类物质促进微生物病原菌黏质沙雷氏菌(Serratia marcescens)生长并使其成为优势菌[31−32]。而此次的测序结果中并未检测到黏质沙雷氏菌,这可能与不同地区的太子参根际土壤微生物存在差异有关。
综上所述,植物根际微生物群落结构及多样性对植物的健康生长有着极其重要的作用。本文通过研究柘荣县5个样地的太子参根际土壤微生物群落结构及多样性,发现不同样地微生物群落结构及组成丰度存在共性及差异性,暗示真菌致病菌镰刀菌属等影响太子参根际土壤微生物结构组成及丰度多样性。同时,太子参根际土壤微生物群落分布受到根际土壤化学性质及根系分泌物酚酸类物质的影响,暗示太子参土壤连作效应很可能归因于根系分泌物参与调控根际微生物菌群结构和多样性演变,导致病原菌增多。所得结果为后续连作太子参根际土壤微生物群落分布、太子参连作效应及相关根际致病菌的研究奠定了一定的工作基础。

