巨尾桉EuDQD/SDH5 基因的克隆与表达分析
王 梅,赵艳玲
(华侨大学化工学院,福建 厦门 361021)
【研究意义】莽草酸脱氢酶(Shikimate dehydrogenase,SDH)催化3-脱氢莽草酸(3-DHS)加氢合成莽草酸(SA)或脱氢形成没食子酸(GA)[1]。脱氢奎尼酸脱水酶(Dehydroquinate dehydratase,DQD)负责催化3-脱氢奎尼酸向3-脱氢莽草酸转化的可逆反应。植物莽草酸途径中的SDH 与DQD 形成二聚体复合酶DQD/SDH[2],这些次生代谢物是木质素、凝聚型丹宁、原花青素类等物质的合成前体[3]。桉树是重要的纸浆材树种,水解单宁占桉木多酚类化合物的5.98%,而缩合单宁占1.91%[4],单宁在酸、碱、酶条件下都不易水解,工业造纸上利用浓硫酸将缩合单宁缩合成不溶于水的分子[5]。开展桉树木材多酚类的分子调控机理研究,对培育低多酚的纸浆林品种、降低造纸污染具有重要意义。【前人研究进展】SDH 家族具有高度保守的α/β 折叠三维结构,因活性位点残基和几何结构的轻微不同而具有不同的底物特异性[6]。在植物中,SDH 通过N 端与DQD 结合,形成DQD/SDH 复合酶。植物中SDH基因的沉默会影响植物茎高生长以及造成芳香族氨基酸缺乏等现象[7]。目前已经分离得到白杨[8]、拟南芥[9]、番茄[10]、烟草[7,11]、葡萄[12]、山茶[13]、赤桉[14]、石榴[15]等植物中的DQD/SDH基因。不同植物因生理特性不同具有不同的DQD/SDH基因种类,目前已发现拟南芥编码1 个DQD/SDH基因[8],白杨编码5 类DQD/SDH基因[8],葡萄、赤桉、石榴、山茶等编码4 类DQD/SDH基因。【本研究切入点】桉树的多酚类物质含量较高,推测桉树SDH基因家族更加复杂,目前已发现4 个桉树SDH家族基因,但与木质素合成相关的桉树SDH研究较少。本研究根据桉树基因组数据分离桉树DQD/SDH基因,通过分析木质素含量不同的转基因桉树植株的DQD/SDH基因表达量,探究DQD/SDH酶与木质素合成的相关性。【拟解决的关键问题】分析巨尾桉SDH 家族EuDQD/SDH5 的酶动力学和表达特性,探究EuDQD/SDH5 与木质素生物合成的关联性,为进一步解析巨尾桉多酚类物质的合成途径提供基础研究数据。
1 材料与方法
1.1 试验材料
野生巨尾桉组培苗[16]、转基因盆栽苗(过表达CuZnSOD 的P40、P41[18],过表达CuZnSOD+反义4CL1基因的F52、F71、F76[19])、大肠杆菌DH5α、大肠杆菌BL21均为华侨大学生物技术实验室保存。pMD-18T Vector、PrimeScript Ⅱ1st Strand cDNA Synthesis Kit、Takara miniBEST Agarose Gel DNA Extraction Kit Ver.4.0、Takra MiniBEST Plant RNA Extraction Kit、One Step SYBR®PrimeScripTMPLUS RTPCR Kit,以及TaqPlus DNA polymerase、BamІ、Hind Ⅲ、DNA ligase 等均购自大连宝生物公司,Poly(A)mRNA 纯化试剂盒购自生工生物工程(上海)股份有限公司,His-tag Protein purification Kit购自常州天地人和生物科技有限公司。其他常规试剂购自厦门绿茵试剂玻仪有限公司。
1.2 试验方法
1.2.1 基因克隆 提取巨尾桉叶片总RNA,具体操作方法参照文献[17]。依据巨桉预测的DQD/SDH基因(GenBank 登录号:XM_010026815.1)设计引物克隆巨尾桉DQD/SDH基因,引物为DQD/SDH5F:5'ATGACTCTCA GCAG CATCCC 3',DQD/SDH 5R:5'-TCAACTGTTCTTCACCAATG 3'。获得的目的片段与pMD18-T Vector 连接,PCR 筛选阳性克隆子。
1.2.2 生物信息学分析 委托华大基因公司测序克隆序列,在GenBank 数据库注册基因序列。通过ExPASy(http://www.expasy.org/)预测DQD/SDH 蛋白质的生物化学性质和功能特征,Swissmodel(http://swissmodel.expasy.org/)预测DQD/SDH蛋白质三级结构,InterProScan(http://www.ebi.ac.uk/ Tools/InterProScan/)预测DQD/SDH 蛋白质家族和功能结构域,利用软件MEGA5.2 构建邻接树。
1.2.3 原核表达载体构建与酶活性测定设计引物EuDQD/SDH5F:5'GGATCCATGACTC TCAGCAGCATCCC 3',EuDQD/SDH5R:5'AAGCTTTCAACTGTTCTTCACCAATG 3',亚克隆获得具有BamH І和Hind Ⅲ酶切位点的阳性PCR克隆质粒,用BamH І和Hind Ⅲ双酶切原核表达载体pET-32a和亚克隆载体,连接目的片段筛选获得pET-EuDQD/SDH5,按照文献[7][11]的方法,通过SDS-PAGE电泳检测IPTG诱导的融合蛋白的表达。收集诱导蛋白表达的菌液,加入4 mL裂解液,悬浮菌体并放置冰中1 h,通过超声波震碎机充分裂解样品,取上清。通过Ni-NTA beads 6FF亲和纯化His6标记的重组蛋白,用250 mmol/L咪唑(pH 8)洗脱His6标记的重组蛋白,利用Bradford法测定蛋白含量。以莽草酸为底物、NADP+为辅因子,在pH 7条件下,分析波长340 nm处NADHP在酶反应5 min内的吸光度变化,采用软件OriginPro 8.5中Michaelis-Menten线性拟合计算最大速率Vmax和米氏常数Km,Kcat/Km评估酶在植物体内的催化效率。
1.2.4 实时定量PCR 利用实时定量PCR(qRT-PCR)检测野生巨尾桉组培苗的3 个植物组织(根、茎、叶)、野生巨尾桉盆栽苗不同节间(第一节、中间节、最低节)的叶片,以及本实验室转化筛选获得木质素含量降低和不变的巨尾桉转基因植株[18-19]的EuDQD/SDH5表达模式。参照Takara MiniBEST Plant RNA Extraction Kit 提取总RNA。以巨尾桉18S rRNA 为内参基因,使用One Step SYBR®PrimeScripTMPLUS RT-PCR Kit 对目的基因及内参基因进行扩增,Eg18S3:5'CATGGCCGTTCTTAGTTGGT 3',Eg18S4:5'TAGCA GGCTGAGGTCTCGTT 3',EuDQD/SDH5(1):5'CCCAATAGCCAAGGCCATAG 3',EuDQD/SDH5(2):5'GCT CCATTTGA AGCTCGGAC 3',反应程序参照文献[17],重复测定3 次,按照相对定量法计算EuDQD/SDH5基因表达量:
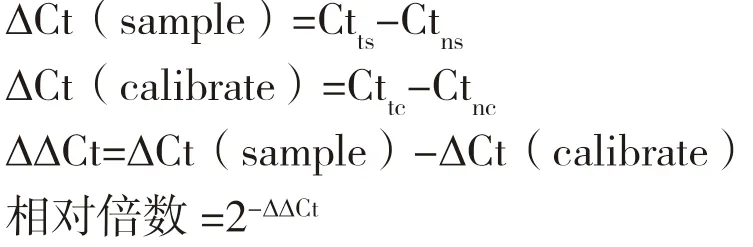
式中,Ctts为实验组目的基因Ct 值,Ctns为实验组内参基因Ct 值;Cttc为对照组目的基因Ct 值,Ctnc为对照组内参基因Ct 值。
2 结果与分析
2.1 巨尾桉EuDQD/SDH5 基因克隆
提取巨尾桉叶片总RNA 并纯化获得mRNA,通过RT-PCR 扩增获得巨尾桉EuDQD/SDH基因如图1 所示,用凝胶回收1 500 bp 处的DNA 片段并与pMD-18T 连接,PCR 筛选阳性克隆子,结果如图2 所示,选择第4、6、9、10 号菌株委托华大基因公司测序,第 6、9、10 号菌株的测序结果和巨桉基因组数据库的预测基因(GenBank 登录号:XM_010026815.1)具有同源性,相似性分别为98.75%、98.94%和98.94%。

图1 RT-PCR 扩增巨尾桉EuDQD/SDH 基因电泳结果Fig.1 Electrophoretic results of RT-PCR amplification of EuDQD/SDH gene from Eucalyptus grandis × E.urophylla

图2 pMD-EuDQD/SDH5 质粒PCR 验证电泳结果Fig.2 Electrophoretic result of plasmids PCR verification of pMD-EuDQD/SDH5
2.2 巨尾桉EuDQD/SDH5 的生物信息学分析
由1 对引物克隆得到3 条同源性极高的同源序列,全长均为1 599 bp,编码532 个氨基酸,分别命名为EuDQD/SDH5-6(GenBank 登录号:KY401151.1)、EuDQD/SDH5-9(GenBank 登录号:KY401150.1)、EuDQD/SDH5-10(GenBank登录号:KY401149.1),其中EuDQD/SDH5-6 与EuDQD/SDH5-10存在7 bp 差异,EuDQD/SDH5-6与EuDQD/SDH5-9存在8 bp 差异,EuDQD/SDH5-9与EuDQD/SDH5-10存在9 bp 差异;3 个基因编码的蛋白分子质量分别为57.24、57.3、57.41 ku,等电点分别为6.83、6.42、6.40。通过在线IterPro预测基因编码蛋白功能,3 个蛋白均具有脱氢奎尼酸脱水酶和NADP+为辅因子的莽草酸脱氢酶功能,包含4 类保守序列:醛缩酶类І 超家族、莽草酸脱氢酶超家族、NADB Rossmann〔Rossmannfold NAD(P)+binding protein〕超家族和DHQD(Dehydroquinate dehydratase)第一类酶。利用Swiss-model 同源建模蛋白三级结构表明,3 种蛋白在结构上属于双功能DQD/SDH,其中SDH 酶通量高于DQD 酶通量。这3 个蛋白除了在二聚体结合位点稍有不同,其中DQD/SDH5-6 由原来的187Glu 替换成186Phe,在辅因子结合位点、底物结合位点的氨基酸残基则完全相同。
利用MEGA5.2 对拟南芥、白杨、葡萄、巨桉等的DQD/SDH 基因建邻接树,结果(图3)表明EuDQD/SDH5-6(简称EU5-6)、EuDQD/SDH5-9(简称EU5-9)、EuDQD/SDH5-10(简称EU5-10)与VvSDH4、EgSDH2基因序列相似性为77%,预测EuDQD/SDH5可能具有典型的DQD/SDH 活性,催化3-DHQ 到3-DHS 的脱水反应以及3-DHS 到SA 的氧化还原反应。

图3 植物DQD/SDH 邻接树Fig.3 Neighbor-joining tree of plant DQD/SDH5
2.3 原核表达载体PET-EuDQD/SDH5 的构建与表达
BamHІ/Hind Ⅲ双酶切包含EuDQD/SDH5-6、EuDQD/SDH5-9、EuDQD/SDH5-10的DNA 序列和原核表达载体PET32a,构建重组载体PETEuDQD/SDH5-6,PET-EuDQD/SDH5-9,PETEuDQD/SDH5-10,双酶切重组载体质粒的电泳结果(图4)表明,在1 500 bp 处有目的基因条带,委托华大基因测序验证,结果表明载体构建成功。
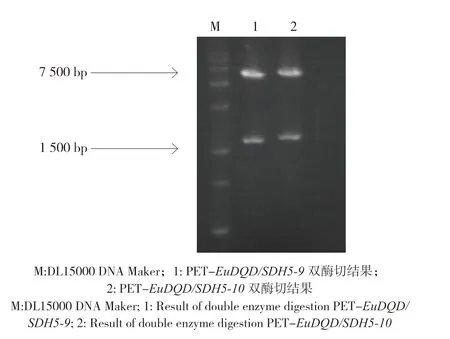
图4 重组载体PET-EuDQD/SDH5 的BamHІ/HindⅢ双酶切电泳结果Fig.4 Double enzyme digestion of recombinant vector PET-EuDQD/SDH5 by BamHІ/Hind Ⅲ
参照文献[8][12]进行ITPG 诱导重组蛋白表达。3 个EuDQD/SDH5基因的开放阅读框为1 599 bp,编码532 个氨基酸,表达57 ku 左右的蛋白,另加表达载体的融合蛋白,预计蛋白条带在60~70 ku 附近,如图5 所示,与对照组相比,在70 ku 附近有明显的蛋白条带,说明目的蛋白在大肠杆菌中有表达。

图5 重组蛋白原核表达的SDS-PAGE 电泳结果Fig.5 SDS-PAGE electrophoretic results of prokaryotic expression of recombinant protein
2.4 重组蛋白EuDQD/SDH5 酶动力学参数的测定
用250 mmol/L 咪唑(pH 8)洗脱His6 标记的重组蛋白,测定辅因子为NADP+、底物为莽草酸(SA)的酶催化反应,从表1 可见,EuDQD/SDH5-9 和EuDQD/SDH5-10 对底物SA 的亲和力较大,且在植物体内的催化效率较高,但EuDQD/SDH5-6 对底物SA 在植物体内的催化效率较低,这可能与其二聚体结合位点的一个氨基酸位置变化有关,由原来的187Glu 替换成186Phe。

表1 EuDQD/SDH5 酶动力学参数(辅因子NADP+、底物SA)Table 1 Kinetic properties of EuDQD/SDH5(co-factor NADP+,substrate SA)
2.5 EuDQD/SDH5 在巨尾桉的表达模式
EuDQD/SDH5的3 个基因存在7~9 bp 的差异序列,生物信息学分析发现在EuDQD/SDH5特异性最强的200 bp DNA 片段中,3 个基因的序列完全相同,因此荧光定量PCR 所检测的EuDQD/SDH5的特异性片段表达量是3 个基因的总表达量。采用2-∆∆Ct相对定量法以18S 为内参基因,荧光定量PCR 技术检测EuDQD/SDH5基因在巨尾桉组培苗不同组织中(根、茎、叶片)的表达模式。EuDQD/SDH5在叶片中表达量最高,茎中表达量稍低,根系表达量最低,叶片表达量约是根部表达量的9 倍。在不同节间叶片中的表达量也有差异(表2),EuDQD/SDH5在上层幼叶中表达量最高,在中间节间和下层叶片中表达量都低,EuDQD/SDH5在上层幼叶中的表达量是其他节间叶片表达量的7 倍左右。

表2 EuDQD/SDH5 基因在巨尾桉中的表达定量分析Table 2 Quantitative analysis of expression of EuDQD/SDH5 gene in Eucalyptus grandis × E.urophylla
EuDQD/SDH5基因属于莽草酸脱氢酶家族的第4 类,属于同一分类的白杨DQD/SDH2(poptr5)主要在木质化组织中表达,可能与木质素的合成相关[8]。利用本实验室转化获得的硫酸木质素含量改变的转基因巨尾桉温室苗植株(过表达CuZnSOD 的P40、P41[18],过表达CuZnSOD+反义4CL1基因的F52、F71、F76[19]),研究EuDQD/SDH5基因在叶片中的表达量变化,以野生型巨尾桉叶片EuDQD/SDH5基因的表达量为对照。其中P40 和F52 的硫酸木质素含量分别比对照增加2%和减少1.07%,P41、F71 和F76 的硫酸木质素含量分别比对照减少55.48%、41.81%、38.68%。从图6 可见,5 株转基因植株叶片的EuDQD/SDH5基因表达量均低于野生株系,其中转基因植株P41、F71 和F76 的EuDQD/SDH5基因表达量均降低,暗示EuDQD/SDH5的低表达可能与木质素的生物合成有关,但是转基因株系F52 中该基因表达量也降低,木质素含量减少较小,说明莽草酸脱氢酶家族有多个酶为木质素生物合成提供前体物质。

图6 巨尾桉转基因植株叶片的EuDQD/SDH5 基因表达分析Fig.6 Quantitative analysis of expression of EuDQD/SDH5 gene in leaves of transgenic Eucalyptus grandis × E.urophylla
3 讨论
Bontpart 等[12]将双子叶植物的DQD/SDH 分成5 类,第4 类是VvSDH4和poptr5,序列相似性为77%。本研究克隆巨尾桉的3 个基因同属于第4 类,都具有典型的SDH 活性,但对底物莽草酸的亲和力不同,其中EuDQD/SDH5-10 对莽草酸的亲和力和催化效率均最高。根据生物信息学分析数据,3 个蛋白在辅因子结合位点、底物结合位点的氨基酸残基完全相同,只有在二聚体结合位点稍有不同,EuDQD/SDH5-6 由原来的187Glu 替换成186Phe,这可能导致EuDQD/SDH5-6 在植物体内的催化效率比EuDQD/SDH5-10 和EuDQD/SDH5-9 低。
巨尾按EuDQD/SDH5在幼叶和茎中的表达量较高,暗示EuDQD/SDH5 在莽草酸合成途径中主要承担生长发育旺盛器官的芳香族氨基酸合成以及酚酸类物质合成等。属于同一分类的白杨的DQD/SDH2(poptr5)主要在木质化组织中表达,可能与木质素的合成相关[8]。葡萄VvSDH4在葡萄生长发育期间表达相对稳定,在葡萄浆果开始着色成熟期之前表达量最高[12]。这些研究结果与本研究中EuDQD/SDH5在巨尾桉中表达量的研究结果相契合。本研究3 个基因在木质素含量低的转基因巨尾桉中的表达量也较低,说明该基因的表达与木质素的合成有一定关联性,但木质素的生物合成途径复杂[20],转基因F52 植株的木质素含量仅降低约1.07%,而EuDQD/SDH5基因表达量降低约63%,这暗示有多个莽草酸脱氢酶为木质素的生物合成提供酚类化合物。
本研究分离的巨尾桉EuDQD/SDH5基因与赤桉EuDQD/SDH2基因相似性为98.81%,赤桉的EcDQD/SDH2 和EcDQD/SDH3 两种酶均可催化依赖NADP+的3-脱氢莽草酸氧化生成没食子酸[14],没食子酸为水解单宁提供酚酸,是赤桉铝离子耐受性高的原因之一。有关莽草酸脱氢酶家族的研究尚处于起步阶段,继续开展DQD/SDH5 催化3-脱氢莽草酸生成没食子酸酶动力学研究,通过该基因在桉树中过量表达或者阻断表达进一步研究该基因的生物学功能,为桉树莽草酸脱氢酶家族的研究提供基础研究数据。
4 结论
本研究分离得到巨尾桉3 个EuDQD/SDH5基因,全长均为1 599 bp,EuDQD/SDH5-6与EuDQD/SDH5-10存在7 bp 差异,EuDQD/SDH5-6与EuDQD/SDH5-9存 在8 bp 差 异,EuDQD/SDH5-9与EuDQD/SDH5-10存 在9 bp差异,EuDQD/SDH5-6 由原来的187Glu 替换成186Phe,但是辅因子结合位点、底物结合位点的氨基酸残基则完全相同。3 个EuDQD/SDH5基因的表达蛋白均具有酶活性,EuDQD/SDH5-10对莽草酸的亲和力和催化效率都最高。巨尾桉EuDQD/SDH5基因在幼叶和茎中表达水平高,推测可能与木质素的合成相关。

